掺杂石墨烯分子印迹传感器对色氨酸的手性识别
周丰,连惠婷,曹学功,刘斌
(华侨大学材料科学与工程学院,福建厦门361021)
掺杂石墨烯分子印迹传感器对色氨酸的手性识别
周丰,连惠婷,曹学功,刘斌
(华侨大学材料科学与工程学院,福建厦门361021)
以掺杂了石墨烯纳米片的壳聚糖为功能基体,L-色氨酸为模板分子,利用恒电位沉积法制备对L-色氨酸具有手性识别功能的分子印迹传感器.采用扫描电子显微镜(SEM)、X射线衍射(XRD)、傅里叶变换红外光谱(FTIR)等方法表征印迹膜的形成过程.探讨印迹传感器的电化学性能,并优化了最优检测条件.研究结果表明:石墨烯掺杂量为1 mg·mL-1,沉积时间为300 s,工作电压为+0.85 V,溶液p H值为6时,所制备的石墨烯-壳聚糖印迹传感器具有良好的手性识别性能,且对L-色氨酸的浓度线性响应范围为0.17~25 μmol·L-1,检测限(S/N=3)达0.04μmol·L-1.
石墨烯;分子印迹传感器;手性识别;色氨酸
色氨酸(Trp)是人体必需氨基酸之一,L/D-色氨酸(L/D-Trp)具有不同的药理作用和用途.L-色氨酸(L-Trp)可用于治疗失眠、焦虑、情绪低落和月经前综合征,但服用非光学纯的L-Trp会引发嗜酸粒细胞增多-肌痛综合征[1].D-色氨酸(D-Trp)可作为非营养性甜味剂,饲料添加剂、植物生长剂,在医药行业中,D-色氨酸是抗癌剂和免疫抑制剂的重要合成前体[2].对色氨酸的手性分离分析,主要采用高效液相色谱[3-5]、毛细管电泳[6-7]和配体交换色谱[8]等方法.这些方法存在分析时间长、仪器昂贵、灵敏度较低等缺点,因此,研究一种简单、快速、低成本和高灵敏度的检测方法是十分必要的.电化学传感器以灵敏度高、响应速度快、小型化等的特点,多用于痕量分析[9],分子印迹技术具有高效,专一性选择识别能力、构效预知性等优势[10-12],广泛应用于诸多领域[13],将分子印迹与传感器技术结合,旨在对手性氨基酸进行识别与检测.但前期实验发现,壳聚糖印迹膜传感器对色氨酸的手性识别灵敏度较低,而石墨烯是现有材料中导电速率最快的材料[14],同时具有大的比表面积和其他优异的物理、化学性质[15-17],可应用于制备敏感分子器件领域以提高其灵敏度[18].因此,本文制备了掺杂石墨烯分子印迹手性传感器,以实现对L-色氨酸的快速选择性检测.
1 实验部分
1.1 仪器和试剂
1)仪器.CHI630a型电化学工作站(美国CH Instruments公司);CHI660D型电化学工作站(上海辰华仪器公司);S-4800型扫描电子显微镜(日本日立公司);X′Pert Pro MPD型X射线衍射仪,(荷兰PA Nalytical公司);Nexus-470傅里叶变换红外光谱仪(美国Nicolet公司);Milli-Q超纯水仪(美国Millipore公司).实验采用三电极体系:工作电极为玻碳电极(直径3 mm)或其修饰电极,辅助电极为铂丝电极;参比电极为饱和甘汞电极(SCE).
2)试剂.石墨烯纳米片(GNS,福建厦门凯纳石墨烯技术有限公司),壳聚糖(CS,脱乙酰度≥75%美国Sigma-Aldrich公司);L/D-色氨酸,苯丙氨酸,酪氨酸、丝氨酸等氨基酸(上海国药集团化学试剂有限公司).实验中其他所用试剂除特殊说明均为分析纯,实验用水为Milli-Q超纯水仪所制备的超纯水.
1.2 壳聚糖-石墨烯贮备液配制
准确称量0.38 g壳聚糖粉末,用0.1 mol·L-1HCl溶解,然后用0.1 mol·L-1NaOH溶液调节至p H值为5.0,配制成7.5 g·L-1的壳聚糖储备液;取0.01 g石墨烯纳米片加入10 m L的壳聚糖储备液中,超声1 h,将其分散均匀,制得壳聚糖-石墨烯储备液,置于4℃冰箱冷藏室贮存.沉积液为含有1.5 mmol·L-1L-色氨酸的壳聚糖-石墨烯的储备液.
1.3 L-色氨酸分子印迹电化学手性传感器的制备
将玻碳电极(GCE)分别用4#,5#,6#的金相砂纸打磨,以获得抛光镜面,用水清洗;然后,依次在1∶1的HNO3溶液和水中各超声清洗5 min.将处理好的电极作为工作电极,置于含1.5 mmol·L-1L-色氨酸的壳聚糖-石墨烯储备液中进行恒电位沉积,沉积电位为-1.1 V,沉积时间为300 s.取出,淋洗晾干,并将L-色氨酸-壳聚糖-石墨烯复合物修饰的电极置于10 m L的0.01 mol·L-1NaOH溶液(含100μL乙醇)中恒电位诱导洗脱1 000 s,洗脱模板分子.然后置于0.5 mol·L-1H2SO4质子化交联10 min,淋洗、晾干.即可制得对L-Trp具有特异性识别位点的印迹手性传感器(MIP/GCE).除不含模板分子的传感器外,其他非印迹传感器(NIP/GCE)的制备条件同印迹传感器的制备流程相同.
1.4 印迹传感器的电化学响应
采用微分脉冲伏安法(DPV)和安培计时法优化实验条件,并测试传感器的性能.DPV扫描范围为0.4~1.1 V(vs.SCE,下同),电位增量为4 m V,振幅为50 m V,脉冲宽度为200 ms,脉冲周期为50 ms.安培计时法工作电压为+0.85 V,支持电解质为0.1 mol·L-1的NaCl,连续加入L/D-色氨酸溶液,进行定量分析.电化学交流阻抗谱(EIS)实验在含5 mmol·L-1[Fe(CN)6]3-/4-的0.1 mol·L-1KCl溶液中进行,测试电压为+0.23 V,频率为0.1~1.0×105Hz,使用Zview软件拟合所得的数据,并模拟出实验所制备的传感器的等效电路图.
2 结果与讨论
2.1 电极修饰过程的表征
2.1.1 电极表面形貌的扫描电镜(SEM)表征 通过扫描电镜(SEM)可对电极表面进行形貌分析,如图1所示.从图1可知:为裸玻碳电极(图1(a)),电极表面呈平整刚性结构;通过电沉积的方法修饰了壳聚糖聚合物膜(图1(b)),其表面呈现伸缩结构[19];掺杂了石墨烯纳米片后,可观察到被壳聚糖附着的石墨烯片层结构,电极表面的空间立体感增强(图1(c)).

图1 电极表面的SEM图Fig.1 SEM images of the electrode surface
2.1.2 电极修饰过程的XRD表征 通过XRD可对电极表面修饰物质进行物相分析,如图2所示.从图2中曲线a可知:电极表面修饰了壳聚糖后,分别在10.1°和20.5°出现了壳聚糖的特征峰[20].从图2中曲线b可知:当电极表面修饰了壳聚糖石墨烯(NIP)纳米聚合物膜时,衍射峰发生位移,从10.1°位移到12.5°,在2θ=26.4°出现了石墨烯的X射线特征衍射峰[21],层面间距约为3.6 nm.26.4°处较宽的衍射峰表明石墨烯纳米片在堆砌的方向上呈无定型结构[22].说明壳聚糖-石墨烯复合物形成了新的晶型结构,石墨烯纳米片外围被壳聚糖包裹着.从图2中曲线c可知:2θ=28.3°对应着L-色氨酸(L-Trp-CSGNS)的衍射特征峰,L-色氨酸同时成功地共沉积到电极表面.实验结果显示:通过电沉积方法,可以直接在电极表面简单合成L-色氨酸-壳聚糖-石墨烯复合膜.
2.1.3 电极修饰过程的FTIR表征 利用傅里叶变换红外光谱,研究修饰膜的形成过程及复合物分子之间的相互作用,如图3所示.从图3中曲线a可知:3 400 cm-1处的宽峰是壳聚糖残糖基上的O-H的伸缩振动吸收峰与N-H伸缩振动吸收峰重叠形成的多重吸收峰,较宽的吸收峰还说明壳聚糖存在分子内和分子间氢键[23].1 641,1 535 cm-1分别为壳聚糖中酰胺键中的C=O双键和氨基中的N-H键特征吸收峰[24].
从图3曲线b可知:石墨烯-壳聚糖(NIP)复合物沉积到电极表面时,C=O键和N-H键特征峰分别从1 641 cm-1位移到1 629 cm-1,以及1 535 cm-1位移到1 521 cm-1处,NIP可能发生氢键作用[25].从图3曲线c可知:加入模板分子后,在指纹区743 cm-1处为L-色氨酸特征吸收峰,并且3 400 cm-1处的峰变得尖锐,L-色氨酸-壳聚糖-石墨烯聚合物膜中,壳聚糖的活性官能团羟基、氨基,可以和色氨酸中的羧基、氨基形成氢键作用[26],从而导致峰形的变化和位移.由红外数据得出,L-色氨酸-壳聚糖-石墨烯复合物存在氢键相互作用.
2.1.4 电极修饰过程的电化学交流阻抗表征 在含5 mmol·L-1[Fe(CN)6]3-/4-的0.1 mol·L-1KCl溶液中,裸玻碳电极和修饰不同聚合物膜后的交流阻抗谱图,如图4所示.从从图4可知:玻碳电极表面通过电沉积修饰了壳聚糖膜(曲线b)和L-色氨酸-壳聚糖-石墨烯聚合物膜(L-Trp-CS-GNS/GCE,曲线d)后,阻抗值明显增大,分别为220.6,238.8Ω,大于裸电极(曲线a)的Ret172.7Ω.这两种修饰膜阻碍了界面电子在电极表面的传递,导致阻抗变大.以掺杂石墨烯的壳聚糖溶液所制备形成的NIP膜电极的Ret为142.7Ω(曲线c),说明石墨烯随电沉积过程沉积到电极表面,有利于界面电子传输.L-色氨酸-壳聚糖-石墨烯聚合物膜经电位诱导洗脱去L-色氨酸模板分子后,在膜上留下了相应的印迹孔穴,更有利于[Fe(CN)6]3-/4-探针在膜电极界面传质,所以相应的阻抗值变小(Ret=53.6Ω,曲线e),明显小于NIP电极的阻抗值.内插图为等效电路模型,说明印迹膜符合电子元件模型.

图3 修饰电极的傅里叶变换红外光Fig.3 FTIR spectra of modified electrodes
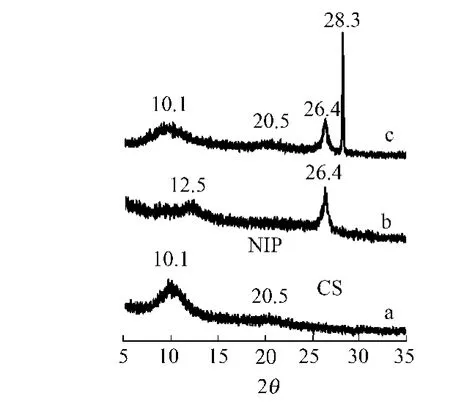
图2 修饰电极的X射线衍射谱Fig.2 XRD patterns of modified electrodes
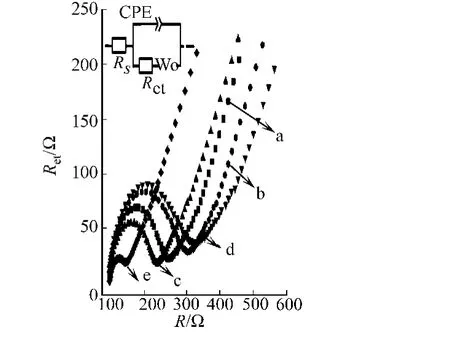
图4 修饰电极的交流阻抗谱Fig.4 Electrochemical impedance spectroscopy of modified electrodes
2.2 实验条件优化
2.2.1 电沉积时间的选择 印迹膜的厚度影响着模板分子的结合位点数量和结合速率,采用恒电位沉积方法制备分子印迹聚合物的过程中,印迹膜的厚度可以由沉积时间控制.通过改变电沉积时间,观察L/D色氨酸在印迹膜上的氧化峰电流比值(IL-Trp/ID-Trp)的变化情况,结果如图5所示.从图5可知:沉积时间较短时,形成的印迹膜较薄,相应的在膜上形成的印迹位点也较少,对L-色氨酸的特异性吸附不明显,膜上的非特异性吸附占据主导作用IL-Trp/ID-Trp较小,识别能力较差;当沉积时间相应延长后,膜的厚度增加,共沉积到电极上的L-色氨酸分子数量增多,膜上印迹位点相应增加,此时对L-色氨酸的特异性吸附作用大于对D-色氨酸的非特异性作用IL-Trp/ID-Trp增大,识别能力提高;但沉积时间太长时,厚膜不利于L-色氨酸进出膜上印迹位点的通道,影响模板分子的完全洗脱和再次识别IL-Trp/ID-Trp又降低,影响印迹膜对L-色氨酸在印迹膜上的对映识别作用.因此,最佳沉积时间选择为300 s.
2.2.2 石墨烯掺杂量的选择 壳聚糖中石墨烯的掺杂量影响印迹膜上印迹位点数量,以及对目标检测物的灵敏度,如图6所示.图6可知:过多或过少的石墨烯都会削弱印迹传感器对色氨酸的手性识别作用.这是因为石墨烯加入量较少时,电沉积修饰到电极上的石墨烯的量也少,印迹膜的空间比表面积没有显著增大,形成对色氨酸的手性识别作用不明显;随着掺杂量的增加,印迹膜的表面明显增大,石墨烯的2D结构也便于模板分子的洗脱及与印迹位点的再结合,因此手性识别能力增强,IL-Trp/ID-Trp提高;当掺杂量达1 mg·L-1时,所制备的L-色氨酸印迹传感器对L/D-色氨酸(10μmol·L-1)响应的比值最大IL-Trp/ID-Trp=2.3,手性识别最为明显;但石墨烯加入量多时,阻碍了壳聚糖与L-色氨酸的印迹位点的形成;当掺杂量达到1.5 mg·m L-1时,IL-Trp变得很小.因此本实验选择最佳掺杂量为1 mg·m L-1.2.2.3 p H值对L-色氨酸测定的影响 采用DPV,测试MIP/GCE对不同p H值的NaCl介质中L-色氨酸(10μmol·L-1)的响应,如图7所示.从图7可知:当p H值由3增至6时,响应电流随之增大,并在p H=6时达最大值,随着p H值进一步增至9时,电流响应却逐渐减小.这是因为色氨酸的等电点为p H=5.89,当p H<5.89时,色氨酸发生质子化而带正电;p H>5.89时,色氨酸失去质子而带负电.印迹聚合物膜中壳聚糖也是带正电荷,更易于带负电的色氨酸相结合,但当溶液中p H值超过6时,溶液中的OH-负离子会与带负电荷的色氨酸分子产生竞争作用,导致色氨酸分子到达电极印迹膜表面的难度加大,响应的电化学氧化峰电流也减小.所以,选择p H=6的NaCl溶液作为分析检测的介质.
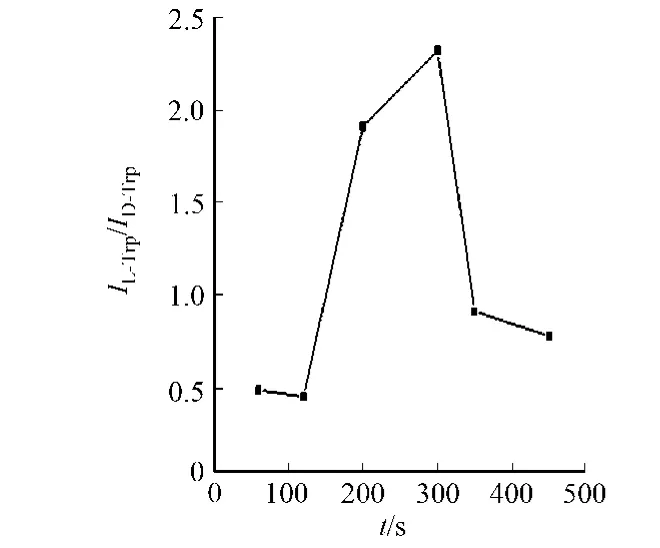
图5 电沉积时间对印迹膜的手性性能识别的影响Fig.5 Impact of electrodeposition time on enantioselective performance of MIP membranes
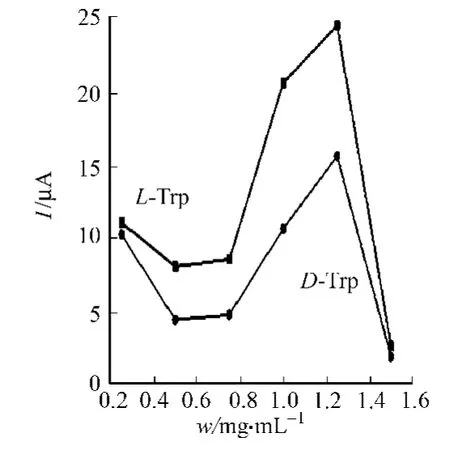
图6 不同掺杂量的石墨烯/壳聚糖的电化学响应Fig.6 Impact of different amount of GNS on electrochemical performance

图7 p H值对印迹电极电流强度的影响Fig.7 Effect of p H values on intensity of MIP/GCE current
2.3 印迹传感器对映选择性识别色氨酸
利用DPV响应电流的大小,来反映印迹传感器的特异性识别效果.将最佳条件下所制备的L-色氨酸印迹传感器,分别浸入含等浓度的L-色氨酸、D-色氨酸的溶液中吸附30 min,然后置于空白的NaCl中考察DPV响应信号,在相同条件下制备非印迹传感器,进行比较实验,如图8所示.从图8可知:L-色氨酸印迹传感器对L-色氨酸的吸附量(曲线a)约为对D-色氨酸(曲线b)吸附量的2.3倍;而非印迹电极对L/D-色氨酸(曲线d,e)而言,在氧化峰电流上没有明显差异,同时吸附到电极表面的色氨酸的量也远远小于印迹电极的吸附的量.说明印迹膜上形成的印迹孔穴相对L-色氨酸分子,无论从空间结构的大小,还是功能基团结合的位置上,它们都是互补的.印迹膜对D-色氨酸的吸附主要是由于膜上的非特异性吸附作用.而在非印迹膜上由于没有形成特定的选择性识别位点,对L/D色氨酸的响应没有明显差别,说明不具有特异性手性识别性能.实验结果反映了L-色氨酸印迹膜传感器对L/D-色氨酸有较好的手性识别作用.

图8 L/D-色氨酸在印迹/非印迹电极上的DPVs响应Fig.8 DPV responses of L/D-Trp on MIP/GCE or NIP/GCE
同样,阻抗谱的阻抗值变化也可反映印迹膜的手性识别,将L-色氨酸印迹膜电极与等浓度的L/D-色氨酸吸附后,再进行交流阻抗谱表征,如图9所示.从图9可知:其阻抗值分别变为89.6,81.8Ω,曲线f,g是与L/D-色氨酸吸附后的阻抗图,它们均比洗脱后的印迹膜电极(曲线e,Ret=53.6Ω)的阻抗大.这说明与L/D-色氨酸吸附后,印迹膜上的印迹孔穴被色氨酸分子占据,从而阻碍了探针进出膜的孔穴,阻抗变大.因为印迹膜对L-色氨酸的空间互补性更强,结合能力更大,所以曲线f阻抗值较大.
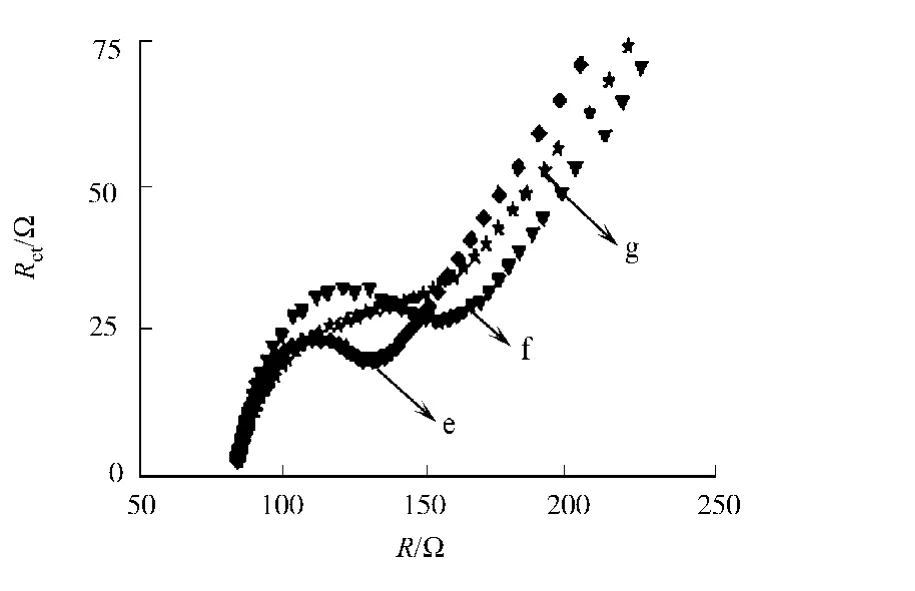
图9 印迹电极吸附L/D-色氨酸后EIS变化Fig.9 EIS changes on MIP/GCE after absorbing with L/D-Trp
2.4 安培计时测量
以p H=6的0.1 mol/L NaCl溶液为支持电解质溶液,利用安培计时法快速检测L/D-色氨酸在L-色氨酸印迹薄膜上的响应,结果如图10所示.从图10可知:在一定的浓度范围内时,L/D-色氨酸的电流响应值都会随着响应溶液的加入而出现阶梯状的递增,但在加入等浓度的L/D-色氨酸时,L-色氨酸的加入引起的电化学信号递增量要大于加入D-色氨酸所引起的递增量.溶液中L-色氨酸通过印迹孔穴在电极表面上发生响应,而D-色氨酸分子与L-色氨酸分子空间三维取向不同,存在着空间位阻,导致了D-色氨酸分子扩散到电极膜上的数量不多,以非特异性吸附为主,所以D-色氨酸的响应信号低很多.而相同条件下制备的非印迹电极上,由于没有印迹位点,与模板分子L-Trp为非特异性识别作用.图10中:曲线c,d,分别为L-Trp和DTrp在非印迹电极上的电流响应.它们的电流变化的几乎没有差别.与印迹电极相比,所得到的电流信号也较小.加入不同浓度L/D-Trp时,在印迹和非印迹电极上产生的电流响应转化成三维柱形图,如图11所示.在加入同一浓度色氨酸溶液时,产生的电流响应a>b>c=d.说明印迹电极对L-色氨酸具有手性选择识别能力.随着加入溶液中色氨酸的浓度不断加大,当浓度大于25μmol·L-1时,响应电流不再随着色氨酸的加入增大反而有所降低,这是由于印迹孔穴逐渐被L-色氨酸填充,吸附趋于饱和,响应电流趋于稳定,如图12所示.在0.17~25μmol·L-1浓度范围内,L-色氨酸浓度与响应电流之间呈现良好线性关系,线性回归方程为(μmol·L-1),Ia=9.53CL-Trp-0.082 8,R2=0.998 4,定量检出下限(S/N=3)为0.04μmol·L-1.
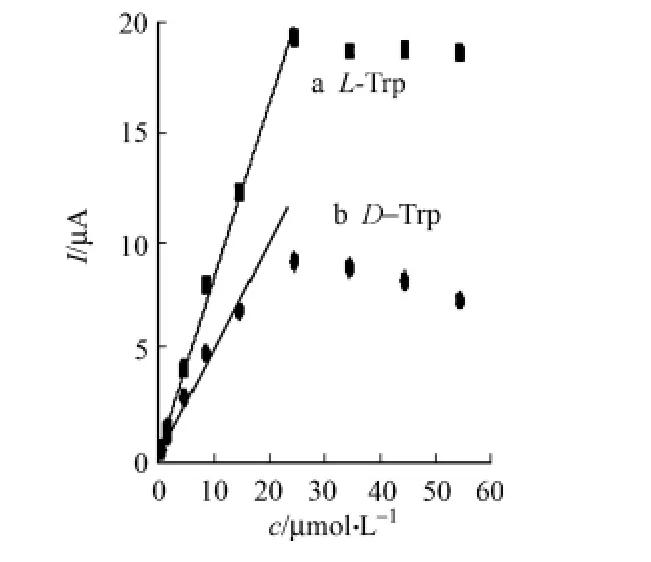
图12 L/D-色氨酸在印迹电极上的校正曲线极上的Fig.12 Calibration curve for L/D-Trp at MIP/GCE
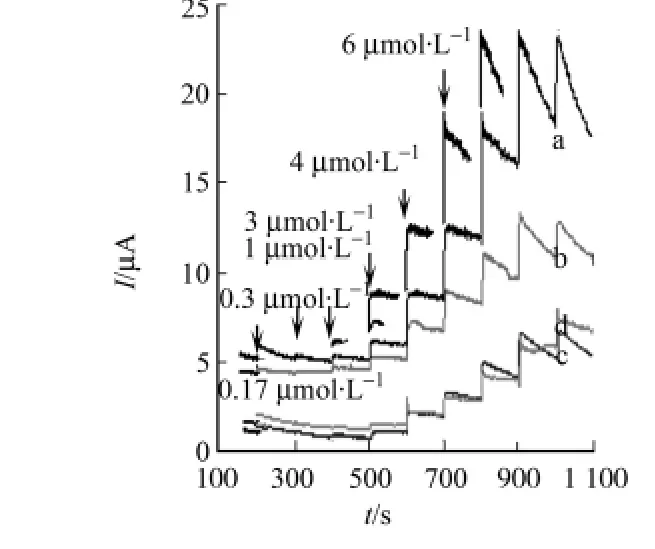
图10 安培计时电流响应图Fig.10 Typical current response(i-t)of MIP/GCE and NIP/GCE

图11 L/D-色氨酸在印迹和非印迹电极上的电流比例关系Fig.11 Current ratio of L/D-Trp at the MIP/GCE and NIP/GCE
2.5 L-色氨酸印迹电极的选择性
利用安培计时法,考察L-色氨酸传感器对其他氨基酸的抗干扰性,待基底电流稳定后,再加入5 μmol·L-1的L-色氨酸,得到电流变化明显的阶梯状曲线,如图13所示.从图13可知:待电流稳定后,再依次加入等浓度的L-酪氨酸、L-丝氨酸、L-苯丙氨酸、D-色氨酸,发现丝氨酸和苯丙氨酸的加入均没有引起电流的变化.但L-酪氨酸和D-色氨酸的加入则引起较为明显的电流变化,这是因为D-色氨酸与L-色氨酸结构相似性产生竞争性结合,而酪氨酸与色氨酸发生电化学氧化的峰电位接近.两者所引起的电流变化量比L-色氨酸的小得多,表明所制备的传感器具有较好的抗干扰性.再次加入L-色氨酸时,其电流变化虽依然比其他氨基酸明显,但比第一次的信号减小了很多.说明其他氨基酸虽然没有发生电化学响应,但也有可能进行非特异性吸附或竞争性占据印迹位点,阻碍模板分子与印迹位点的结合.
2.6 印迹传感器的稳定性和重现性
将制备的印迹电极在10μmol·L-1L-色氨酸溶液中,吸附30 min后,测定其氧化峰电流值.洗脱L-色氨酸后,重复连续使用10次,信号变化如图14所示.图14中:相对标准偏差为4.9%.每天使用一次,连续使用一周后,对L-色氨酸的电化学响应变为原来的88%,结果表明印迹传感器具有较好的重现性和稳定性.
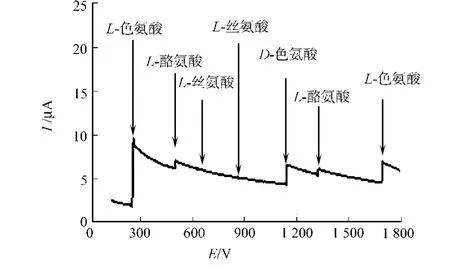
图13 其他氨基酸的电流响应Fig.13 Current responses obtained at the GNS-MIP/GCE for the additions
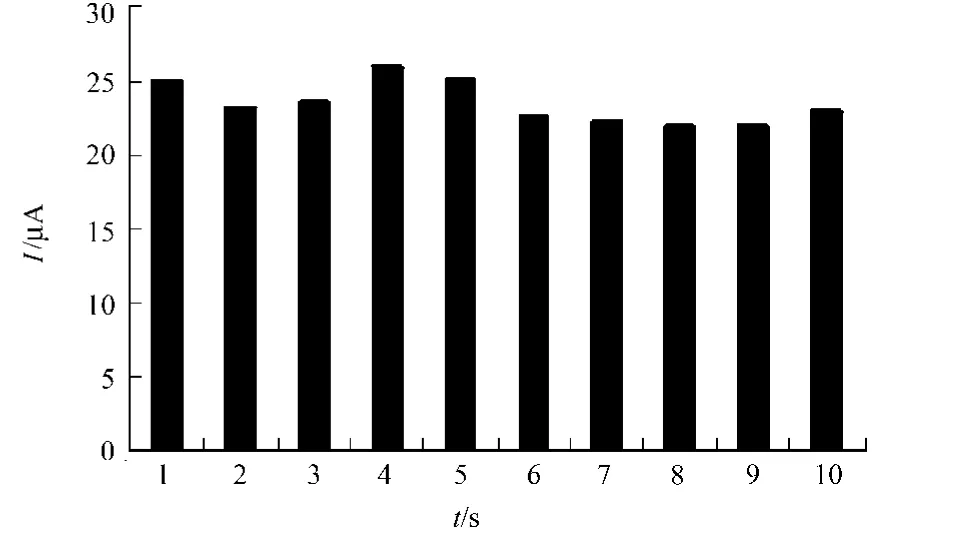
图14 L-色氨酸的响应信号Fig.14 Responses of L-Trp on the MIP/GCE
3 结束语
采用恒电位沉积技术,壳聚糖为功能基体,在玻碳电极表面制备了掺杂了石墨烯纳米片的L-色氨酸手性印迹传感器.所制备的印迹传感器对L-色氨酸具有手性识别性能,对L-色氨酸的微分脉冲响应峰电流是对同浓度D-色氨酸的2.3倍.对结构近似的氨基酸具有较强的抗干扰能力,可应用于色氨酸的快速简便识别.
[1] 郭智成.对美国L-色氨酸事件的回顾和思考[J].医学与哲学,2001,22(8):60-61.
[2] 王大慧,韦萍,欧阳平凯.D-色氨酸研究进展[J].化工进展,2002,21(2):103-105.
[3] 甄乾娜,黄小兰,张晓清,等.高效液相色谱程序波长紫外检测法同时测定血浆中的色氨酸及其代谢物[J].Spzz,2011,29(5):435-438.
[4] Da SILVA M S,VAO E R,TEMTEM M,et al.Clean synthesis of molecular recognition polymeric materials with chiral sensing capability using supercritical fluid technology[J].Biosens Bioelectron,2010,25(7):1742-1747.
[5] 马东杰,许旭,廉伟,等.高效液相色谱法检测胃液中色氨酸和利多卡因[J].分析化学,2009,37(11):1617-1621.
[6] 乔成栋,宋平顺,严祥,等.5种生物胺的毛细管胶束电动色谱分离[J].分析化学,2007,35(1):95-98.
[7] BELIN G K,GARTNER V,SEEGER S.Rapid analysis and sensitive detection of D,L-tryptophan by using shorter capillary column coupled with deep-UV fluorescence detector[J].J Chromatogr B,2009,877(29):3753-3756.
[8] YAN Hang-yan,ROW K H.Enantioseparation condition of D,L-tryptophan using ligand exchange chromatography[J].Indian J Chem A,2008,47(1):75-80.
[9] PRIVETT B J,SHIN J H,SCHOENFISCH M H.Electrochemical sensors[J].Analytical Chemistry,2008,80(12):4499-4517.
[10] CHEN Yang-ping,LIU Bin,LIAN Hui-ting,et al.Preparation and application of urea electrochemical sensor based on chitosan molecularly imprinted films[J].Electroanal,2011,23(6):1454-1461.
[11] 连惠婷,陈娟娟,薛燕,等.久效磷分子印迹传感器的电化学响应特性[J].华侨大学学报:自然科学版,2011,32(2):182-187.
[12] 殷静芬,连惠婷,孙向英,等.尿酸分子印迹电化学传感器的研制及其应用[J].华侨大学学报:自然科学版,2012,33(1):33-38.
[13] VASAPOLLO G,DEL SOLE R,MERGOLA L,et al.Molecularly imprinted polymers:Present and future prospective[J].Int J Mol Sci,2011,12(9):5908-5945.
[14] ZHANG Yuan-bo,TAN Yan-wen,STORMER H L,et al.Experimental observation of the quantum Hall effect and Berry′s phase in graphene[J].Nature,2005,438(7065):201-204.
[15] SHAFRANJUK S E.Electromagnetic properties of the graphene junctions[J].European Physical Journal B-Condensed,2011,80(3):379-393.
[16] MOROZOV S,NOVOSELOV K,KATSNELSON M,et al.Giant intrinsic carrier mobilities in graphene and its bilayer[J].Physical Review Letters,2008,100(1):16602-16604.
[17] GEIM A K.Graphene:Status and Prospects[J].Science,2009,324(5934):1530-1534.
[18] HILL E W,VIJAYARAGAHVAN A,NOVOSELOV K.Graphene Sensors[J].Sensors Journal,IEEE,2011,11(12):3161-3170.
[19] DEMETGUL C,SERIN S.Synthesis and characterization of a new vic-dioxime derivative of chitosan and its transition metal complexes[J].Carbohydrate Polymers,2008,72(3):506-512.
[20] WANG Shao-feng,SHEN Lu,ZHANG Wei-de,et al.Preparation and mechanical properties of chitosan/carbon nanotubes composites[J].Biomacromolecules,2005,6(6):3067-3072.
[21] LI Waoguo,XU Shudong,TANG Min,et al.Direct electrochemistry of horseradish peroxidase on graphene-modified electrode for electrocatalytic reduction towards H2O2[J].Electrochimica Acta,2011,56(3):1144-1149.
[22] NETHRAVATHI C,RAJAMATHI M.Chemically modified graphene sheets produced by the solvothermal reduction of colloidal dispersions of graphite oxide[J].Carbon,2008,46(14):1994-1998.
[23] 蒋挺大.壳聚糖[M].北京:化学工业出版社,2001.
[24] CAO Xiao-ding,DONG Hua,LI Chang-min,et al.The enhanced mechanical properties of a covalently bound chitosan-multiwalled carbon nanotube nanocomposite[J].Journal of Applied Polymer Science,2009,113(1):466-472.
[25] WAN Yi,LIN Zhi-feng,ZHANG Dun,et al.Impedimetric immunosensor doped with reduced graphene sheets fabricated by controllable electrodeposition for the non-labelled detection of bacteria[J].Biosens Bioelectron,2011,26(5):1959-1964.
[26] 农兰平,黄敏,庄玉.L-色氨酸分子印迹壳聚糖膜的制备及透过选择性[J].化学研究,2009,20(3):15-18.
Enantioselective Recognition of Tryptophan Enantiomers by Graphene Doped Molecularly Imprinted Electrochemical Sensor
ZHOU Feng,LIAN Hui-ting,CAO Xue-Gong,LIU Bin
(College of Materials Science and Engineering,Huaqiao University,Xiamen 361021,China)
A novel electrochemical sensor was prepared by graphene-chitosan molecularly imprinted film,which casted on the gassy carbon electrode by electrodeposition,using L-tryptophan(L-Trp)as the template.The prepared film was investigated by scanning electron microscopy(SEM),fourier transform infrared spectroscopy(FTIR)and X-ray diffraction(XRD).The enantioselective performance and the optimal conditions for L-Trp detection were evaluated by electrochemical technique in detail.Under the optimum conditions of 1 mg·m L-1graphene doping concentration,300 s electrodepositing time,the prepared sensor showed a excellent chiral recognition to Trp in p H=6 NaCl solution and linearly selective detection of L-Trp in the range of 0.17~25μmol·L-1was found,with a limit of detection of 0.04μmol·L-1(S/N=3).
graphene;molecularly imprinted sensors;chiral recognitiony;tryptophan
O 657.1
A
(责任编辑:陈志贤 英文审校:熊兴泉)
1000-5013(2012)05-0528-07
2012-04-18
刘斌(1963-),男,教授,主要从事电化学传感器的研究.E-mail:bliu@hqu.edu.cn.
国家自然科学基金资助项目(20955001,21175049);福建省自然科学基金计划资助项目(2011J01049);中央高校基本科研业务费专项基金资助项目(10QZR13)

