木通皂苷D通过丝裂原活化蛋白激酶信号通路促进大鼠骨髓间充质干细胞分化为成骨细胞*
张云辉, 刘成成, 祝爱珍, 陈小宇, 刘革修, 何冬梅, 谭广销
(暨南大学1附属第一医院校门诊部,2医学院血液病研究所,广东广州510632)
木通皂苷D通过丝裂原活化蛋白激酶信号通路促进大鼠骨髓间充质干细胞分化为成骨细胞*
张云辉1△, 刘成成2, 祝爱珍2, 陈小宇2, 刘革修2, 何冬梅2, 谭广销2
(暨南大学1附属第一医院校门诊部,2医学院血液病研究所,广东广州510632)
目的:探讨木通皂苷D(ASD)是否促进大鼠骨髓间充质干细胞(BMSCs)分化为成骨细胞及其机制。方法:分离培养大鼠BMSCs;观察ASD对其向成骨细胞分化的影响以及p38丝裂原激活蛋白激酶(p38 MAPK)抑制剂SB203580和细胞外信号调节激酶(ERK)抑制剂PD098059的干预作用;检测BMSCs分化过程中碱性磷酸酶(ALP)活性和骨钙素(OC)含量;实时荧光定量PCR检测护骨素(OPG)和核因子κB受体活化因子配体(RANKL)mRNA的表达;Western blotting法检测p38 MAPK和ERK活性水平。结果:ASD处理后第9 d,成骨性分化标志物OPG mRNA表达量明显增高,RANKL mRNA的表达量明显降低,同时显著提高BMSCs分化为成骨细胞的ALP活性和OC的表达,而且p38 MAPK和ERK活性也显著增加。SB203580和PD098059则显著抑制ASD的成骨作用。结论:ASD在体外具有促进大鼠BMSCs向成骨细胞分化的作用,这一作用与MAPK途径的p38 MAPK和ERK蛋白有关。
木通皂苷D;间充质干细胞;成骨细胞;分化;信号通路
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)亦称骨髓基质干细胞(bone mar-row stromal cells,BMSCs),主要存在于机体骨髓腔中,具有干细胞特性,具有多向分化能力[1-3]。其向成骨分化特性是骨组织工程、骨折修复和骨质疏松等研究的理论基础。木通皂苷D(Akebia saponin D,ASD)是续断、木通药材的主要活性成分,又称川续断皂苷IV,具有明确的药理活性[4],主要用于制备防治骨质疏松和/或促进骨愈合的药物。有研究表明,ASD可促进成骨细胞增殖、分化,提高成骨细胞的活性和数量,促进基质钙化、骨痂生长,从而防止骨质疏松、促进骨折的愈合[5]。目前研究表明,骨髓间充质干细胞向成骨细胞定向分化,主要通过细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)和p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)信号通路调节成骨细胞特异性转录因子Runx2的转录活性,Runx2则调节下游成骨性标志物的表达,例如护骨素(osteoprotegerin,OPG)、核因子κB受体活化因子配体(receptor activator of nuclear factor-kappa B ligand,RANKL)等,促进MSCs的成骨分化[6-9]。本研究观察ASD是否促进大鼠骨髓间充质干细胞向成骨细胞分化及其对ERK和p38 MAPK活性的影响。
材料和方法
1 材料
4周龄雄性SD大鼠购自中山大学实验动物中心;DMEM培养基、胎牛血清和胰蛋白酶购自Gibco;青霉素和链霉素购自华北制药;细胞裂解液、地塞米松、β-甘油磷酸钠和DMSO购自Sigma;SB203580和PD098059购自Gibco;碱性磷酸酶(alkaline phosphatase,ALP)测定试剂盒购自南京建成生物工程研究所;细胞茜素红钙染色试剂盒购自上海杰美基因医药有限公司;ERK1/2、p-ERK1/2、p38和p-p38抗体购自Santa Cruz。
2 方法
2.1 大鼠骨髓间充质干细胞的分离培养 按照文献[9],取4周龄雄性SD大鼠利用颈椎脱臼法处死,然后用75%乙醇浸泡5 min,在无菌条件下分离出两侧股骨及胫骨,剔除干净表面附着的肌肉、筋膜等组织,剪去股骨近端和胫骨远端,充分暴露骨髓腔,用DMEM完全培养基(含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素)反复冲洗骨髓腔,直至骨髓腔发白,收集细胞转移至15 mL的离心管中,1 000 r/min离心8 min,弃上清,混成细胞悬液,约2 ×106个细胞接种于25 cm2培养瓶中,标记为原代P0,置于37℃、5%CO2的培养箱中培养。24 h后换液以去除未贴壁细胞和各种杂质,加入5 mL新鲜完全培养液。此后每隔2~3 d换液1次,倒置相差显微镜下观察细胞生长状况,直至细胞接近80%汇合时进行传代。此后每隔3~4 d传代1次。取第4代细胞进行MSCs鉴定:成骨分化采用茜素红染色、成脂分化细胞采用油红O染色、流式细胞术检测表面标记CD44和CD45。
2.2 ASD对BMSCs成骨分化的影响 取第4代已鉴定的BMSCs为研究对象,根据不同实验需要将细胞种植于培养皿或培养板中,加入成骨诱导液(含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素、10-8mol/L地塞米松、10 mmol/L β-甘油磷酸钠、50 mg/L抗坏血酸的DMEM低糖培养基)培养。观察不同浓度的ASD对BMSCs成骨分化的影响:实验分6组,A组:空白对照组,正常培养MSCs;B组:实验对照组,成骨诱导分化MSCs;C组:成骨诱导液培养+ASD(0.1 μmol/L);D组:成骨诱导液培养+ ASD(1.0 μmol/L);E组:成骨诱导液培养+ASD(10 μmol/L);F组:成骨诱导液培养+ASD(1.0 μmol/ L)+SB203580(20 μmol/L)+PD098059(50 μmol/ L)。1.0 μmol/L ASD是根据预实验分析得出的实验适合浓度。
2.3 ALP活性的测定 取已鉴定的BMSCs,以1× 108/L的密度接种于96孔板,每孔100 μL,设5个复孔。各组于成骨性诱导培养第3、6、9和12 d测定ALP活性,检测时将细胞洗涤后以0.2%Triton X-100裂解液及反复冻融法充分裂解,裂解液经低温离心机12 000×g离心10 min,取上清50 μL,按试剂盒说明书进行操作,于酶标仪520 nm波长处测定ALP值。ALP活性以mmol·L-1·min-1·(g protein)-1表示。
2.4 采用ELISA法检测骨钙素(osteocalcin,OC)的含量 成骨诱导培养后每3 d换液1次,每次换液时留取1 mL旧培养液,于-20℃保存,收集第3、6、9和12 d各组的样品,采用ELISA法检测骨钙素的分泌量,以μg/L表示,具体操作步骤按试剂盒说明书进行。
2.5 成骨性分化基因表达 收集第12 d各组的细胞,用Trizol试剂按照常规方法抽提总RNA,采用A260/A280比值来确定总RNA的质量,并用2%琼脂糖电泳检测其完整性。应用随机引物和反转录酶试剂盒反转录合成cDNA第1链,按常规方法进行。使用SYBR PremixEx TaqTMReal-time PCR试剂盒配制20 μL PCR反应体系,采用实时荧光定量PCR法检测成骨性基因OPG mRNA、RANKL mRNA表达情况。反应条件为:荧光定量PCR 93℃3 min,然后93℃ 1 min,55℃ 1 min,72℃ 1 min,共40个循环。以目的基因扩增量/内参照(β-actin)基因扩增量表示所要检测基因的表达量。OPG/RANKL mRNA的相对表达量以公式2-ΔCt表示,其中ΔCt=Ct(OPG/ RANKL)-Ct(β-actin)。实时定量PCR引物及探针:OPG:sense strand(5'-3')CGGCACATTGGACATGCTAA;anti-sense strand(5'-3')TCCCGGTAAGCTTTCCATCA;probe(5'-3')FAM-TCACCTTCGAGCAGCTTCGTAGC-TAMRA。RANKL:sense strand(5'-3')CGATGGTGGATGGCTCATG;antisense strand(5'-3')TGAGCAAAAGGCTGAGCTTCA; probe(5'-3')FAM-TTAGATCTGGCCAAGAGGAGCAAGC-TAMRA。β-actin:sense strand(5'-3') GCGCGGCTACAGCTTCA;anti-sense strand(5'-3') TCTCCTTAATGTCACGCACGAT;probe(5'-3')FAM-CACCACGGCCGAGCGGGA-TAMRA。
2.6 Western blotting检测ERK和p38 MAPK的表达及活性 细胞处理48h后,用预冷的PBS洗2遍,加入细胞裂解液,4℃裂解30 min,12 000 r/min离心10 min,取上清液,用BCA蛋白质定量试剂盒进行蛋白定量。50 μg总蛋白经SDS-PAGE分离后,转移到PVDF膜上,50 g/L脱脂牛奶常温下封闭1 h,用Ⅰ抗ERK1/2(1∶1 000)、p38(1∶1 000)、p-ERK1/2 (1∶1 000)、p-p38(1∶1 000)、β-actin(1∶5 000)分别4℃孵育过夜,用TBST洗3次,每次10 min,加入Ⅱ抗(1∶2 500)孵育1.5 h,再用TBST洗3次,每次10 min。将膜用发光试剂ECL显色,暗室曝光,凝胶成像系统分析结果。
3 统计学处理
数据以均数±标准差(珋x±s)表示,采用SPSS 13.0软件处理数据,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 大鼠骨髓间充质干细胞的分离培养
骨髓细胞接种24 h后,大部分细胞仍然悬浮,少量细胞贴壁生长、呈梭形,细胞生长缓慢,2~3 d后增殖加快,7 d左右达融合。通过传代、常规贴壁法分离纯化骨髓间充质干细胞,第3代细胞形态单一,呈梭形,可见集落形成,细胞增生活跃。第4代细胞进行成骨成脂分化鉴定显示可以分化为成骨细胞和脂肪细胞,见图1;流式细胞术检测CD44表达率为93.50%,CD45表达率为0.21%。
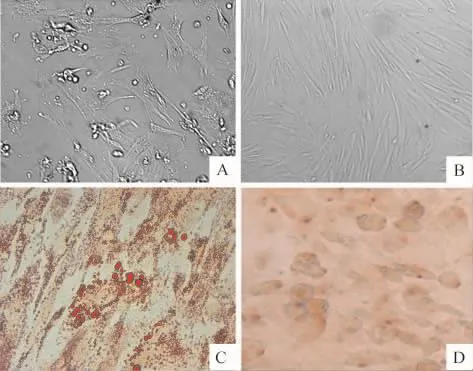
Figure 1. The BMSCs isolated from rat bone marrow(×200).A:the primary cells;B:the fourth generation cells;C: oil red O staining after adipogenic induction of differentiation;D:alizarin red staining after osteogenic induction of differentiation.图1 分离培养的大鼠骨髓间充质干细胞
2ASD对BMSCs ALP活性影响
常规成骨诱导分化的细胞在第3、6、9和12 d均表达ALP,且逐渐增加,其活性与正常MSCs相比差异显著(P<0.01);低剂量ASD对细胞成骨分化则作用不明显,在第3、6、9和12 d ALP活性与常规成骨分化相比无显著差异(P>0.05);中、高剂量ASD则促进MSCs成骨分化,在第3、6、9和12 d ALP活性与常规成骨分化相比差异显著 (P<0.01),中、高剂量ASD之间无显著差异(P>0.05);p38 MAPK抑制剂 SB203580(20 μmol/L)和 ERK抑制剂PD098059(50 μmol/L)则抑制MSCs成骨分化,第3、6、9和12 d ALP活性与其它成骨分化组相比差异显著(P<0.01)。
3 ASD对BMSCs诱导分化过程中OC分泌的影响
A组在第3、6、9和12 d仅有微量OC生成;B组在第3、6、9和12 d OC含量与A组相比差异显著(P<0.01);D组在第3、6、9和12 d OC含量明显增多,与B组相比差异显著(P<0.01);F组在第3、6、9、12 d OC含量明显降低,与B、D组相比差异显著(P<0.01),见图1。这说明1.0 μmol/L ASD对MSCs成骨分化具有促进作用。
4 ASD对 BMSCs诱导分化过程中 OPG与RANKL表达的影响
正常培养的MSCs几乎不表达OPG和RANKL mRNA,成骨诱导分化培养的细胞在第9 d表达了一定量的OPG mRNA和RANKL mRNA,两者比值为1.52±0.45;1.0 μmol/L ASD则可以进一步促进其OPG mRNA的表达,两者比值增加为3.87±1.20,与实验对照组相比差别有统计学意义(P<0.05);而SB203580(20 μmol/L)和PD098059(50 μmol/L)则可显著抑制OPG的表达,两者比值增加为1.13± 0.32,分别与B、D组相比差别有统计学意义(P<0.05),见图2。

表1 ASD对BMSCs成骨分化过程中碱性磷酸酶活性的影响Table 1.Effects of Akebia saponin D(ASD)on ALP activity of BMSCs during differentiation to osteoblasts[mmol·L-1·min-1·(g protein)-1.珋x±s.n=5]

表2 ASD对BMSCs成骨分化过程中骨钙素分泌的影响Table 2.Effects of ASD on osteocalcin secretion of BMSCs cells during differentiation to osteoblasts(μg·L-1.珋x±s.n=5)
5 ASD对BMSCs向成骨细胞分化过程中ERK和p38 MAPK的影响
成骨诱导分化过程中ASD(1.0 μmol/L)处理的细胞不仅表达ERK和p38 MAPK水平总量显著增加,而且p-ERK1/2和p-p38 MAPK也显著增加。SB203580(20 μmol/L)和PD098059(50 μmol/L)则可显著抑制p-ERK1/2和p-p38 MAPK水平,见图3。
讨论
BMSCs具有多向分化潜能,能促进间充质组织的再生,如:骨、软骨、肌肉、韧带、肌腱、脂肪及基质等组织。自体骨髓间充质干细胞移植不会发生免疫排斥反应,但是在骨髓中,BMSCs占骨髓有核细胞总数的0.001%~0.1%,含量极低。因此,体外培养获取骨髓间充质干细胞并诱导分化为成骨细胞,已经成为骨组织工程等的研究热点。
骨组织由细胞和骨基质组成。骨质疏松症是一种系统性骨病,主要是由于成骨细胞形成不足和破骨细胞吸收亢进所致的骨重建失衡。ALP是主要分布于细胞膜的钙结合转运蛋白,一种较为肯定的成骨细胞分化的早期指标,促进细胞成熟、钙化,它的表达和分泌会随着细胞的分化而增强,ALP活性越强表明成骨细胞骨形成的状况越好。骨钙素是骨质钙化必需的因子,维持骨组织的正常矿化。ALP和骨钙素分别是成骨细胞早期和中期分化的标志物。本研究发现,BMSCs用成骨诱导液加1 μmol/L ASD培养,在细胞分化过程中碱性磷酸酶和骨钙素合成较对照组增多,说明ASD可促进BMSCs向成骨细胞分化。研究结果还显示,BMSCs在ASD作用后第9 d,碱性磷酸酶和骨钙素合成最多,说明ASD在细胞内起作用的时间需要9 d左右。
MAPK是一系列丝氨酸/苏氨酸激酶,是介导细胞反应的重要信号系统,包括3个信号途径蛋白: ERK、c-Jun氨基末端激酶(JNK)和p38 MAPK。它们可激活多种转录因子来调控基因表达,在细胞增殖、分化、运动及凋亡等多种生理过程中起着至关重要的作用[10-12]。

Figure 2. Effects of ASD on expression of OPG/RANKL during BMSCs differentiation.A:normal control;B:osteogenic differentiation;D osteogenic differentiation+ASD(1.0 μmol/L);F:osteogenic differentiation+ASD(1.0 μmol/L)+SB203580(20 μmol/L)+PD098059(50 μmol/L).珋x±s.n=5.**P<0.01 vs A group;##P<0.01 vs B group;△△P<0.01 vs D group.图2 BMSCs分化过程中ASD对BMSCs OPG/RANKL的影响
Suzuki等[13]研究发现,以MAPK细胞信号转导通路在成骨细胞的活化中最为重要,MAPK通路主要参与成骨细胞的分化,破骨细胞的形成和凋亡,并且在RANKL/RANK/OPG系统中具有主要的调控作用,是骨质疏松症发病的重要细胞信号途径。
Giner等[14]研究表明,成骨细胞能分泌OPG和RANKL,具有调节破骨细胞分化、发育的作用,其与破骨细胞上的RANK形成了一个骨调节轴,RANK是RANKL的唯一受体,RANK介导的信号是破骨细胞分化、活化的一道关键闸门。OPG抑制骨吸收功能通过与RANKL竞争性结合RANK来实现,其中OPG扮演RANKL的诱饵性受体角色。RANKL与RANK结合后启动 RANKL信号转导,OPG则与RANKL竞争性结合RANK,RANKL/OPG浓度比决定破骨细胞分化、成熟及功能。因此,RANKL、RANK和OPG形成了一个调节破骨细胞分化、成熟、功能的轴,这个调节轴也是影响破骨细胞分化、发育,调节其功能唯一的、最终的途径,在多种骨质疏松中起重要作用。本研究发现ASD可以上调 BMSCs OPG mRNA表达,下调RANKL mRNA表达,使得OPG/ RANKL比值升高;另外,本研究结果发现成骨诱导分化过程中川续断皂苷VI(1.0 μmol/L)处理的细胞表达ERK和p38 MAPK水平总量显著增加,说明ASD可能通过上调OPG/RANKL,使得ERK和p38 MAPK通路蛋白增加,进而诱导BMSCs向成骨细胞分化。

Figure 3. Effects of ASD on expression of p-ERK1/2 and p-p38 MAPK during BMSCs differentiation.A:normal control;B:osteogenic differentiation;D:osteogenic differentiation+ASD(1.0 μmol/L);F:osteogenic differentiation+ASD(1.0 μmol/ L)+SB203580(20 μmol/L)+PD098059(50 μmol/L).珋x±s.n=5.**P<0.01 vs A group;##P<0.01 vs B group;△△P<0.01 vs D group.图3 ASD对BMSCs向成骨细胞分化过程中ERK和p38 MAPK的影响
本研究提示,ASD可以促进大鼠骨髓间充质干细胞向成骨细胞分化,并可以上调OPG/RANKL,增加ERK和p38 MAPK蛋白表达,对于探讨外伤、骨折后利用ASD治疗,促进骨髓间充质干细胞向成骨细胞方向分化,促进骨愈合的机制具有重要意义。
[1]Pileggi A.Mesenchymal stem cells for the treatment of diabetes[J].Diabetes,2012,61(6):1355-1356.
[2]Han R,Kan Q,Sun Y,et al.MiR-9 promotes the neural differentiation of mouse bone marrow mesenchymal stem cells via targeting zinc finger protein 521[J].Neurosci Lett,2012,515(2):147-152.
[3]Zhang LL,Liu JJ,Liu F,et al.MiR-499 induces cardiac differentiation of rat mesenchymal stem cells through wnt/β-catenin signaling pathway[J].Biochem Biophys Res Commun,2012,420(4):875-881.
[4]杨中林.木通皂苷D在制备防治骨病药物中的应用:中国CN1493299A[P].
[5]程志安,吴燕峰,黄智清,等.续断对成骨细胞增殖、分化、凋亡和细胞周期的影响[J].中医正骨,2004,16 (12):1-3.
[6]Chen YJ,Kuo YR,Yang KD,et al.Activation of extracellular signal-regulated kinase(ERK)and p38 kinase in shock wave-promoted bone formation of segmental defect in rats[J].Bone,2004,34(3):466-477.
[7]Dai Z,Li Y,Quarles LD,et al.Resveratrol enhances proliferation and osteoblastic differentiation in human mesenchymal stem cells via ER-dependent ERK1/2 activation[J].Phytomedicine,2007,14(12):806-814.
[8]Yang L,Wang NL,Cai GP.Maohuoside A promotes osteogenesis of rat mesenchymal stem cells via BMP and MAPK signaling pathways[J].Mol Cell Biochem,2011,358(1-2):37-44.
[9]Peng S,Zhou G,Luk KD,et al.Strontium promotes osteogenic differentiation of mesenchymal stem cells through the Ras/MAPK signaling pathway[J].Cell Physiol Biochem,2009,23(1-3):165-174.
[10]Chang L,Karin M.Mammalina MAP kinase signaling cascades[J].Nature,2001,410(6824):37-40.
[11]Han YC,Liu LY,Yan DX,et al.Correlation between expression of P38 MAPK-signaling and uPA in breast cancer[J].Chin J Clin Oncol,2008,5(3):161-164.
[12]Tsubaki M,Matsuoka H,Yamamoto C,et al.The protein kinase C inhibitor,H7,inhibits tumor cell invasion and metastasis in mouse melanoma via suppression of ERK1/2[J].Clin Exp Metastasis,2007,24(6):431-438.
[13]Suzuki A,Guicheux J,Palmer G,et al.Evidence for a role of p38 MAP kinase in expression of alkaline phosphatase during osteoblastic cell differentiation[J].Bone,2002,30(1):91-98.
[14]Giner M,Rios MA,Montoya MA,et al.RANKL/OPG in primary cultures of osteoblasts from post-menopausal women.Differences between osteoporotic hip fractures and osteoarthritis[J].J Steroid Biochem Mol Biol,2009,113 (1-2):46-51.
Akebia saponin D promotes differentiation of bone marrow mesenchymal stem cells into osteoblasts through MAPK signaling pathways
ZHANG Yun-hui1,LIU Cheng-cheng2,ZHU Ai-zhen2,CHEN Xiao-yu2,LIU Gexiu2,HE Dong-mei2,TAN Guang-xiao2
(1Campus Clinic,the First Affiliated Hospital,2Institute of Hematology,School of Medicine,Jinan University,Guangzhou 510632,China.E-mail:z001yh@163.com)
AIM:To explore the role of Akebia saponin D(ASD)in the differentiation of rat bone marrowderived mesenchymal stem cells(BMSCs)into osteoblasts.METHODS:The rat BMSCs were cultured using routine methods.The effects of ASD on the differentiation of MSCs into osteoblasts were observed.The p38 mitogen-activated protein kinase(p38 MAPK)inhibitor SB203580 and extracellular signal-regulated kinase(ERK)inhibitor PD098059 were used to evaluate the mechanisms.The activity of alkaline phosphate(ALP)and content of osteocalcin(OC)were assayed during differentiation.The mRNA expression of osteoprotegerin(OPG)and receptor activator of nuclear factor-κB ligand(RANKL)was determined by real-time fluorescence quantitative PCR.The activity of p38 MAPK and ERK was measured by Western blotting.RESULTS:Six days after treatment with ASD,the mRNA expression of OPG significantly increased,while the mRNA level of RANKL significantly decreased in induced cells.ASD increased the activity of ALP and the content of OC.Moreover,ASD enhanced the activity of both p38 MAPK and ERK,which was inhibited by SB203580 and PD098059.SB203580 and PD098059 also inhibited the positive role of ASD in the differentiation of MSCs into osteoblasts.CONCLUSION:Akebia saponin D significantly enhances differentiation of rat BMSCs into osteoblasts in vitro,which may be mediated by the p38 MAPK and ERK signaling pathways.
Akebia saponin D;Mesenchymal stem cells;Osteoblast;Differentiation;Signaling pathway
R332
A
10.3969/j.issn.1000-4718.2012.08.021
1000-4718(2012)08-1455-06
2012-04-09
2012-06-13
国家自然科学基金资助项目(No.30670902)
△通讯作者Tel:020-85225658-809;E-mail:z001yh@163.com

