腐殖物凝聚分离法在饮用水处理中的运用
张 自 胜
(许昌勘测设计研究院 许昌 461000)
1 腐殖物的类型及危害
1.1 腐殖物的类型
腐殖物属溶解性有机物,主要来源于植物及动物碎屑腐败、生物降解过程,作为植物生物降解过程的最终产物,它们广泛、稳定地存在于天然水、土壤和海洋沉淀中。按照它们的溶解性,腐殖物通常被分成以下4大类:
富里酸类──能够溶解于碱性和酸性的水环境中;
腐殖酸类──能够溶解于碱性和微酸性的水环境中但不能溶解于非常酸的水环境中(pH=2);
Hymanomelanlic acids类──能够溶解于碱性水环境和酒精中;
腐黑土类(humus)──不能溶解于水中。
在天然水环境中,人们通常仅能发现富里酸与腐殖酸,其中主要是富里酸。这些腐殖物平均构成了天然水体 40%~50%的溶解性有机碳源,而在高色度的地面水源中,这一比例有时甚至高达90%以上。
腐殖物是一大类聚合芳香族化合物,碳含量约占整个分子重量的 42%~55%,其余成分主要是氧,另有少量的氢(3%~6%)和氮(1%~5%),它们的分子构造及分子量至今没有精确确定。富里酸的分子量在 500~5000之间,其功能团主要为羧基;腐殖酸的分子量在 105~5000之间,主要为酚基功能团。
1.2 腐殖物的危害
腐殖物给饮用水带有感官上不受欢迎的色度,同时它们是许多有害的化学物质的先兆物。在氯的预氧化及消毒过程中,腐殖物能够导致形成一些具有致癌、致畸变特性的氯的衍生物(如Trimalomethanes,Chloropicrine,Dichloroacetic Acid 和 Trichloroacetic Acid等)。由于腐殖物的离子交换及络合能力,它们构成大多数有毒物质(重金属,杀虫剂等)的载体,这些物质的形成给人体的健康带来潜在的危害。
另一方面,它们的存在同时也给水处理工艺带来许多问题。腐殖物能够吸附在胶体和悬浮物(黏土、细菌、病毒、藻类等)的表面,促进系统的稳定性和处理的难度。此外,去除溶解性的富里酸、腐殖酸较之去除无机的胶体及悬浮物更为困难。未能有效去除的腐植物在供水管网中形成软垢,被管网中的余氯缓慢氧化,转化成可生物降解的物质,为细菌的滋生提供了条件。在饮用水活性炭吸附工艺中,腐殖物与其它要处理的微量化合物(杀虫剂、嗅和味以及一些工业微污染物)竞争,大大降低了活性炭的工作寿命,同时还可能造成活性炭微孔堵塞。在工业水处理中,它们是造成膜或离子交换树脂不可逆堵塞的主要原因,在很大程度上降低了这些装置的产水能力。因此,开展有效去除水中腐植物的专题研究对于改善提高供水水质、保障公众健康及优化水的深度处理具有重要的意义。
2 腐殖物的凝聚分离
天然水中的溶解性有机物可分为憎水性及亲水性有机物,而其中又以具有憎水特性的腐殖物类物质为主,如富里酸和腐殖酸(Thurman,1985;Edzwald,1993)。国外进行的许多研究(包括本文作者在国外的研究)表明:这些憎水性的溶解性有机物能够通过混凝-絮凝及随后的固液分离过程被去除。去除效率主要取决于源水性质、腐殖物的类型、混凝剂种类、凝聚的物理化学条件(pH值、混凝剂投加量、原水的硬度和碳酸氢盐碱度等)和后续的分离过程等。以下将对这些方面的研究结果进行简要的介绍。
2.1 腐殖物的类型与去除
腐殖物的去除效率随腐殖物的分子量的分布大小而变化,在溶解性的腐殖物类中,分子量高的组分有较强的憎水性,能够较容易的通过凝聚分离的方式将它们去除。
在几乎所有对腐殖酸与富里酸的去除对比试验中都观察到,腐殖酸较富里酸容易去除,所需的混凝剂投加量较低,而色度及总有机碳(TOC)的去除率较高。对于腐殖酸的凝聚分离,色度去除率与TOC去除率通常是近似相等的;而对于富里酸的凝聚分离,色度去除率通常明显高于TOC的去除率,一定比例的溶解性有机物不能通过混凝、沉淀的方式去除,腐殖酸的凝聚分离较富里酸更加有效。
SUVA=UV/TOC (m-1/mg/L)
在波长254nm下的紫外吸收值(用UV或UVA表示)能够较好度量水中芳香族化合物,通常可利用这一特点来测定水中的腐殖物。Edzwald等人(1993)提出了利用比吸收值(SUVA)来测定溶解性有机物的憎水性的概念,比吸附值被定义为单位浓度的总溶解有机碳(TOC,mg/L)所具有的紫外吸收值(m-1)。当SUVA值介于4~6.5之间时,水中的溶解性有机物主要是富里酸和腐殖酸,这些溶解性有机物具有较多的芳香族化合物构造并具有较强的憎水性,有机物的分子量也较大,通过适当的凝聚分离,70%以上的DOC能够得到去除。当SUVA值小于3时,水中的溶解性有机物主要是一些非腐殖物类的有机物,这些有机物相对而言是亲水性的,具有较少的芳香族化合物构造并具有较低的分子量,凝聚分离工艺难以将它们去除。
Lefebvre等人(1990)使用铁盐对从不同水源提取的腐殖物进行试验,在相同的水样TOC试验浓度条件下,TOC的去除率从总体上来说随水样色度增大而增加,亦即随水样中具有较高分子量的芳香族化合物所占比例的增大而增加。
2.2 pH值和混凝剂投加量对腐殖物去除的影响
与黏土类悬浮物的去除相比,pH值和混凝剂投加量对腐殖物的混凝、絮凝的影响要大得多。对于一个给定的水源,相对于一个混凝剂投加量,腐殖物脱稳通常仅发生在一个较为狭窄的 pH值范围,以至于有时不易观察到腐殖物的絮凝现象(尤其是使用阳离子高分子聚合物作为混凝剂或腐殖物浓度相当低时)。只有适宜地选择这一对物理化学参数,才能获得满意的凝聚分离效果。
对于腐殖物的凝聚分离,pH值和混凝剂投加量是两个最重要的影响因数(这里所指的 pH值系混凝剂投加后的 pH值)。许多的研究者对这两个影响因数进行了研究,涉及不同地区及不同类型的水源,研究中使用了多种混凝剂(如硫酸铝、三氯化铁、聚合氯化铝和一些阳离子高分子聚合物等),表1总结了这方面的一些研究结果。
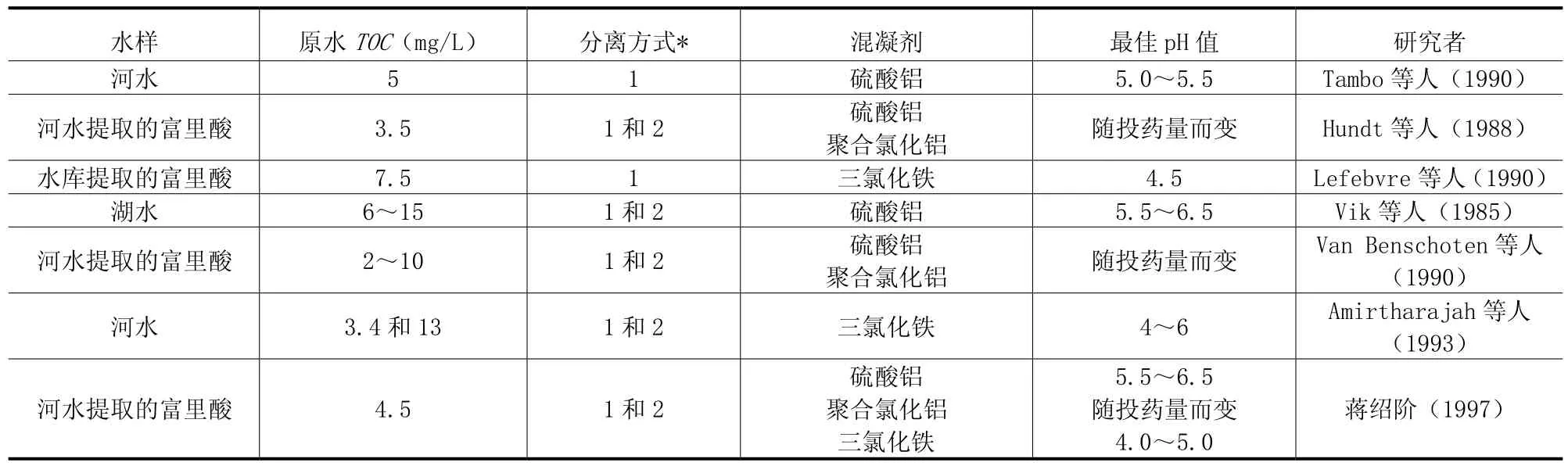
表1 不同研究者提出的最佳pH值比较
从表 1我们能够看到,就腐殖物凝聚的最佳pH值而言,相同混凝剂下的研究结果并不一定存在一致性。这种现象可能是起因于:(1)实验中所使用的腐殖物的浓度和类型不同;(2)混凝剂投加量的不同;(3)实验条件的差异。一些研究者观察到混凝剂和碱(或酸)的投加顺序影响实验结果,但另一些研究者却没有发现这一投加顺序的影响。在本文作者的研究中,碱的投加顺序对腐殖物使用三氯化铁混凝有影响,先投加碱将增加三氯化铁的需要量,同时降低腐殖物的去除效率。然而,碱的投加顺序对腐殖物使用铝盐混凝的影响并不明显。凝聚-沉淀后的水样在测试前是否经过滤纸(孔径通常为0.45μm)过滤也会影响实验结果。此外,表1中一些最佳pH值是在单一混凝剂投加量或较少变化的混凝剂投加量下获得的。但是大多数的研究者观察到腐殖物脱稳的 pH值区域随着混凝剂投加量的增加向高pH值方向移动。
尽管不同条件下的研究结果有所差异,但通过表1所给出的不同研究者的实验结果,我们可以从总体上得知:(1)铁盐或铝盐对腐殖物进行混凝宜在酸性条件下进行,使用铁盐时的最佳 pH值较使用铝盐时低;(2)当使用铁盐作为混凝剂时,腐殖物凝聚的最佳pH值范围通常在5以下;(3)当使用硫酸铝作为混凝剂时,腐殖物凝聚的最佳pH值范围通常在5.5~6.5之间。
2.3 混凝剂的选择和利用
本文作者(1997)所进行的研究结果表明:最常用的几种无机混凝剂,如硫酸铝、三氯化铁和聚合氯化铝都可以有效地用于腐殖物的凝聚分离,根据原水水质合理选择混凝剂的类型及在使用中对凝聚的物理化学参数的控制是取得良好凝聚效果的关键。三氯化铁适宜在较低的 pH值下使用,并具有良好的凝聚分离效果,通过混凝-沉淀,高达80%的腐殖物能够得到去除。对于高色度,低浊度且低碱度的原水(如一些湖泊,水库水源),三氯化铁可被考虑是最佳的选择,不需另投加酸,pH值在混凝剂投加后将降至合适的范围,所需的投药量也较低。加碱调节出水 pH值应在固液分离完成后进行。然而,在较高的原水碱度下,铁的需要量将因太高而不经济。
对于色度,碱度都较高的原水,硫酸铝可被认为是适宜的选择。pH值在5.5~6.5的范围内,腐植物的去除率是较高的,混凝剂的需要量也相对较低。在pH值低于5.5的情况下,硫酸铝与腐殖物形成的絮体较细,沉淀分离效果较差,并且由于氢氧化铝在此 pH值范围内溶解度较高,处理后的水中的溶解铝含量存在超标的危险。聚合氯化铝是一种高效的无机混凝剂,能够用于相当宽的pH值(4~9)范围,并且自身在被投加后,较少引起原水的pH 值的变化,易于运行管理,它尤其适合碱度及pH值高的原水。如果在此条件下使用三氯化铁或硫酸铝,所需要的混凝剂量将很高,处理后的水质也较差。
有机阳离子聚合物也可有效地用于腐殖物的脱稳、凝聚,但难以形成可沉淀分离的絮体。使用阳离子聚合物的一个最大优点是它们形成的絮体总体积小,絮体的强度也较高,适用于含有中等浓度溶解性有机物、低浊度的原水的直接过滤。尽管无机铁盐、铝盐对腐殖物有较好的凝聚特性,但它们与腐殖物形成的絮体总体积大,絮体的强度也较低,当用于这种原水的直接过滤时,滤床易过早发生絮体穿透。
3 结论和建议
腐殖物广泛地存在于天然地面水体中,尤其是湖泊、水库水源。腐殖物的存在给饮用水水质带来诸多问题,也给水处理工艺带来较大的难度。有效地去除饮用水中的腐植物对于改善提高供水水质、保障公众健康及优化水的深度处理具有重要的意义。
凝聚分离技术是从水中去除溶解性的腐殖物的一个有效方法。掌握原水中腐殖物的凝聚特性,根据本地原水水质合理选择混凝剂的类型及腐殖物凝聚的物理化学参数,是取得良好凝聚效果的关键。
我国多年来水处理行业的一个主要方向是解决供水量的问题,对确保供水水质方面考虑不够。近年来,随着人们对供水水质要求的提高,改善供水水质是广大市民所关心的问题(如对直接饮用水的要求)。在给水处理中,水的生物处理和深度处理正日益受到国内研究人员的注意。然而,作为天然水中最重要的溶解性有机物、腐殖物的危害及处理方法并未得到应有的重视。尽管腐殖物的凝聚分离在国外已取得了较大进展,但这一处理技术与胶体及悬浮物的去除无论从机理上还是从工艺上都存在着相当大的区别,腐殖物的凝聚分离理论及处理技术存在着不少问题,而我国在这一方面的研究几乎处于空白。因此,结合我国水源的水质特点,开展腐殖物去除的研究工作,应是摆在我国水处理领域今后的一项重要的研究课题。
1 蒋绍阶. Etude de l’élimination de l’acide fulvique par coagulation-floculation ou filtration contact: 法国贡比涅理工大学博士论文,1997.
2 Amirtharajah A, Dennett K E, Studstill A, Ferric Chloride Coagulation for Removal of Dissolved Organic Matter and Trihalomethane Precursors. Wat. Sci. & Tech., 1993,27(11):113-121.
3 Dempsey B A,Ganho R M,O’Melia C R. The CoagulationOf Humic Substances by Means of Aluminum Salts. J. Am. Wat. Wks.Ass,1984,76(4):141-150.
4 Edzwald J K,Becker W C,Tambini S J. Organics,Polymers and Performance in Direct Filtration. J. Envir. Engng.Div. ASCE, 1993,113(1):167-185.
5 Eikebrokk B. (1996)Removal of Humic Substances by Coagulation.Chem. Wat. & Wastewat. Treat Hahn, H H,Hallvard, φ. (Eds),Springer-Verlag Berlin, Heidelberg, 173-187.
6 Lefebvre E et Legube B. Coagulation par Fe(III)de substances humiques extraites d’eaux de surface: Effet du pH et de la concentration en substances humiques, Wat. Res., 1993,24(5):591-606.
7 Tambo N, Kamei T. (1989)Evaluation of Extent of Humic-Substance Removal by Coagulation, Aquatic Humic Substances: Influence on Fate and Treatment of Pollutants,Suffet, I. N. and MacCarthy, P. (Eds), Am. Chem. Soc.,Washington, 456-3-471.
8 Thurman E M. Developments in Biogeochemistry: Organic Geochemistry of Natural Waters, Nijhoff, M. (Ed), Junk,Dordrecht.
9 Van Benschoten J E,Edzwald J K. (1990)Chemical Aspects of Coagulation Using Aluminum salts—II. Coagulation of Fulvic Acid Using Alum and Polyaluminum Chloride, Wat. Res,1985,24(12):1527-1535.
10 Vik J E. et al Removing Aquatic Humus from Norweigian Lakes. J. Am. Wat. Wks. Ass, 1985,77(3)58-66.

