用于大容量人源天然噬菌体抗体库的表达载体的构建及鉴定
潘 博 付文卓 王晓娜 张宝中 米志强 安小平 刘大斌李 存 姜焕焕 陈 斌 童贻刚*
(1.军事医学科学院微生物流行病所国家重点实验室,北京100071;2.中国农业大学动物医学院国家海绵状脑病实验室,北京100193;3.首都医科大学医学实验与测试中心,北京100069)
噬菌体抗体库技术的发展和应用为抗体技术领域带来了巨大的变化,已被广泛应用于生物学、医学等各个研究领域,通过基因工程和噬菌体展示技术的结合,能得到人源化的针对几乎所有抗原表位的抗体,这极大地推动了各种性能优良抗体及多功能抗体融合蛋白的开发和应用[1-3]。噬菌体抗体库模拟了天然抗体库,使得人们可以不经过复杂的免疫过程,而是直接利用抗原就可以从抗体库中筛选出特异性抗体成为可能。它既解决了人源性单克隆抗体的来源困难、人体杂交瘤系统的低效及鼠单抗的动物源性等难题,也使得单克隆抗体的制备变得简单易行,稳定有效,使人单克隆抗体的制备有了突破。但是,此技术目前还有许多问题尚待解决,如在保证抗体库的多样性和呈现效率的同时,如何提高有效库容量、如何在构建抗体库时提高抗体基因的连接效率问题上,还有待进一步解决。为了克服这些问题,本研究拟在本室多年抗体工程研究的基础上,构建含自杀基因的新型、高效抗体库表达载体pDF-D-SacB。
1 材料与方法
1.1 菌株、质粒
噬菌体VCSM13、BSl365菌、表达载体pDF由海军总医院周丽君教授馈赠;Puc19-SacB质粒由军事医学科学院疾病预防控制所黄留玉研究员馈赠;带有抗乙肝病毒表面抗原人Fab段基因的质粒B4HFLF由本室保存。
1.2 主要试剂
Phusion,BssH Ⅱ,Xba Ⅰ,Nco Ⅰ,NheⅠ,BglⅡ,碱性磷酸酶,由美国New England Biolabs(NEB)公司生产;EcoR Ⅰ,DraⅠ,T4 DNA Ligase,T4 Plolynucleotide Kinnase(PNK)由日本TaKaRa中国大连分公司生产;EasyPure Plasmid MiniPrep Kit,EasyPure Quick Gel Extraction Kit由中国北京全式金生物有限公司提供;5000 DNA Marker,DL2 000 DNA Marker由中国北京博迈德科技有限公司生产。
1.3 引物设计及合成
为了提高轻链抗体基因连接效率,设计了2条引物来改造原始噬菌粒载体pDF上用以连接轻链抗体基因的酶切位点BssHⅡ,其新的酶切位点为BglⅡ,同时设计用于克隆SacB自杀基因的引物序列来构建抗体库载体,具体引物序列详见表1,以及用于克隆抗乙肝表面抗原抗体的引物序列,具体引物详见表2,所有引物均由上海生工生物工程技术服务有限公司合成。

表1 引物序列Tab.1 Primers
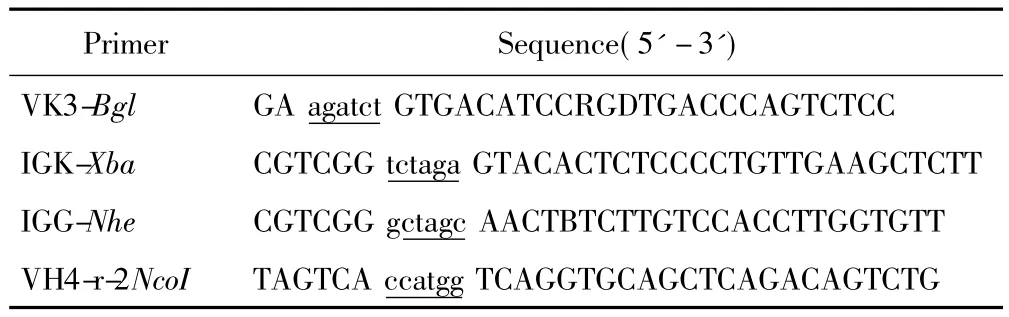
表2 引物序列Tab.2 Primers
1.4 表达载体pDF-D-SacB的构建
1.4.1 验证SacB的自杀功能
从平板上挑取携带有pUC19-SacB质粒的单克隆至3 mL含有氨卞抗性液体LB培养基中,在37℃摇床中220 r/min振摇10 h至对数生长期;取上述菌液200 μL分别加入到预先准备好5 mL含有氨卞抗性液体LB培养基和含有氨卞抗性及5%蔗糖液体LB培养基2支试管中,在37℃摇床上220 r/min振摇5 h,将2支试管的菌液分别从10-1稀释至10-9,各取每个稀释梯度的菌液5 μL,加入到预先准备的含有氨卞抗性固体LB培养基平板上相应的格子中,放入37℃温箱中,次日观察结果。
1.4.2 构建质粒pDF-D-SacB
以Puc19-SacB为模板,pDF-BssH和pDF-R-Xba为引物,进行PCR扩增获得轻链区域SacB基因并纯化回收,用BssHⅡ和XbaⅠ进行酶切,与同样经电泳分离、纯化、酶切的PSGX载体用T4 DNA连接酶16℃连接,连接物转化感受态细菌,铺盘挑取单集落,提取质粒DNA,以HindⅢ内切酶鉴定阳性克隆PSBX;再用BssHⅡ50℃酶切质粒PSBX 3.5 h后,加入1 μL CIP,温度降至37℃酶切1 h后进行回收。将引物DDTB-F和DDTB-R 各取 2 μL,加 H2O 到总体积为 20 μL,放入PCR仪中由98℃ ~20℃进行退火,取出17 μL与10×T4 DNA Ligase Buffer 2 μL 混合,再加入1 μL T4 Plolynucleotide Kinnase,37℃反应30 min,而后70℃反应10 min,将两者进行常规连接、转化、挑克隆后,用BglⅡ与EcoRⅤ鉴定,获得阳性克隆PSGX;再以Puc19-SacB为模板,引物pDF-Nco和pDF-R-Nhe进行PCR扩增获得重链区域SacB基因并纯化回收,用NheⅠ和NcoⅠ进行酶切,与同样经电泳分离、纯化、酶切的PSGX载体用T4 DNA连接酶16℃连接,常规转化、铺盘、挑取单集落,提取质粒后用EcoRⅠ对重组子进行酶切鉴定,获得噬菌粒载体pDF-D-SacB。
1.5 构建重组质粒pDF-SacB-HBsL和pDFSacB-HBsH
以质粒B4HFLF为模板,用表1、表2中的两组引物PCR分别扩增抗乙肝表面抗原抗体的κ链、Fd段基因,反应条件为:95℃热启动2 min;95℃变性20s,65℃退火20s,72℃延伸l 5s,35个循环后72℃延伸5 min。将轻链和重链PCR产物用凝胶电泳分离、纯化后分别用BglⅡ、XbaⅠ和NcoⅠ、NheⅠ双酶切4 h,与同样经电泳分离、纯化、酶切的pDF-D-SacB载体用T4 DNA连接酶16℃连接16 h,转化感受态大肠杆菌Trans1-Blue而后铺板,分别用该4种酶进行酶切鉴定;挑取含有适当表达载体的单集落Trans1-Blue菌,接种到含100 μg/mL氨苄青霉素和10 g/L葡萄糖的LB培养基中,37℃震荡培养过液,取30 μL过夜菌接种到3 mL含100 μg/mL氨苄青霉素的SB培养液,37℃震荡培养至A600约为0.5,加入20 μL辅助噬菌体VCSM13。30℃震荡培养过夜,次日离心收集上清,取10 μL适当稀释的上清样品,与100 μL对数增长期的 Trans1-Blue菌混合,室温孵育30 min,铺含Amp的LB盘,37℃培养过夜,次日计数,估算滴度。
1.6 抗体基因的细胞内重组
挑取单集落BSl365菌,在含有50 μg/mL卡那霉素和10g/L葡萄糖的2YT培养基中生长至对数生长期(A600=0.5)。通过滴度测定,将上述两种噬菌体上清以相同的滴度混合,以20个噬菌体颗粒∶1个细胞的比例感染BS1365菌,37℃温育60 min,加入Amp补至100 μg/mL,30℃振摇过夜。次日取过夜培养菌加入到3 mL含Amp的2TY培养液中,37 ℃培养至 A600=0.5,加入20 μL VCSM13,37 ℃震荡培养过夜。次日离心回收上清,测定噬菌体滴度,将噬菌体感染对数生长期的大肠杆菌Trans1-Blue,铺含Amp的培养盘,37℃ 培养过夜,次日挑取单个集落,扩增培养,提取质粒,通过内切酶谱进行分析鉴定。
1.7 用酶联免疫吸附剂测定方法检测噬菌体
将乙肝表面抗原以pH9.8的碳酸盐缓冲液稀释至 7.62 μg/mL,以 50 μL/孔包被 ELISA 板,4 ℃ 过夜,次日弃去孔内液体,以12%的脱脂牛奶100 μL 37℃封闭2 h后,PBST洗涤5次,加入待测噬菌体抗体样本及对照,37℃孵育2 h后,再以PBST洗涤5次,加入3∶1 000稀释的HRP-羊抗M13(Pharmacia),37℃孵育2 h,最后PBST洗涤5次后加OPD底物显色,读取A450值。
2 结果
2.1 验证SacB基因的自杀活性
在含有Amp抗性液体LB培养基中生长的大肠杆菌,在10-1~10-5均有克隆,且10-1~10-3稀释倍数克隆无法计数,在10-4有86个单克隆,在10-5有11个单克隆;而在含有Amp抗性及5%蔗糖液体LB培养基中生长的大肠杆菌10-1~10-5均无克隆。表明大肠杆菌在是否含蔗糖的培养基环境里,生长相差5个数量级,说明PUC19-SacB质粒带有自杀功能,详见图1和图2。

图2 带有PUC19-SacB质粒的大肠杆菌在Amp平板上的生长的情况Fig.2 The growth condition of E.coli with PUC19-SacB plasmid on Amp plate
2.2 新型噬菌体抗体表达载体pDF-D-SacB的构建
首先构建PSBX质粒,随后又改变其酶切位点构建了PSGX质粒,最后用本室发明的回收方法[4]对SacB基因进行回收,得到了SacB基因后(图3),以内切酶NcoⅠ和NheⅠ分别对PSGX和SacB基因进行酶切,随后进行连接、转化并随机挑取10个单克隆提取质粒,利用内切酶EcoRⅠ进行鉴定(图4)。

图3 PCR扩增SacB基因纯化回收Fig.3 PCR products of SacB gene and purification

图4 EcoRⅠ酶切鉴定1%凝胶电泳图Fig.4 1%agarose gel electrophoretic profile of digestion of clone with EcoR I
2.3 pDF-D-SacB细胞内重组
为了鉴定pDF-D-SacB能否在表达Cre蛋白酶的细菌内发生loxp和loxp511介导的重组,分别构建了仅含抗HBsAg的轻链和重链的质粒pDF-SacBHBsL和pDF-SacB-HBsH,并用DraⅠ酶切鉴定(图5、图6),分别制备含有2者的 phagemid-噬菌体上清,等量混合后,以20个病毒颗粒∶1个细胞感染可表达Cre蛋白酶的细菌BS1365,使多副本载体进入同一个细胞,载体之间发生重组,获取重组后的质粒,进行内切酶谱分析。这2种载体经Cre-Loxp介导的重组后,应产生4种不同载体,除2种亲本载体外,还有同时含有轻重链的pDF-HBsH-L和无抗体基因的pDF-D-SacB。一共进行了9次重组实验,鉴定了180个克隆,所获4种载体的比例大体符合随机重组的规律。

图5 DraⅠ酶切鉴定1%凝胶电泳图Fig.5 1%agarose gel electrophoretic profile of digestion of clone with Dra Ⅰ
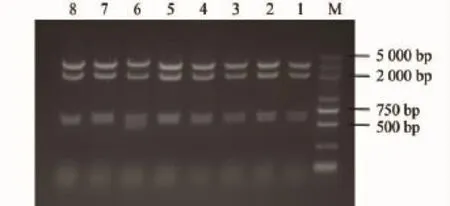
图6 DraⅠ酶切鉴定1%凝胶电泳图Fig.6 1%agarose gel electrophoretic profile of digestion of clone withDraⅠ
2.4 pDF-D-SacB载体表达活性的鉴定
为了鉴定新构建的pDF-D-SacB载体是否能表达功能性的噬菌体抗体,利用经重组后得到的质粒pDF-HBsH-L,用其表达噬菌体抗体,并以未插入任何基因的原始质粒pDF载体所表达的噬菌体蛋白作为阴性对照,ELISA检测其与HBsAg的结合活性,读取各孔450 nm处的吸光值,结果详见表3。pDFHBsH-L所表达的蛋白经10倍稀释后测得的每组数值之间差异有统计学意义(P<0.01),即随着蛋白浓度的下降A450值也呈现递减下降,说明抗原与样品之间的结合是特异性的;而阴性对照pDF所表达的蛋白经10倍稀释后测得的每组数值之间差异无统计学意义,即随着蛋白浓度的下降A450值未呈递减下降,呈现无规律性,且 3,4,5,6,7 组 A450 值均低于0.1,说明抗原与样品之间的结合是非特异性的。
表3 2种样品浓度10倍递减稀释Tab.3 Two kinds of sample concentration decreasing diluted 10 times (±s)
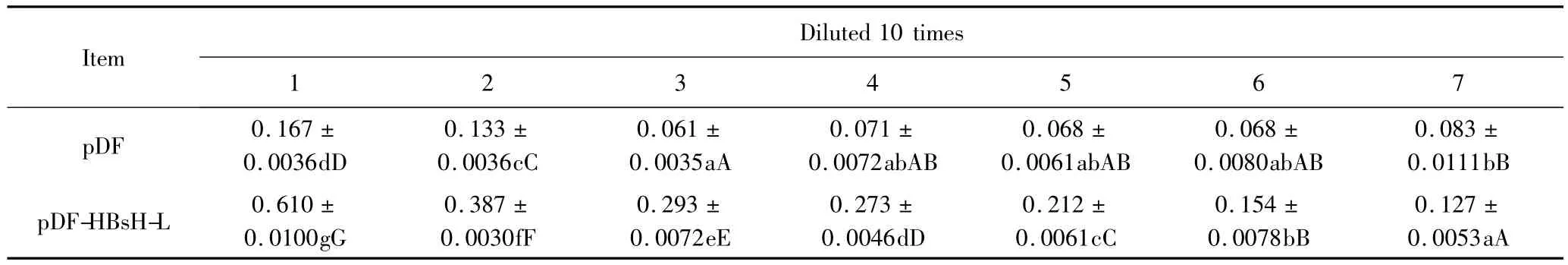
表3 2种样品浓度10倍递减稀释Tab.3 Two kinds of sample concentration decreasing diluted 10 times (±s)
The results presented as mean±standard deviation,means in the same row with completely different capital letters are significantly different(P<0.01),with the small letters are significantly difference(P<0.05).
Item Diluted 10 times 1 2 3 4 5 6 7 pDF 0.167±0.0036dD 0.133±0.0036cC 0.071±0.0072abAB 0.083±0.0111bB pDF-HBsH-L 0.610±0.0100gG 0.061±0.0035aA 0.387±0.0030fF 0.293±0.0072eE 0.068±0.0061abAB 0.068±0.0080abAB 0.273±0.0046dD 0.212±0.0061cC 0.154±0.0078bB 0.127±0.0053aA
2.5 大容量噬菌体抗体库表达载体pDF-D-SacB的鉴定
本实验构建pDF-D-SacB噬粒载体后,将抗乙肝表面抗原的抗体轻、重链基因分别克隆于该载体构建两个初级质粒,而后经重组得到噬粒载体pDF-HBsHL,再将其转化大肠杆菌后,以噬菌体VCSM13进行拯救,得到含有抗乙肝表面抗原的Fab段噬菌体抗体。我们利用该抗体与乙肝表面抗原作结合活性分析,并用未插入任何基因的原始噬粒pDF所表达的蛋白作为阴性对照,分别进行10倍的递减稀释作ELISA检测。实验结果显示,包被的乙肝抗原量不变,将抗乙肝表面抗原抗体轻、重链基因插入到噬粒载体pDF-DSacB中,其pDF-HBsH-L噬粒表达的噬菌体蛋白与乙肝表面抗原的结合能力,要远高于未插入任何基因时原始噬粒pDF所表达的噬菌体蛋白与乙肝表面抗原的结合能力(在每一对比组中,阳性都远高于阴性),且随着特异性pDF-HBsH-L噬菌体抗体浓度的降低A450值均会下降,该值的下降程度大致呈现有规律的递减一次函数;而未插入任何基因的原始噬粒pDF所表达的蛋白与乙肝表面抗原的A450值则基本趋于0.1以下。理论上,由于pDF所表达的蛋白不与乙肝表面抗原相结合,递减稀释pDF所表达的蛋白与乙肝表面抗原结合能力应保持在同一数值;但实验数据显示,在阴性对照pDF中,第7组A450值要略高于对比组3、4、5和6(对比组A450值也呈现一定的递减趋势),而低于对比组1和2,其原因可能是由于在噬菌体纯化物中存在大肠杆菌残体,而菌体中可能含有内源性HRP,使得对照组出现较低程度的非特异性着色,当倍比稀释至102,其非特异性着色降至显色剂本底着色OD值0.1以下。
3 讨论
抗体工程领域中最突出的研究进展就是噬菌体抗体库技术,该技术的出现开创了一条简便、快捷的基因工程抗体生产路线[5]。本课题组在国内外噬菌体抗体库技术进展的基础上,构建了一个适用于大容量噬菌体抗体库的表达载体pDF-D-SacB,它具有以下特点:
3.1 在抗体库载体轻、重链区域插入自杀基因
枯草芽孢杆菌中的果聚糖蔗糖转移酶催化以蔗糖为底物合成果聚糖的反应,其SacB基因编码的蛋白为分泌型的蔗糖果聚糖酶,此酶能催化蔗糖,水解产生葡萄糖和果聚糖[6]。尽管枯草芽孢杆菌SacB基因导致许多革兰阴性菌和革兰阳性菌死亡的原理尚不清楚,但基因SacB已经被用于克隆研究,而且也获得了SacB基因转化的烟草、番茄、杨树[7]。基于这种特性,SacB基因赋予细胞的蔗糖敏感特性作为一种阴性筛选克隆的标记,在生物研究中特别是在基因克隆等遗传操作中有着广泛的应用[8]。Fab抗体库的质量很大程度上取决于抗体基因的插入效率,而在大多数情况下,抗体基因的插入效率并不很高,这样就会产生很多的无效克隆,而轻链或重链中的任何一个位置没有抗体基因插入都会导致克隆的无效,这样就会大大增加无效克隆的比例。为了克服这一问题,本研究组拟在本室多年抗体工程研究的基础上,采用可诱导的自杀基因和以国内自主构建且普遍使用的基于pDAN5[9]的抗体库表达载体pDF为骨架,构建新型、高效的pDF-D-SacB表达载体。在抗体轻链和重链的克隆位点分别引入SacB自杀基因,以此作为反向筛选基因,当抗体基因插入自杀载体后,自杀基因便失去功能;而没有插入抗体基因的自杀载体,表达自杀基因的革兰阴性菌,在含有蔗糖的培养基中生长时,会将蔗糖分解为对细菌有毒的产物,从而杀死表达自杀蛋白的细菌。因此,SacB作为反筛基因常与抗性基因等正向筛选基因联合,用于构建细菌的无痕缺失突变株。用这种方法构建的抗体库,不仅容量大,而且质量更高,理论上可以得到近于100%的有效克隆,以避免无效克隆的产生。
3.2 选择了更合理的抗体基因克隆位点
随着抗体胚系可变区基因序列的阐明,本课题组目前广泛应用于噬菌体抗体库中的表达载体内切酶位点的选择并不合理,因此本课题组在pDF-D-SacB中选用了抗体胚系可变区基因中不存在的内切酶位点,以保证内切酶序列不会影响到成熟抗体分子氨基端的序列。除此之外,PCR产物及噬菌粒载体两端酶切位点的酶解效率直接影响到抗体基因的连接效率,进而影响整个抗体库的质量。在原噬菌粒载体pDF上用于连接轻链抗体基因的酶切位点BssHⅡ和XbaⅠ,酶切温度分别是50℃和37℃,所用Buffer的离子浓度也相差甚远,在构建噬菌体抗体库的试验过程中显示,酶切噬菌粒载体和抗体基因时,难以控制酶切的时间及酶的用量,且酶切不完全,连接效率低下,若要保证抗体库的容量和多样性,则必须进行多次酶切、连接和转化,致使工作量大大地增加。为了能够解决这一问题,通过借鉴本室对于酶切位点改造的研究[10]以及大量的实验摸索,用上述方法将酶切位点BssHⅡ改为BglⅡ,从而极大地提高了抗体基因的连接效率,减少了工作量。
综上所述,pDF-D-SacB在构建后经检测,具有正常的噬菌体抗体表达功能,能够在分泌Cre细菌中发生Cre-LoxP介导的同源重组,为大容量噬菌体抗体库的构建提供了有效工具;本实验的数据能够支持对表达载体pDF-D-SacB用于构建大容量噬菌体抗体库的定性分析,其定量分析还有待进一步研究。
[1]Kim S H,Hwang S Y,Lee Y S,et al.Single-chain antibody fragment specific for Plasmodium vivax Duffy binding protein[J].Clin Vaccine Immunol,2007:726-731.
[2]杜东霞,吴剑,李小曼,等.噬菌体抗体库淘筛方法的比较研究[J].现代生物医学进展,2009,9(4):730-732.
[3]潘博,童贻刚.噬菌体抗体库技术及其应用研究进展[J].生物技术通讯,2010,21(4):581-585.
[4]朱晓峰,安小平,陈锦辉,等.一种简便、高效、经济的从凝胶中回收DNA的方法[J].生物技术通讯,2006,17(4):603-604.
[5]Griffiths A D,Duncan A R.Strategies for selection of antibodies by phage display[J].Curr Opin Biotechnol,1998,9(1):102-108.
[6]Irani V R,Lee S H,Eckstein T M,et al.Utilization of a ts-sacB selection system for the generation of a Mycobacteriu-m avium serovar-8 specific glycopeptidolipid allelic exchange mutant[J].Ann Clin Microbiol Anti-microb,2004,3:18.
[7]Quénée L,Lamotte D,Polack B.Combined sacB-based negative selection and cre-lox antibiotic marker recycling for efficient gene deletion in pseudomonas aeruginosa[J].Biotechniques,2005,38(1):63-67.
[8]Mizoguchi H K,Tanaka-Masuda K,Mori H.A simple method for multiple modification of the Escherichia coli K-12 chromosome[J].Biosci Biotechnol Biochem,2007,71(12):2905-2911.
[9]Sblattero D,Bradbury A.Exploiting recombination in single bacteria to make large phage antibody libraries[J].Nat Biotechnol,2000,18(1):75-80.
[10]Zhang B Z,Zhang X,An X P,et al.An easy-to-vse sitedirected mutagenesis method with a designed restric-tion site for convenient and reliable mutant screening[J].J Zhejiang Univ Sci B,2009,10(6):479-482.

