不同AMF菌剂对白三叶草坪的扶壮作用
王 立,徐亚男,马 放,张淑娟,张 雪,李 哲
(哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨)
丛枝菌根(Arbuscular mycorrhiza,AM)是自然界中普遍存在的丛枝菌根真菌(Arbuscular Mycorrhizal Fungi,AMF)和植物形成的互惠互利共生体,世界上90%以上的植物种类都能形成AM[1].绝大多数维管植物理论上都可以用作AMF菌剂生产的宿主植物,如高粱、洋葱、大麦、玉米、苜蓿、三叶草、花生、棉花、芦笋、百喜草、苏丹草等[2],AMF能促进宿主对土壤中矿质元素磷、氮、钾、铜、锌等的吸收,提高宿主根系对根部病菌的抵抗力,增强植物对干旱、高温、重金属的抗性,促进宿主植物的生长[3],广泛应用于农牧、园艺[4]、林木[5-6]、药材[7-8]、土壤修复[9-11]等方面,依托AMF的优良特性,作为草坪草养护管理的微生物菌剂,具有广阔的应用前景.
白三叶草的叶色、花色美观,绿色期极长,可连续利用6~7年甚至10年,是优良的绿化观赏草坪种.其根系具有很强的分蘖能力和再生能力,侧根密集,蓄水保土作用明显,适宜在坡地、堤坝湖岸种植,防止水土流失.但其对营养物质要求较高,需在扶壮过程中追施氮、磷等化学肥料[12],一方面增加养护难度和费用,另一方面极易造成面源污染,影响生态环境质量,成为白三叶草坪应用推广的限制因素.针对这一问题,选用摩西球囊霉(Glomusmosseae)、根内球囊霉(Glomus intraradices)两种性能优越的土著广适菌种,分别探讨单独施加和混合施加与白三叶草的共生关系,以及AMF菌剂对白三叶草的生长效应与营养吸收的促进作用,得到有效促进白三叶草坪生长的最佳AMF菌剂,为以后菌剂在白三叶草坪养护、管理中的应用提供理论依据.
1 试验
1.1 材料
试验地点设在城市水资源与水环境国家重点实验室实验田.位于黑龙江省双城市前进乡的大田试验基地(E:125°41'-126°42',N:45°08'-45°43');土壤中水解性氮质量分数为108.22mg/kg,有效磷424.77mg/kg;试验所用AMF菌剂为摩西球囊霉(Glomus mosseae,GM)、根内球囊霉(Glomus intraradices,GI)和两种菌剂的混合菌(GM+GI);受试草坪草宿主为白三叶草(Trifolium repens).
1.2 试验田设计
小区均为边长8m的正方形,面积为64m2,于小区中间6×6=36m2内的正方形中进行实验设置,最外围2m为保护区及保护行,每块试验田均为边长6m、深度20cm的立方体,实验前于底部铺设1cm厚细沙,覆安全网(既可以渗水又可用于阻断试验土壤与自然土壤的接触,且方便灭菌),覆土.
1.3 试验方法
1.3.1 大田灭菌
每平方米土壤施用150mL福尔马林(每块试验区施加150×6×6=5400mL),拌匀,盖膜,连续每天采集土样,采用平板计数法,分别使用孟加拉红培养基和普通培养基培养真菌和细菌,直至真菌基本不长、细菌少量存活时揭膜,7d后待福尔马林挥发尽后播种.
1.3.2 AMF接种方法
采用条播的方法于土壤中接种AMF菌剂(每垅30g)及白三叶草种子,每个小区20垅,播种间距1cm,实验田的设置分别为:不接菌,接种GM、GI,两种菌的混合菌(GM+GI),每个处理3个重复.
1.3.3 菌根依赖性计算
接种70 d后,从每块试验田随机抽取20株,于每株苗上随机剪取5条营养根,并剪为2 cm长的根段,混匀,从中拣取 60段,应用酸性品红染色法进行染色,在高倍光学显微镜下检验菌根侵染情况,得到侵染率.AMF侵染率=(侵染根段数/观察根段数)×100%.
植物的地上菌根依赖指数IMPD(Mycorthizal Plant Dependence)、地下菌根依赖指数IMFD(Mycorthizal Foot Dependence)及植物菌根依赖指数IMD(Mycorthizal Dependence)计算如下:
IMD=(施加菌剂后的植株总生物量/不施加菌剂时植株总生物量)×100%;
IMPD=(施加菌剂后的植株地上生物量/不施加菌剂时植株地上生物量)×100%;
IMFD=(施加菌剂后的植株地下生物量/不施加菌剂时植株地下生物量)×100%.
根据Nemec[13]的分类方法,将植物对菌根的依赖度分为3级,菌根依赖指数IMD=300%时为高强度依赖性,IMD=200%时为中等强度依赖性,IMD=100%时为弱依赖性或无依赖性.
1.3.4 AMF对植物生长的影响
分别测量不同接菌处理时白三叶草的株高、地上及地下生物量,并与空白试验作对比,阐述AMF对植物生长的影响,计算植物菌根依赖指数.
1.3.5 AMF对根际土壤营养元素的影响
采用碱解-扩散和碳酸氢钠法分别对根际土壤中的水解性氮、有效磷进行测定,并计算利用率,以空白对照(CK)的利用率为100%.
菌剂处理后植物对根际土壤中水解性氮的利用率=[(不施加菌剂时根际水解性氮含量-施加菌剂后根际水解性氮含量)/不施加菌剂时根际水解性氮含量×100%]+100;
菌剂处理后植物对根际土壤中有效磷的利用率=[(不施加菌剂时根际有效磷含量-施加菌剂后根际有效磷含量)/不施加菌剂时根际有效磷含量×100%]+100.
1.4 数据分析
试验数据采用Spss17.0进行单因素ANOVA统计分析.
2 结果与分析
2.1 菌根依赖性研究
植物菌根依赖性是判断植物对AMF的依赖程度及AMF对植物促进效果的重要指标.实验表明,选用的两种AMF均能有效侵染白三叶草,形成菌根共生体,但不同菌剂对白三叶草的侵染率不同(图1).
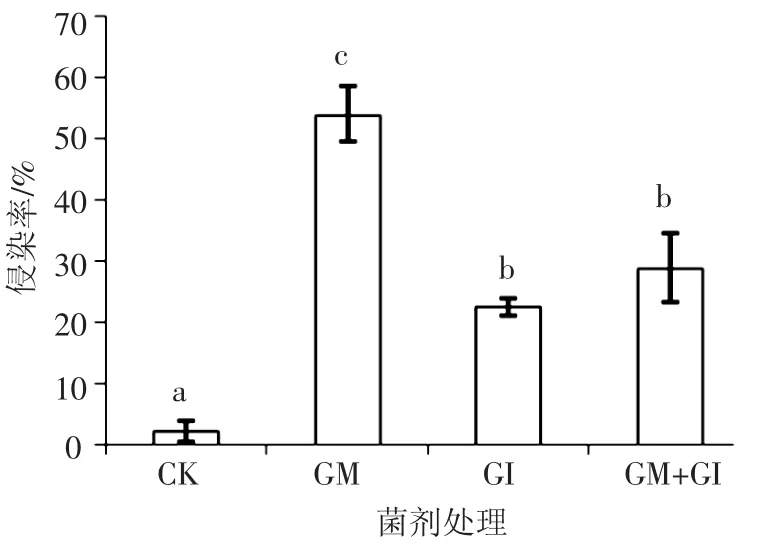
图1 AMF对白三叶草的侵染效果
自然条件下,不施加菌剂的处理(CK)中,AMF的侵染率很低(2.09%).与CK相比,施加菌剂可显著提高AMF对白三叶草的侵染作用(P<0.05).其中,摩西球囊霉对白三叶草的侵染效果最优,侵染率可达53.84%,显著高于根内球囊霉的侵染率(22.37%)(P<0.05).两种菌剂混合施加的侵染效果居中(侵染率28.78%),显著低于摩西球囊霉的侵染率,高于根内球囊霉,但与其差异无统计学意义.结果表明,摩西球囊霉对白三叶草的侵染效果最佳,单菌(GM)的侵染效果优于混菌.
AMF对植物的侵染作用可有效改善白三叶的生长状况,其表现为白三叶草不同营养器官(地上、地下)对AMF的菌根依赖性(图2).
将不施加菌剂的对照处理(CK)植物的菌根依赖指数设为100%(IMD=100%),与CK相比,施加不同菌剂可显著提高植物的菌根依赖性(P<0.05).其中,施加单菌时,摩西球囊霉(IMD=144%)、根内球囊霉(IMD=162%)二者的效果相当,差异无统计学意义.而施加两种菌的混合菌时明显优于单菌,且效果显著(P<0.05)(IMD=249%),说明植物对混菌的菌根依赖性强于单菌(图2(a)).
与对照相比,施加菌剂可显著提高植物地上、地下部分的菌根依赖性(P<0.05)(图2(b)).其中,白三叶草地上部分对混菌的依赖性(IMD=308%)显著高于对单菌的依赖性 (IMD=180%),为高强度依赖.白三叶草地下部分对AMF菌剂的依赖性,混菌与单菌效果相当,差异无统计学意义.白三叶草地上部分对菌剂的依赖性最强,且明显高于地下部分.
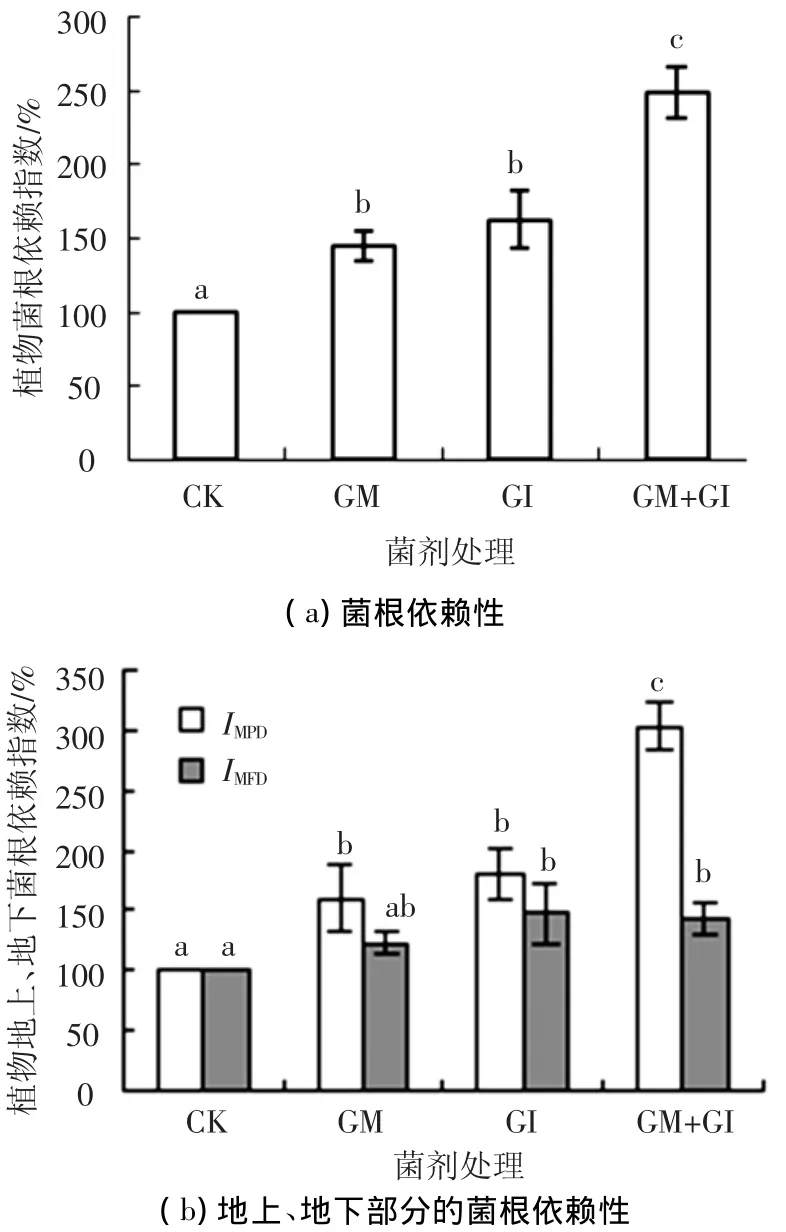
图2 白三叶草的菌根及其地上、地下部分的菌根依赖性
2.2 AMF对植物生长的影响
植物株高、生物量是反应植物生长情况的有效指标,施加AMF可明显促进白三叶草的营养生长,其株高及生物量(地上、地下)均有显著提高,不同菌剂处理对植物生长具有不同的促进效果(图3、4).

图3 AMF对白三叶草株高的影响

图4 AMF对白三叶草地上、地下生物量的影响
株高是草坪建植质量评价的指标之一,能够反映草坪草的生长状态和整齐性.白三叶草坪建植的经验管理高度为20 cm,超过这一高度则需要进行刈割,以避免出现倒伏和不整齐现象.在不施加菌剂(CK)时,白三叶草平均株高为(19±0.7)cm,低于刈割高度,表明无施肥管理不能满足草坪建植要求.施加菌剂可显著促进白三叶草的生长(P<0.05),且均能满足刈割高度.其中,单独施加摩西球囊霉(株高27±1.5 cm)和混合施加(株高27±1.0 cm)时植物的长势相当,差异无统计学意义.两种菌剂的混合施加对白三叶草的促进效果显著高于根内球囊霉(P<0.05).
与不施加菌剂(CK)相比,施加菌剂后可显著提高白三叶草地上、地下生物量(P<0.05),尤其是对白三叶草地上生物量的促进作用更为明显.其中施加单菌时,摩西球囊霉和根内球囊霉对植物地上及地下部分生物量的促进作用相当,差异无统计学意义.施加两种菌的混合菌时,对白三叶草地上、地下生物量促进作用最强,显著高于任何一种单菌(P<0.05),植物地上、地下生物量分别提高76.6%、35.7%.说明混菌更有效地促进白三叶草同化物质的积累,对植物的生长更有益.
2.3 AMF对植物根际土壤氮、磷的影响
菌剂对植物生长的促进作用是通过对营养元素吸收利用的改善来实现的,施加AMF可有效增强植物对土壤中水解性氮及有效磷的吸收能力(图5).
在不施加菌剂(CK)时,植物对根际土壤中水解性氮、有效磷的吸收率很低,植物对营养元素的吸收、利用效果差.施加菌剂可明显提高白三叶草对水解性氮、有效磷的吸收能力,且效果显著(P <0.05).
在促进水解性氮吸收上,单独施加摩西球囊霉的效果(与CK相比,可提高46.47%)显著好于根内球囊霉(与 CK相比,可提高33.23%)(P<0.05).而施加两种菌的混合菌时,其效果显著高于单菌(与 CK相比,可提高50.33%)(P<0.05),说明在促进白三叶草对根际土壤水解性氮吸收方面,混菌优于单菌.
在促进有效磷吸收上,单独施加摩西球囊霉与根内球囊霉时的效果最好,二者效果相当,差异无统计学意义,植物根际土壤中的有效磷质量分数最高,可由424.77 mg/kg降至142.17 mg/kg,对有效磷的利用率提高48%,且单菌促进效果好于混菌,二者差异有统计学意义(P<0.05),说明在促进白三叶草对根际土壤中有效磷的吸收方面,单菌优于混菌.
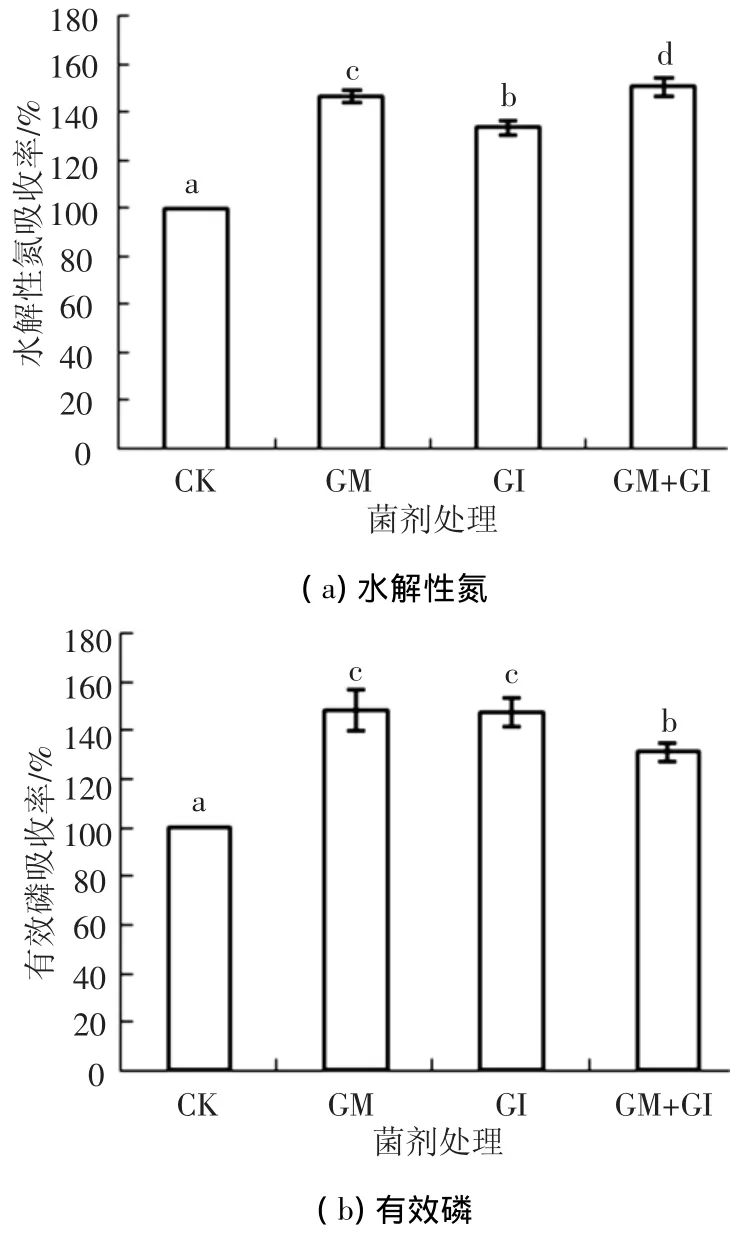
图5 AMF对根际土壤中水解性氮、有效磷吸收率的促进效果
2.4 植物生长与根际土壤氮、磷的关系
为确定在施加AMF菌剂条件下,宿主植物生长与土壤养分的关系,对土壤中能够被植物直接利用的主要营养元素(水解性氮和有效磷)的丰缺度进行了分析[14],并对其与植物生长指标(株高)之间的关系进行了定量分析,其结果如图6所示.
根据第二次全国土壤普查中水解性氮与有效磷含量的分级标准可知[15-19],黑龙江土壤属于氮缺乏、磷盈余的土壤类型.随着受试植物的生长,土壤中可被植物利用的活性氮水平与植物的株高有显著的线性负相关关系.随着植物株高的增加,植物根际土壤中残留的水解性氮含量急剧减少,在有菌剂存在的条件下,氮元素的供给仍不能够达到作物生长的饱和需求,成为植物生长的限制因子.
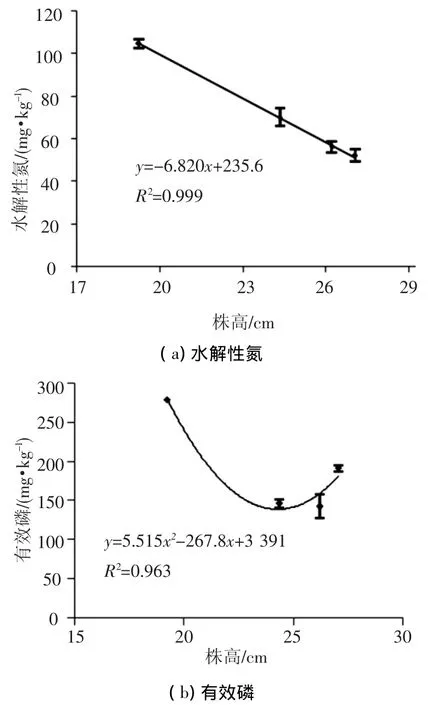
图6 根际土壤中水解性氮、有效磷与株高的关系
氮是植物生长需要的大量元素,而我省土壤水解性氮含量本底值低、耗竭严重,在植物培养过程中需要底肥来培肥土壤,施加菌肥对植物生长有促进作用,虽能达到白三叶草坪建植的生长需要,但是在白三叶草的生长与水解性氮利用关系曲线中可以得出,植物生长元素利用尚未达到饱和临界点,适量补充氮肥条件下,白三叶的营养生长尚有提高空间.
受试土壤中,速效磷水平较高,属于磷盈余状态.植物生长株高与磷之间呈现饱和曲线规律,在无菌剂施加条件下,植物土壤中残余的磷质量分数高达420 mg/kg,菌剂施加对植物生长的促进提高了植物对土壤中磷元素的利用效率.在土壤残留150 mg/kg的磷营养水平时,即使植物进一步生长,对磷的需求也不会有太大的波动,达到饱和状态.实际生产过程中,施加菌剂时可满足植物对磷的吸收利用,白三叶草坪扶壮过程中无需追施磷肥.
3 结论
1)白三叶草能与AMF形成菌根共生体.摩西球囊霉对白三叶草的侵染效果最佳,侵染率可达53.84%,优于混菌,但是白三叶草对混菌的菌根依赖性最强,且在植物的营养器官中,其地上部分较地下部分对菌剂表现出更强的菌根依赖性.
2)施加AMF后,可明显促进白三叶草的营养生长,其株高及生物量(地上、地下)均有显著提高,混菌为最佳菌剂,株高、地上及地下生物量的扶壮率可分别增加40.7%、76.6%、35.7%.
3)施加AMF菌剂后,可明显改善白三叶草对根际土壤中水解性氮、有效磷的利用效果.在实际生产过程中,可适量配施少量氮肥进行草坪扶壮管理.
[1]易时来,温明霞.VA菌根改善植物磷素营养的研究进展[J].中国农学通报,2004(5):164-166.
[2]MENGE J A.Inoculum production[C]//VA Mycorrhiza.USA:CRC Press,Raton Florida USA,1984:187-204.
[3]SNDERS F E,TINKER P B.Phosrhato flow into mycorrhizal root[J].Pestic Sci,1973(4):385 - 395.
[4]李瑞卿,刘润进,李敏.园艺作物菌根及其在生态农业的应用[J].中国生态农业学报,2002,10(1):24-26.
[5]陈羽,弓明钦,仲崇禄.菌根菌剂在华南地区林业及农业上的应用[J].广东林业科技,2004,20(1):50-53.
[6] HELGASON T,MERRYWEATHERJ W,DENISON J,et al.Selectivity and functional diversity in arbuscular mycorrhizas of cooccurring fungi and plants from a temperate deciduous wood land[J].J Ecol,2002,90:371 -384.
[7]任嘉红,刘瑞祥,李云玲.三七丛枝菌根(AM)的研究[J].微生物学通报,2007,34(2):224 -227.
[8]杨光,郭兰萍,黄璐琦,等.药用植物的丛枝菌根接种方法研究[J].资源科学,2008,30(5):778-785.
[9]BEATH J M.Consider phytoremediation for waste site cleanup[J].Chem Eng Prog,2000,96(7):61 -69.
[10]BULLARD R D.Dumping in Dixie:race,class,and environmental quality[M].New York:Westview Press,2000:201.
[11]RISER R E.Remediation of pet folium contaminated soils:biological,physical and chemical processes[M].Boca Raton:Lewis Publishers Inc,1998.
[12]吴建峰,林先贵.我国微生物肥料研究现状及发展趋势[J].土壤,2002,34(2):68-72.
[13]NEMEC S.Response of Citrus rootstoks to 3 species of Glomus[C]//Proc Fla State Hortic Soc.[S.l.]:[s.n.],1978:10-91.
[14]中国土壤学会农业化学专业委员会.土壤农业化学常规分析方法[M].北京:科学出版社,1983.
[15]全国土壤普查办公室.中国土种志(第一卷)[M].北京:农业出版社,1993:924.
[16]全国土壤普查办公室.中国土种志(第二卷)[M].北京:农业出版社,1994:730.
[17]全国土壤普查办公室.中国土种志(第三卷)[M].北京:农业出版社,1994:744.
[18]全国土壤普查办公室.中国土种志(第四卷)[M].北京:农业出版社,1995:806.
[19]全国土壤普查办公室.中国土种志(第五卷)[M].北京:农业出版社,1996:880.

