硫辛酸对黄羽肉鸡生长性能、抗氧化能力和免疫功能的影响
规模化、集约化养殖为肉鸡生产做出重要贡献的同时,也带来了严重的隐患,如肉鸡体内产生大量自由基、发生氧化应激,表现为免疫机能低下、疾病易感性增加等[1]。生长期是肉鸡机体的各项功能趋于完善的重要时期。因此,提高生长期肉鸡抗氧化能力和免疫功能对减少集约化养殖下肉鸡疾病的发生以及药物的使用具有重要的意义。抗氧化剂,作为自由基的清除剂,可以协助体内维持氧代谢平衡,提高机体抗氧化能力,同时维持重要免疫细胞的功能和结构完整性,进而增强机体的免疫机能[2-3]。硫辛酸,是唯一兼具脂溶性与水溶性的的抗氧化剂,具有很强的抗氧化活性,它可以通过螯合金属离子、清除自由基、再生内源性抗氧化剂来减缓或修复氧化损伤,也被称为“万能抗氧化剂”[4]。目前国内外关于硫辛酸的研究主要集中在人类疾病等的治疗和预防方面,有关硫辛酸在畜禽饲养和免疫方面的研究报道还较少[5-6]。为此,本试验以21日龄黄羽肉鸡为试验动物,旨在通过研究硫辛酸对其生长性能、抗氧化能力及免疫功能的影响,为硫辛酸在肉鸡生产中的应用提供参考。
1 材料与方法
1.1 试验设计与材料
试验选用21日龄体重相近的矮脚黄羽肉鸡60只,随机分成2组,每组5个重复,每个重复6只鸡。对照组饲喂基础饲粮,试验组(硫辛酸组)饲喂在基础饲粮中添加300 mg/kg硫辛酸的试验饲粮,试验期30 d。
硫辛酸由江苏省常熟市富士莱医药化工有限公司提供,纯度为99%。
矮脚黄羽肉鸡由上海农业科学院畜牧兽医研究所试验场提供。
试验基础饲粮参照美国NRC(1994)家禽营养需要量配制,基础饲粮组成及营养水平见表1。
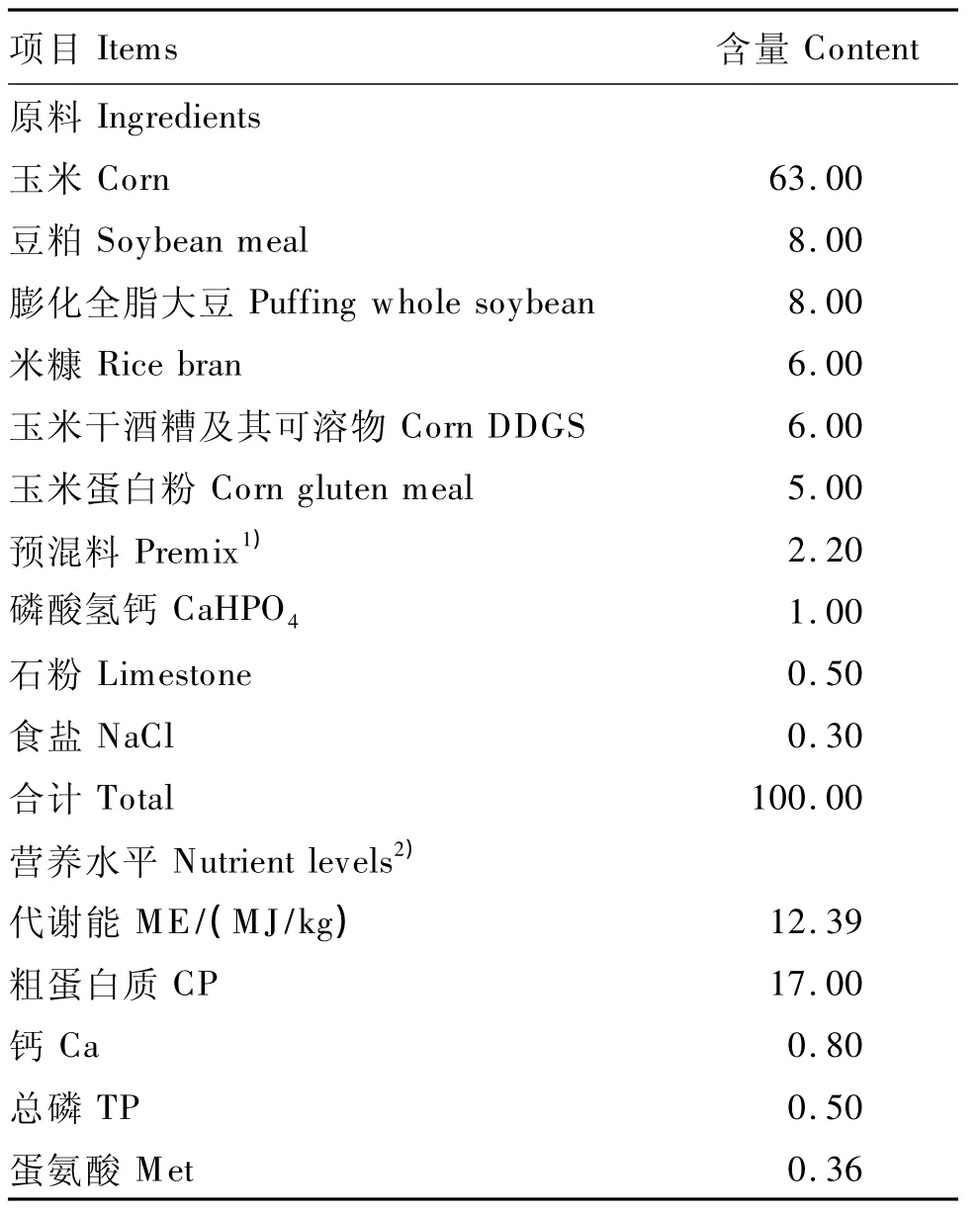
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels ofthe basal diet(air-dry basis) %
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet:VA 12 000 IU,VD31 000 IU,VE 60 mg,VB23.0 mg,VB1215 μg,烟酸 nicotinic acid 30 mg,叶酸 folic acid 0.55 mg,生物素 biotin 0.15 mg,泛酸 pantothenic acid 10 mg,胆碱 choline 400 mg,Fe 80 mg,Mn 60 mg,Cu 8 mg,Zn 40 mg,Se 0.15 mg,I 0.7 mg。
2)计算值 Calculated values。
1.2 饲养管理
试验鸡采用舍内笼养方式,自由采食和饮水。按正常程序防疫和鸡舍消毒。
1.3 样品采集与制备
1.3.1血液的采集与样品制备
分别于试验第15天和第30天,每个重复挑选与该重复平均体重相近的肉鸡1只,翅静脉采集2管(不含肝素锂和含肝素锂)分别为3 mL的血样,其中不含肝素锂血样于3 000 r/min离心15 min制备血清,放入EP管中,置于4℃冰箱保存,用于血清抗氧化指标及免疫指标的测定;含肝素锂血样为抗凝血,用于淋巴细胞转化率的测定。1.3.2 免疫器官采集
分别于试验第15天和第30天,每个重复挑选与该重复平均体重相近的肉鸡1只,屠宰,收集脾脏、胸腺和法氏囊,称重,用于计算免疫器官指数。
1.4 测试指标和方法
1.4.1 生长性能
试验期间每天记录鸡只死亡情况,以重复为单位记录每日投料量和剩余料量,分别于试验第15天和第30天09:00对试验鸡(禁食12 h)进行称重,并计算各组死亡率、平均采食量、平均日增重和料重比。
1.4.2 抗氧化能力
血清谷胱甘肽过氧化物酶(GSH-Px)活性、总超氧化物歧化酶(T-SOD)活性、总抗氧化能力(TAOC)以及丙二醛(MDA)含量、一氧化氮(NO)含量、过氧化氢(H2O2)含量、抑制羟自由基(·OH)能力均使用购自南京建成生物工程研究所的试剂盒进行测定。
1.4.3 免疫功能
1.4.3.1 免疫器官指数
免疫器官指数(g/kg)=免疫器官重量(g)/
肉鸡活体重(kg)。1.4.3.2 外周血淋巴细胞转化率
将抗凝血先用无钙镁Hank’s液作1∶1稀释,然后移取3 mL人淋巴细胞分离液于10 mL离心管中,沿管壁缓慢加入2倍体积的稀释血液,2 500 r/min离心 30 min。取中间白细胞层约1 mL,加入3~5倍 RPMI-1640完全培养液,洗涤3次,每次2 000 r/min离心10 min,弃上清。将190 μL的淋巴细胞悬液加入到96孔细胞培养液中,再加入含10 μL的伴刀豆球蛋白A(ConA)或10 μL的脂多糖(LPS)溶液,每个样品3个重复,每个样品留2个孔作空白对照,培养体系每孔共200 μL。于 5%CO2、39 ℃ 下培养 72 h。在培养结束前4小时,每孔加5 mg/mL噻唑蓝(MTT)10 μL,继续培养,培养结束时,每孔再加入100 μL 10%十二烷基磺酸钠(SDS)-0.04 mol/L氯化氢(HCl)溶液,30 min后用酶标仪在570 nm波长下测定OD值。淋巴细胞转化率=丝裂原刺激孔OD570nm/
对照孔OD570nm。
1.4.3.3 血清免疫球蛋白
血清免疫球蛋白 A(IgA)、免疫球蛋白 M(IgM)、免疫球蛋白G(IgG)含量均采用免疫比浊法进行测定,试剂盒购自南京建成生物工程研究所。
1.5 数据处理
采用 SPSS 13.0软件的 One-way ANOVA程序对试验数据进行方差分析,分别以P<0.05、P<0.01作为差异显著与极显著的判断标准,结果以平均值±标准差表示。
2 结果
2.1 硫辛酸对黄羽肉鸡生长性能的影响
由表2可以看出,与对照组相比,硫辛酸对2个阶段的黄羽肉鸡平均日采食量、平均日增重、料重比均无显著影响(P>0.05)。
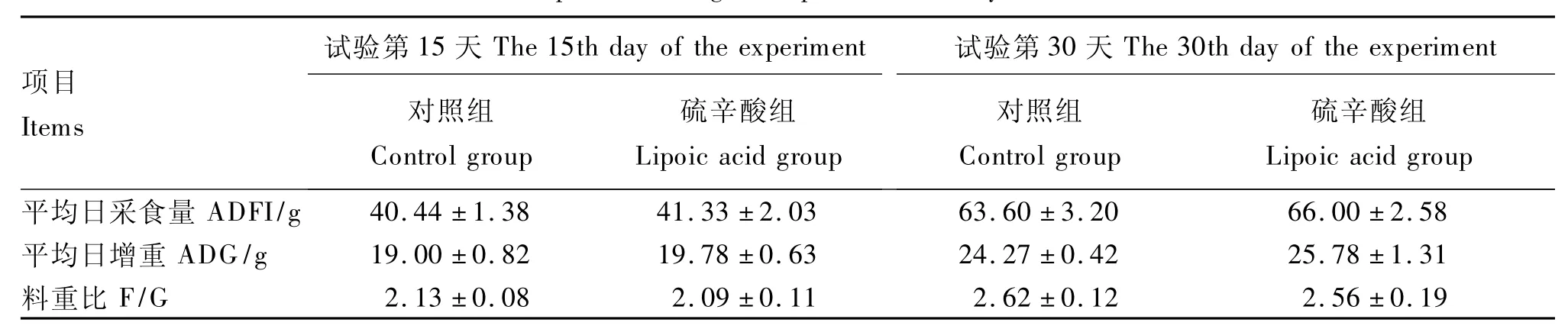
表2 硫辛酸对黄羽肉鸡生长性能的影响Table 2 Effects of lipoic acid on growth performance of yellow-feathered broilers
同行同一阶段中的数据肩注小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01),无肩注表示差异不显著(P>0.05)。下表同。
In the same row,values in the same period with different small letter superscripts mean significant difference(P<0.05),and with different capital letter superscripts mean extremely significant difference(P<0.01),while without letter superscripts mean no significant difference(P>0.05).The same as below.
2.2 硫辛酸对黄羽肉鸡抗氧化能力的影响
由表3可见,在试验第15天时,与对照组相比,硫辛酸组黄羽肉鸡血清 T-SOD活性升高了19.57%(P<0.05),NO含量下降了 16.64%(P<0.05)。
在试验第30天时,与对照组相比,硫辛酸组黄羽肉鸡血清抑制羟自由基能力提高了562.56%(P<0.01),MDA含量降低了20.98%(P<0.05)。
2.3 硫辛酸对黄羽肉鸡免疫器官指数的影响
由表4可以看出,在试验第15天时,与对照组相比,硫辛酸组黄羽肉鸡脾脏指数提高了29.86%(P<0.05)。
在试验第30天时,与对照组相比,硫辛酸对黄羽肉鸡脾脏指数、胸腺指数、法氏囊指数均无显著影响(P>0.05)。
2.4 硫辛酸对黄羽肉鸡外周血淋巴细胞转化率的影响
由表5可知,在试验第15天时,与对照组相比,硫辛酸对由ConA和LPS刺激的黄羽肉鸡外周血淋巴细胞转化率均无显著影响(P>0.05);在试验第30天时,二者分别提高了16.83%和19.79%(P<0.05)。
2.5 硫辛酸对黄羽肉鸡血清免疫球蛋白含量的影响
由表6可以看出,在试验第15天时,与对照组相比,硫辛酸组黄羽肉鸡血清IgG含量提高了34.03%(P<0.01)。
在试验第30天时,与对照组相比,硫辛酸组黄羽肉鸡IgG含量提高了29.40%(P<0.05)。
3 讨论
3.1 硫辛酸对黄羽肉鸡生长性能的影响
Zhang等[7]研究表明,饲粮中添加300 mg/kg硫辛酸对爱拔益加肉鸡生长性能无显著影响(P>0.05),这与本试验结果一致。Srilatha等[8]研究也发现,饲粮中添加20、40、60 mg/kg硫辛酸对肉鸡日增重、料重比均无显著影响(P>0.05)。在本试验中,饲粮中添加300 mg/kg硫辛酸对整个试验期间黄羽肉鸡平均日采食量、平均日增重、料重比均无显著影响(P>0.05),这与已有研究结果相似。

表3 硫辛酸对黄羽肉鸡血清抗氧化能力的影响Table 3 Effects of lipoic acid on serum antioxidant capacity in yellow-feathered broilers
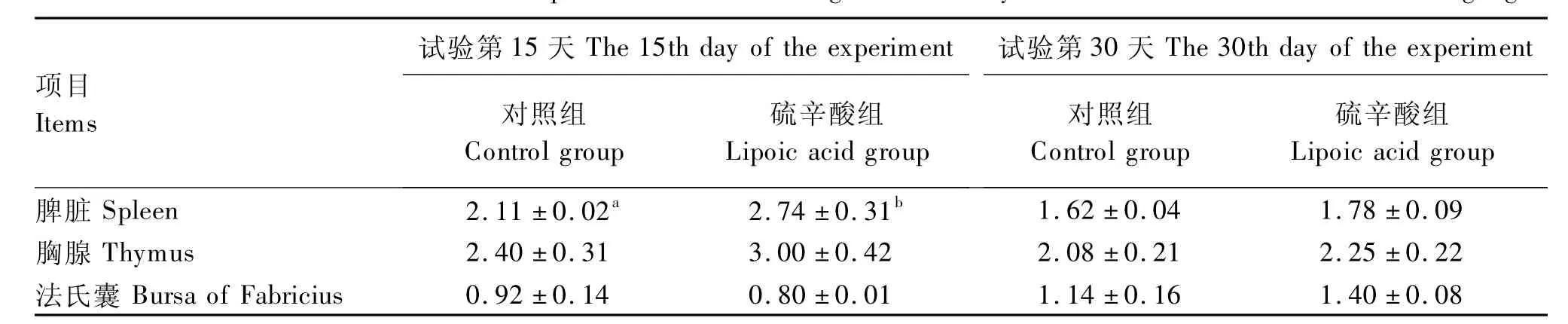
表4 硫辛酸对黄羽肉鸡免疫器官指数的影响Table 4 Effects of lipoic acid on immune organ indices in yellow-feathered broilers g/kg
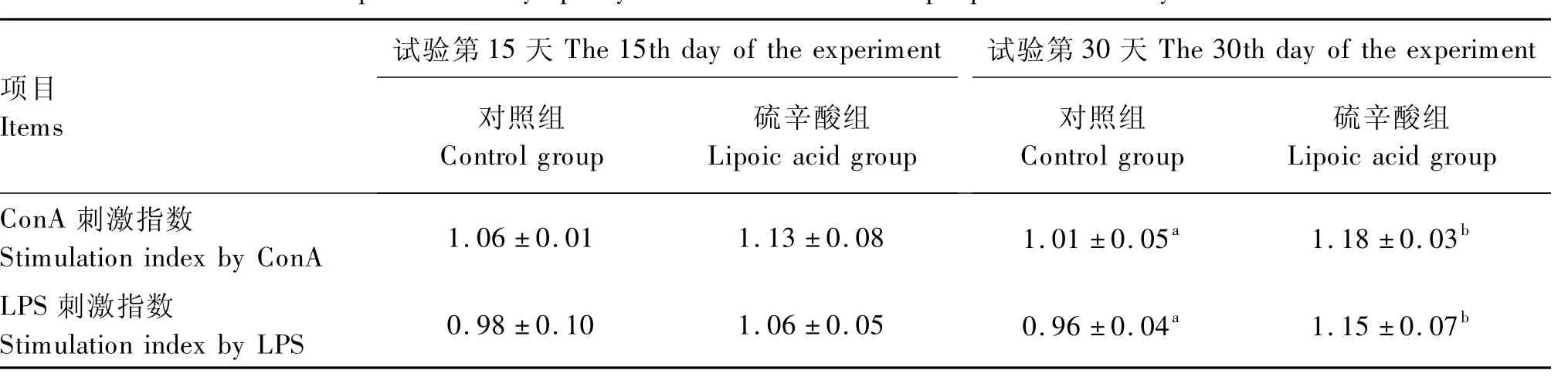
表5 硫辛酸对黄羽肉鸡外周血淋巴细胞转化率的影响Table 5 Effects of lipoic acid on lymphocyte transformation rate in peripheral blood in yellow-feathered broilers
3.2 硫辛酸对黄羽肉鸡抗氧化能力的影响
超氧化物歧化酶(SOD)是机体清除自由基的一种重要酶,T-SOD活性的高低间接反映了机体清除自由基的能力。GSH-Px是机体内广泛存在的一种重要的过氧化物酶,它能催化还原型谷胱甘肽(GSH)变为氧化型谷胱甘肽(GSSG),使有毒的过氧化物还原为无毒的羟基化合物,从而保护细胞膜的结构和功能不受过氧化物的干扰及损害。脂质过氧化最终产物之一是MDA,血清中MDA含量的高低间接反映了机体细胞受到自由基攻击的严重程度。试验动物在服用抗氧化剂一段时间后,可以通过测定血清或组织中SOD活性、GSH-Px活性、MDA含量等的变化来判断抗氧 化剂的作用效果[9]。
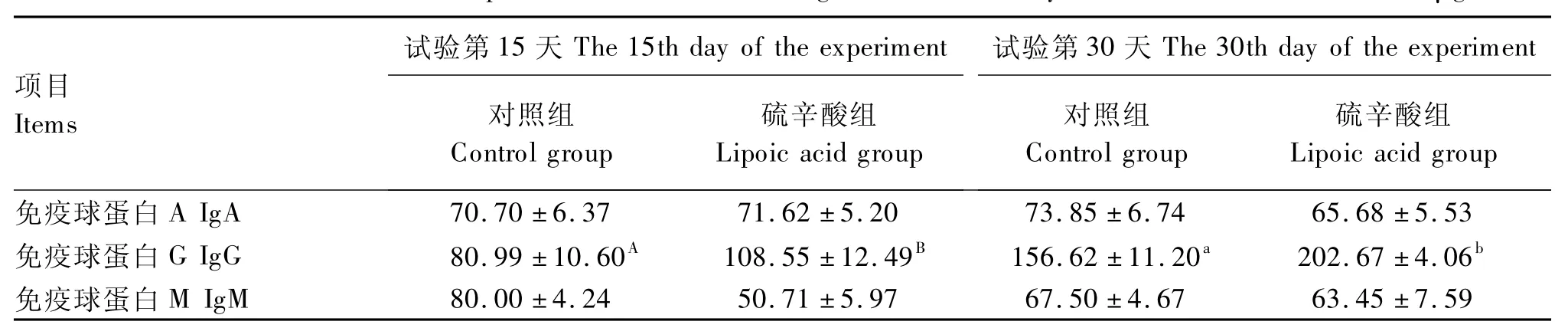
表6 硫辛酸对黄羽肉鸡血清中免疫球蛋白含量的影响Table 6 Effects of lipoic acid on serum immunoglobulin content in yellow-feathered broilers μg/mL
目前,硫辛酸的抗氧化功能已经得到证实。Zhang等[7]研究表明,饲粮中添加300 mg/kg硫辛酸可以显著降低爱拔益加肉鸡血清MDA含量(P<0.01);李建文等[10]研究也发现,肉鸭饲粮中添加150 mg/kg硫辛酸有提高其血浆GSH-Px活性的趋势(P=0.077),可以显著降低其肝脏MDA含量(P<0.05)。在本试验第15天时,硫辛酸组黄羽肉鸡血清T-SOD活性显著高于对照组(P<0.05);在第30天时,硫辛酸组黄羽肉鸡血清MDA含量显著低于对照组(P<0.05),由此可初步判定300 mg/kg硫辛酸可以在一定程度上改善黄羽肉鸡机体的抗氧化能力。
随着现代养殖业集约化程度的提高,动物机体内自由基过量产生,引起脂质、蛋白质氧化损伤,诱导各种疾病的发生。抗氧化剂作为自由基的清除剂,可以抑制或减缓自由基或自由基所产生的连锁反应化合物的生成,达到修复机体氧化损伤的作用。因此,自由基的水平也从侧面反映了抗氧化剂抗氧化能力的强弱[11]。NO作为一种氮自由基,携带有1个未配对电子,极易与氧、超氧阴离子、过氧化氢反应生成 NO3-和NO2-。其中NO3-容易质子化后迅速分解成具有高反应性的羟自由基,诱发生物膜的多种不饱和脂肪酸的脂质过氧化作用,造成细胞损伤[12]。在本试验中,第15天硫辛酸组黄羽肉鸡血清NO含量显著低于对照组(P<0.05),表明硫辛酸的添加可以在黄羽肉鸡21~35日龄显著减少NO的产生,进而减缓脂质过氧化作用的发生,保护机体组织不受损伤。羟自由基则是人体在新陈代谢过程中产生的对生物体毒性最强、危害最大的自由基,它可以使组织中的糖类、氨基酸、蛋白质、核酸等物质发生氧化,遭受氧化性损伤和破坏,导致细胞损伤、坏死或突变[13]。抑制羟自由基的能力可以间接反映羟自由基的活性,二者之间为反相关系。即抑制羟自由基能力越强,羟自由基活性越弱;抑制羟自由基能力越弱,羟自由基活性越强。在本试验中,第30天时,硫辛酸组黄羽肉鸡血清抑制羟自由基能力显著高于对照组(P<0.01),说明硫辛酸的添加可以显著降低血清中羟自由基的活性,保护机体免受损伤。
从以上结果可以看出,硫辛酸作为抗氧化剂可以在一定程度上清除机体自由基,提高肉鸡抗氧化水平。
3.3 硫辛酸对黄羽肉鸡免疫功能的影响
3.3.1 硫辛酸对黄羽肉鸡免疫器官指数的影响
脾脏、胸腺、法氏囊作为禽类主要免疫器官,在机体的体液免疫和细胞免疫中发挥了极其重要的作用。脾脏是禽类最大的外周免疫器官,聚居着大量B细胞、T细胞,是免疫应答的重要场所。同时也是体内产生抗体的主要器官,参与全身细胞免疫和体液免疫。胸腺和法氏囊是禽类的中枢免疫器官,前者主要负责T细胞的成熟和分化,后者则是B细胞生长和分化的部位,主要参与体液免疫。中枢和外周免疫器官发育状态及其机能强弱直接决定着禽类全身的免疫水平[14]。Rivas等[15]认为,脾脏、胸腺及法氏囊的重量可用于评价雏鸡的免疫状态,其绝对重量和相对重量越大,说明机体的细胞免疫和体液免疫机能越强。在本试验第15天时,硫辛酸可以促进脾脏和胸腺的发育,其中对脾脏发育的影响显著(P<0.05),表明硫辛酸可以在一定程度上促进免疫器官的发育,进而提高机体免疫水平。
3.3.2 硫辛酸对黄羽肉鸡细胞免疫的影响
硫辛酸作为唯一一个脂水兼溶的抗氧化剂,在水相和脂质中都有较好的溶解性,可以以相当高的浓度存在于细胞内和细胞外,发挥清除脂溶性和水溶性自由基的作用,从而保护脂蛋白及细胞膜,增强免疫细胞的完整性,进而提高细胞免疫功 能。Srilatha 等[8]发 现,饲 粮 中 添 加 60、80 mg/kg硫辛酸均可显著刺激肉鸡皮肤嗜碱性粒细胞过敏反应(P<0.05);崔珏等[16]研究也发现,高脂饲粮中添加0.1%硫辛酸可以显著提高小鼠外周血CD4+/CD8+、B细胞百分含量(P<0.05),进而有效改善慢性氧化应激对免疫系统的损伤,这表明饲粮中添加一定量的硫辛酸可以提高动物细胞免疫水平。检测外周血淋巴细胞转化率也是细胞免疫研究的一种常用方法。ConA和LPS是常用来检测外周血淋巴细胞转化率的丝裂原,作为促分裂因子来检测淋巴细胞转化功能,其转化率的高低常作为衡量机体细胞免疫水平的指标。其中ConA选择性地刺激T细胞,而LPS只刺激B细胞[17]。在本试验中,第30天时,硫辛酸组黄羽肉鸡由ConA、LPS刺激的外周血淋巴细胞转化率均显著高于对照组(P<0.05),表明300 mg/kg硫辛酸可以在黄羽肉鸡21~35日龄显著提高其细胞免疫水平。
3.3.3 硫辛酸对黄羽肉鸡体液免疫的影响
免疫球蛋白是具有抗体活性或化学结构上与抗体相似的球蛋白,是一类重要的免疫效应分子。家禽主要含有 IgA、IgM、IgG 3种免疫球蛋白。IgA具有抗菌、抗毒、抗病毒作用,占血清免疫球蛋白的10%~20%。IgG是人和动物血清中含量最高的免疫球蛋白,占血清免疫球蛋白总量的75%~80%,同时它也是再次免疫所产生的免疫球蛋白,在体液免疫中最为重要。IgM是分子量最大的免疫球蛋白,是初次体液反应早期阶段产生的主要的免疫球蛋白,但持续时间短,其含量仅占血清免疫球蛋白的10%左右[18]。在本试验中,硫辛酸组黄羽肉鸡IgG含量在整个试验期间均显著高于对照组(P<0.05)。作为体液免疫中最重要的免疫球蛋白,IgG含量的提高表明饲粮中添加300 mg/kg硫辛酸可以增强肉鸡体液免疫功能。
4 结论
①饲粮中添加300 mg/kg硫辛酸对黄羽肉鸡的生长性能无显著影响。
②饲粮中添加300 mg/kg硫辛酸可抑制黄羽肉鸡体内自由基的产生,在一定程度上提高机体的抗氧化能力。
③饲粮中添加300 mg/kg硫辛酸可以通过提高黄羽肉鸡细胞免疫和体液免疫水平,进而改善其免疫功能。
[1] 许传田,张秀美.现代规模化肉鸡养殖调查报告[J].家禽科学,2009(8):3 -4.
[2] FANG Y Z,YANG S,WU G.Free radicals,antioxidants,and nutrition[J].Nutrition,2002,18(10):872-879.
[3] HALLIWELL B.Free radicals and antioxidants:a personal view [J].Nutrition Reviews,1994,52(8):253-265.
[4] FLAVIA N I,MIKE F Q,CRISTINA S.Lipoic acid:a unique antioxidant in the detoxification of activated oxygen species[J].Plant Physiology and Biochemistry,2002,40:463 -470.
[5] 刘俊栋,刘海霞,李建基.生物抗氧化剂——硫辛酸的研究[J].饲料工业,2005,26(2):14 -16.
[6] JIMENEZ M H,CERRILLA M C,PERALTA M C.Oxidative stress and the use of antioxidants in domestic animals[J].Interciencia,2005,30(12):728.
[7] ZHANG Y,HONGTRAKUL K,JI C,et al.Effects of dietary alpha-lipoic acid on anti-oxidative ability and meat quality in Arbor Acres broilers[J].Asian-Australia Journal of Animal Science,2009,22(8):1195-1201.
[8] SRILATHA T,REDDY R V,QUDRATULLAH S,et al.Effect of alpha-lipoic acid and vitamin E in diet on the performance,antioxidation and immune response in broiler chicken[J].International Journal of Poultry Science,2010,9(7):678 -683.
[9] JIMENEZ M,CERRILLA M,PERALTA M,et al.Oxidative stress and the use of antioxidants in domestic animals[J].Interciencia,2005,30(12):7 - 23.
[10] 李建文,王聪,丁斌鹰.茶多酚和硫辛酸的复合物对氧化应激肉鸭抗氧化功能的影响[J].中国饲料,2010(14):32-34.
[11] 徐建雄,陈小连.自由基对动物机体的氧化损伤与抗氧化剂的修复作用研究[C]//王康宁.动物营养研究进展.北京:中国农业科学技术出版社,2008:146-148.
[12] 陈瑾歆,唐聪明.氧自由基的研究进展[J].海南医学院学报,2004,10(3):206 -208.
[13] 赵保路.自由基、营养、天然抗氧化剂与衰老[J].生物物理学报,2010,26(1):26 -36.
[14] 罗克.动物的免疫器官、免疫细胞和免疫分子[J].福建畜牧兽医,2005,27(1):59 -68.
[15] RIVAS A L,JULIUS F.Indication of immunodepression in chickens infected with various strains of Marek’s Disease virus[J].Avian Diseases,1988,32:1-8.
[16] 崔珏,肖瀛,王斌,等.硫辛酸高脂日粮对小鼠免疫功能的影响[J].营养学报,2010,32(1):35-38.
[17] KONG X F,HU Y L,RUI R,et al.Effects of Chinese herbal medicinal ingredients on peripheral lymphocyte proliferation and serum antibody titer after vaccination in chicken[J].International Immunopharmacology,2004,4(7):975 -982.
[18] MICHAEL J H R.Antibodies,immunoglobulin genes and the bursa of Fabricius in chicken B cell development[J].Development and Comparative Immunology,2006,30:101-118.

