新疆不同来源单核细胞增生性李斯特氏菌分离株的部分生物学特性及相关性分析
尚文婧,赵新斐,王静梅,剡根强
(石河子大学动物科技学院,新疆石河子 832000)
单核细胞增生性李斯特氏菌(Listeria moncyto genes,LM)是一种重要的食源性病原菌,因致病性及高死亡率被视为毒力最强的食源性病原菌。有关LM的传播机制一直是研究的热点,不同来源LM的生物学特性是否具有相关性还不十分清楚。本实验对8株来自健康绵羊和临床发病绵羊中LM分离株的部分生物学特性进行鉴定,研究8株LM分离株在致病力、谱系、基因型与血清型之间的相互关系,从而丰富对LM的生态学和在食物链中传播维持规律的认识,为有效控制动物李氏杆菌病的传播和制定科学的食品安全措施提供依据。
1 材料和方法
1.1 菌株与实验动物 LM血清型为1/2 a和LM株由扬州大学惠赠;8株LM分离株和22株非LM菌株由石河子大学预防实验室分离并保存;20日龄昆明系小鼠(体质量为20 g左右),雌雄各半,购自石河子大学动物试验中心。
1.2 主要试剂 LB肉汤培养基、TaqDNA聚合酶、dNTPs、50 bp和100 bp DNA Marker购自广州东盛生物科技有限公司;20 bp DNA Marker购自TaKaRa公司;引物均由深圳华大基因技术有限公司合成;限制性内切酶AluⅠ和Tsp509Ⅰ购自Fermentas公司。
1.3 人工感染小鼠致病力检测
1.3.1 细菌培养与计数分别将8株LM分离株接种于LB肉汤内,37℃摇床培养24 h。12 000 r/min离心,灭菌生理盐水配成菌悬液,并稀释10个梯度,取每个梯度的菌液100μL涂布于3个脑心浸液琼脂平板培养,计数其菌落数。
1.3.2 人工感染小鼠试验30只健康、体质量约为20 g的小鼠,随机分为10组,试验组9组,每组3只,对照组3只。试验组小鼠以腹腔注射待测菌液0.1 ML/只(5×109cfu/mL);对照组腹腔注射等体积生理盐水,注射量为0.1 ML/只。接种后每隔12 h观察小鼠状况,对死亡小鼠进行剖检,记录肝脏、脾脏等病理变化。
1.3.3 回收菌的检验采用已建立的针对HlyA基因[1]设计的特异性引物LM PCR方法检测验证从小鼠心血、肝脏、脾脏回收的LM。LM保守的HlyA基因片段Primer1(5'-CTGAATTCGGCTGTTACTAA AGAGCAGTTGC-3')和Primer2(5'-ATGGATCCTTA GCCCCAGATGGAGATATTTCTA-3'),扩增的片段长度为743 bp。扩增条件为:95℃ 5min;94℃1m in、56.4℃1m in、72℃1m in,35个循环;72℃5 min。于1.5%琼脂糖凝胶中进行电泳,预扩增片段为743 bp。
1.4 分离株血清型的PCR鉴定 按照文献[2]设计5对引物分别特异性扩增LM的Lmo0737和Lmo1118基因、开放阅读框ORF2819和ORF2110基因、李斯特菌属共有基因Prs,由上海生工生物工程技术服务有限公司合成。

表1 引物的核苷酸序列及血清型Table1 Nucleotide sequences of primers for serotyping
1.4.1 多重PCR血清型分型采用5对特异性引物进行扩增。反应条件为:95℃ 3 Min;94℃ 24 s、53℃ 75 s、72℃ 75 s,35个循环;72℃ 7 min。PCR扩增产物经2%的琼脂糖凝胶电泳检测。
1.4.2 多重PCR根据文献[3]报道,依据上述5对引物进行PCR扩增,可将LM的10种血清型分为4组和1个李氏杆菌属组。第1组(GP1)由1/2 a和3 a血清型组成,只扩增出Lmo0737和Prs的DNA片段;第2组(GP2)由1/2 b、3 b和7血清型组成,只扩增出ORF2819和Prs的DNA片段;第3组(GP3)由1/2 c和3 c血清型组成,同时扩增出Lmo0737、ORF1118和Prs的DNA片段;第 4组(GP4)由 4 b、4 d和 4 e血清型组成,同时扩增出 ORF2819、ORF2110和Prs的 DNA片段;第5组(GPL)为 LM所共有的基因产物,只扩增出Prs的DNA片段,为非LM。
1.5 分离菌株多重PCR的谱系鉴定 将8株LM分离株接种于LB肉汤培养物培养;取1 ML菌液,10 000 r/m in离心10 Min,弃上清,加入200μL双蒸水重新悬浮,沸水浴10 min,冰上放置30 s,12 000 r/m in离心10 Min后,取上清液,作为模板备用。采用actA1、plcB2和actA3-plcB3 3组不同的引物进行多重PCR扩增[4],引物见表2。PCR反应程序:95℃2m in;94℃1min、54℃1min、72℃1 min,35个循环;72℃ 5 Min。PCR扩增产物在1.5%的琼脂糖凝胶中电泳检测。
1.6 分离菌株内化素(InlA)基因的PCR-RFLP 参照文献[5]方法,选定的InlA基因片段是根据遗传异质性由于点突变多态性研究而确定设计引物seq01(5'-AATCTAGCACCACTGTCGGG-3')和seq02(5'-TGTGACCTTCTTTTACGGGC-3'),扩增的片段大小为733 bp。PCR反应程序:95℃4min;94℃30 s、52℃ 1 min、72℃ 2.5 Min,35个循环;72℃7 min。PCR扩增产物在1.5%的琼脂糖凝胶中电泳。分别采用限制性内切酶AluⅠ和Tsp509Ⅰ以37℃和65℃各自进行过夜消化。3%的琼脂糖凝胶电泳后将PCR-RFLP片段分离检测。

表2 谱系多重PCRTable 2 Multiplex PCR of lingeage
2 结果
2.1 人工感染小鼠致病力检测 试验组小鼠从第3 d开始出现精神沉郁、蜷缩、浑身发抖、抱团、步态不稳、嗜睡、结膜炎等症状,继而陆续出现死亡;而对照组小鼠无任何异常。剖检死亡小鼠显示肺脏肿大、边缘钝圆、表面可见出血斑;肝脏肿大、紫红色、表面有弥漫性灰白色点状病灶;脾脏肿大、表面散见黑褐色的病灶,脑部充血,这些均与绵羊自然感染病例的剖检变化相似。从死亡小鼠的心血、肝脏、脾脏通过PCR方法均能够检测到回收的菌为 LM(图 1)。

图1 人工感染小鼠组织脏器部分回收LM菌PCR扩增Fig.1 Part of recovered LM identified by PCR from artificial infected Mice of tissue organ
2.2 分离菌株的血清型PCR鉴定 根据PCT鉴定结果初步断定,2株发病绵羊分离株、5株健康绵羊分离株与LM(1号孔)血清型一致,为1/2 a。8株LM由扬州大学检测,鉴定结果为5株健康绵羊分离株和3株发病绵羊分离株LM中7株血清型为1/2a,一株分离株的血清型为4 b(图2)。

图2 部分LM 5重PCR血清型分型Fig.2 Part of LM fivemultiplex PCR conventional stereotyping
2.3 分离菌株多重PCR的谱系鉴定 8株LM分离株中只有1株发病绵羊分离株的谱系鉴定为GPⅠ,该分离株4b与表2中谱系与血清型相对应;其余2株发病绵羊分离株和5株健康绵羊分离株为GPⅡ,这些分离株的血清型均为1/2a,也与之对应(图3)。
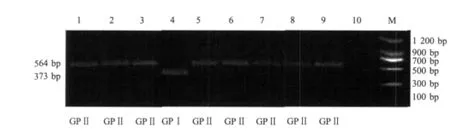
图3 多重PCR的谱系鉴定Fig.3 Multiplex PCR of lingeage identification
2.4InlA基因的PCR-RFLP基因扩增 采用seq01和seq02引物扩增8株LM分离株的InlA基因。根据文献[2]报道,限制性内切酶A luⅠ可以将该片段切为8个~11个片段,片段大小15 bp~241 bp,分为5种不同的基因型,而8株分离株分为3种不同基因型;限制性内切酶Tsp509Ⅰ将该片段切为7个~11个片段,大小8 bp~281 bp,分为3种不同基因型,而8株分离菌株也分为3种不同基因型。
采用AluⅠ和Tsp509Ⅰ分别酶切获得的不同类型基因型组合可以产生5种复合型的基因型,A型为AluⅠ酶切1型和Tsp509Ⅰ酶切3型,B型为AluⅠ酶切2型和Tsp509Ⅰ酶切1型,C型为A luⅠ酶切3型和Tsp509Ⅰ酶切2型,D型为A luⅠ酶切4型和Tsp509Ⅰ酶切2型,E型为A luⅠ酶切5型和Tsp509Ⅰ酶切3型;而A型为截短InlA蛋白,B型、C型和E型为完整InlA蛋白。8株LM中3株发病绵羊分离株中2株(血清型1/2a)为C型,一株(血清型4b)为B型,5株健康绵羊分离株(血清型1/2a)为 E 型(图 4)。

图4 不同菌株用限制性内切酶AluⅠ和Tsp509I分别酶切获得的PCR-RFLP基因型Fig.4 PCR-RFLP profiles of different isolates obtained after digested with endonucleases AluⅠand Tsp509I
3 讨论
LM是一种条件致病菌,是导致人类食源性感染的重要原因之一。传统的玻片单因子血清凝集的血清学分型法被广泛用于描述流行病学目的和监测LM,但传统的血清学分型可能并不是十分准确,与其它微生物有交叉反应,与分子分型方法相比有相对较低的识别能力,并且进行流行病学调查的价值有限[6]。分子生物技术也有助于了解LM分离株之间的生态性、遗传多样性等特性,从而更好地确定在一个特定的谱系中血清型的分布[7]。
小鼠人工感染试验表明无论来自健康绵羊还是临床发病绵羊的分离株对小白鼠均有相同的致病性,这一结果为LM作为条件性致病菌及其内源性感染方式提供了又一佐证,也与人及绵羊发生李氏杆菌病多与自身抵抗力下降有关的报道相一致。
8株LM分离株多重PCR谱系鉴定表明3株发病绵羊分离株中的2株和5株健康绵羊分离株同属于谱系Ⅱ,初步认为感染同一宿主的LM具有相近的进化谱系。研究表明,LM包括至少3个主要的进化部分或独立谱系,谱系Ⅰ普遍存在于人类患病中,谱系Ⅱ常见于动物、食品及相关环境中,谱系Ⅰ和谱系Ⅱ菌株中的重组现象十分普遍,并且谱系Ⅱ的进化动力强于谱系Ⅰ[8];实验的分离株中未检出谱系Ⅲ,可能与分离株数量有限有关。LM的谱系与血清型具有直接的关系[9]。本实验中谱系鉴定结果与分离株的血清型相一致,揭示不同来源的LM在血清型、遗传谱系及致病力之间具有相关性。近年来,InlA已被视为评估LM菌株的毒力属性的分子标记,基于该蛋白的功能(全长或截短型),强毒株和侵入株可以产生80 ku的InlA蛋白,LM在人肠道上皮细胞的侵袭性是与一个被截短的InlA基因表达的表型相关[10]。本实验对8株LM分离株进行PCR-RFLP,AluⅠ酶切中出现较多的5型基因型,从而补充丰富了LM的基因分型[5],而血清型为1/2a的发病绵羊分离株和所有健康绵羊分离株的复合基因型为C型或E型之间尚无确定性,仅有1株血清型为4b的发病绵羊分离株的复合基因型为B型,暗示引发绵羊感染的LM在InlA基因上存在多态性。然而,由于分析的菌株太少,对其多态性与致病性的相互关系的研究较少,还需更多的菌株进行深入研究。
[1]姜永强,雷祚荣,李瑾,等.应用PCR方法鉴定单核细胞增生性李斯特氏菌[J].中华预防医学杂志,1998,32(01):19-91.
[2]Doum ith M,Buchrieser C,Glaser P,et al.Differentiation of the majorListeria monocytogenesserovars by multiplex PCR[J].J Clin Microbiol,2004,42(8):3819-3822.
[3]Doumith M,Jacquet C,Gerner-Smidt P,et al.Multicenter validation of a multiplex PCR assay for differentiating the majorListeriamonocytogenesserovars 1/2a,1/2b,1/2c,and 4b:toward an international standard[J].J Food Prot,2005,68(12):2648-2650.
[4]Ward T J,Gorski L,Borucki MK,et al.Intraspecific phylogeny and lineage group identification based on the prfA virulence gene cluster ofListeria monocytogenes[J].J Bacteriol,2004,186(15):4994-5002.
[5]Rousseaux S,Olier M,Lema^tre J P,et al.Use of PCR-restriction fragment length polymorphism of inlA for rapid screening ofListeriamonocytogenesstrains deficient in the ability to invade Caco-2 cells[J].Appl Environ Microbiol,2004,70(4):2180-2185.
[6]Ward T J,Gorski L,Borucki MK,et al.Intraspecific phylogeny and lineage group identification based on the prfA virulence gene cluster ofListeria monocytogenes[J].J Bacteriol,2004,186(15):4994-5002.
[7]Doum ith M,Buchrieser C,Glaser P,et al.Differentiation of the majorListeria monocytogenesserovars by multiplex PCR[J].J Clin Microbiol,2004,42(8):3819-3822.
[8]Jeffers G T,Bruce J L,Mcdonough P L,et al.Comparative genetic characterization ofListeria monocytogenesisolates from human and animal listeriosis cases[J].M icrobiology,2001,147(Pt 5):1095-1104.
[9]Dussurget O,Pizarro-Cerda J,Cossart P.Molecular determ inants ofListeria monocytogenesvirulence[J].Annu Rev Microbiol,2004,58:587-610.
[10]Jonquières R,Bierne H,Mengaud J,et al.The inlA gene ofListeriamonocytogenesLO28 harbors a nonsensemutation resulting in release of internalin[J].Infect Immun,1998,66(7):3420-3422.

