中枢氧化应激抑制高血压大鼠压力感受性反射功能*
党 娜,潘燕霞
(1.福建医科大学基础医学院生理与病生学系,2.福建医科大学医学技术与工程学院康复治疗学系,福州 350004)
动脉压力感受性反射(arterial baroreflex,ABR)简称压力反射,是维持血压稳态的重要调节机制,它实时监测血压波动,以负反馈方式保持动脉血压相对稳定。压力反射功能减弱与高血压的发生发展密切相关[1,2],而且增加脑卒中、致死性心律失常和猝死等心血管事件的发生[3,4]。因此,探讨压力反射功能减弱的机制对预防高血压的发生及不良预后具有重要意义。
压力反射功能减弱可发生在反射弧任何一个环节,但主要与动脉压力感受器钝化和心血管中枢整合功能异常有关。刺激颈动脉窦压力感受器能降低高血压说明感受器敏感性降低是压力反射功能减弱的重要原因之一[5]。临床研究发现,高血压前期患者或者有高血压家族史的、但血压正常的年轻人,其压力感受器功能尚未改变时,压力反射功能就已降低[2]。动物实验也证实,自发性高血压大鼠(sponta-neously hypertensive rat,SHR)压力感受器传入冲动正常时,压力反射功能就已减弱,提示压力反射功能减弱可能与反射中枢异常有关,但压力反射功能减弱的中枢机制目前尚未完全明了。
许多研究表明,高血压与氧化应激密切相关。高血压患者血浆中丙二醛含量增加,而超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶及谷胱苷肽过氧化酶等活性下降[6],提示抗氧化能力减弱是造成氧化应激的原因之一。应用SOD拟似剂Tempol提高抗氧化能力则降低高血压[7],静脉给予Tempol还能改善肾性高血压大鼠受损的压力反射功能[8],但这主要作用于外周压力感受器。氧化应激对中枢血压调节的影响尚不清楚。我们先前实验证实,降低脑内活性氧水平能改善心衰大鼠受抑的压力反射功能[9]。但高血压状态压力反射功能减弱是否与脑内氧化应激有关报道甚少,造成中枢神经系统氧化应激的原因也不清楚。本实验以SHR为研究对象,改变脑内活性氧水平,观察对压力反射功能影响,探讨脑内氧化应激与高血压大鼠压力反射功能改变的关系;并检测脑组织丙二醛代表脑组织氧化应激水平,检测脑组织总抗氧化能力、SOD,CuZn-SOD、过氧化物酶活性以明确中枢氧化应激的来源。
1 材料与方法
1.1 主要试剂
4-羟基-2,2,6,6-四甲基氧基哌啶(4-hydroxy-2,2,6,6-tetramethylpiperidine 1-oxyl,Tempol)、二乙级二硫代氨基甲酸(diethyldithiocarbamic acid,DETC),美国Sigma公司),总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、铜/锌超氧化物歧化酶(CuZn-SOD)、过氧化氢酶 (catalase,CAT)、丙二醛(malondialdehyde,MDA)等试剂盒(南京建成生物技术有限公司),BCA试剂盒(碧云天生物技术公司)。
1.2 动物及分组
10只雄性自发性高血压大鼠(330~380 g)为实验组,12只正常血压Wistar大鼠为对照组(体重350~400 g),实验动物由中国科学院上海实验动物研究中心提供。
1.3 动物血压、心率记录
大鼠腹腔注射氨基甲酸乙酯(800 mg/kg)和α-氯醛糖(40 mg/kg),气管插管,自主呼吸。右侧股动脉插管记录血压和平均动脉压(MAP),同侧股静脉插管用于静脉给药。采用标准II导联记录心电,心电信号输入BL-420F型实验系统转化成心率(HR),MAP和HR信号同步保存于BL-420F型实验系统。
1.4 压力感受性反射功能检测
采用静脉注射血管舒缩剂改变血压以激活压力反射,以压力反射敏感性(baroreflex sensitivty,BRS)代表压力反射功能。BRS测定方法:静脉注射苯肾上腺素 (phenylephrine,PE)3 μ g/kg 、6 μ g/kg 、15 μ g/kg升高血压,引起反射性心动过缓,反映压力反射对升压的敏感性;静脉注射硝普钠(sodium nitroprusside,NP)3 μ g/kg 、6 μ g/kg 、15 μ g/kg 降低血压 ,引起反射性心动过速,反映压力反射对降压的敏感性;将血压变化值与心率变化值进行直线回归分析,该直线的斜率代表BRS。PE和NP交替给药,两次给药间隔10~20 min。
1.5 侧脑室给药
大鼠头部固定于脑立体定位仪上,根据Paxinos和Watson大鼠脑图谱进行定位。侧脑室坐标分别是:前囟后0.8 mm,中线旁开 1.4 mm,颅骨表面下3.8 mm。将微量进样器固定在微操纵器上,用于侧脑室给药。
为了观察脑内活性氧水平改变对压力反射功能的影响,SHR和正常大鼠分成两组:一组侧脑室注射SOD 拟似剂Tempol(50 μ mol/kg),另一组侧脑室注射 SOD 抑制剂 DETC(50 μ mol/kg),每组 5-6 只 。
Tempol和DETC给药前,向侧脑室注射生理盐水(10 μ l/3min)作为对照,随后静脉注射PE(6 μ g/kg)激活压力感受反射,测定压力反射敏感性(baroreflex sensitivity,BRS)。间隔 20~30 min后,侧脑室缓慢注射Tempol或 DETC,给药体积为 10 μ l,注射时间给3~4 min,给药后再测定BRS。实验结束,迅速取出全脑组织,-80℃保存备用。
1.6 下丘脑 MDA、T-AOC、SOD、CAT等测定
冻存脑组织在冰盘上分离出下丘脑,按1∶9加入预冷匀浆缓冲液,电动匀浆,低温离心(3 000 r/min)10 min,保留上清待测。BCA试剂盒测定上清液蛋白浓度。
MDA 、T-AOC、SOD、CAT等试剂盒购自南京建成生物技术公司,严格按照说明书进行操作,选择相应的波长,用酶标仪测定样品的吸光值,并用样品蛋白浓度进行标化。
1.7 统计学处理
2 结果
2.1 高血压大鼠MAP、HR、BRS变化
高血压大鼠MAP(138.5±11.3)mmHg明显高于正常大鼠(87.4±8.5)mmHg(P<0.01),HR(344±22)b/min与正常大鼠(328±26)b/min无明显差别。PE呈剂量依赖性升高血压,并引起反射性心率减慢(表1),两组升压幅度无明显差异,但高血压组心率减慢的幅度明显小于正常组(P<0.01,表1)。相反,NP则引起剂量依赖性降压和反射性心率增快,高血压大鼠降压幅度明显大于正常组(P<0.05),但心率变化却小于正常组(P<0.01,表2)。
Tab.1 PEinduced dose-dependent pressor and reflex bradycardia in SHR and control groups(±s)

Tab.1 PEinduced dose-dependent pressor and reflex bradycardia in SHR and control groups(±s)
SHR:Spontaneously hypertention rats;PE:Phenylephrine;MAP:Meah aortic pressure;HR:Heart ratie*P<0.05,**P<0.01 vs control group
Group Δ MAP(mmHg) ΔHR(b/min)Control 3 μ g/kg 17.3 ±4.4 -18.2±2.9(n=12) 6 μ g/kg 27.5 ±5.3 -57.9±7.0 15 μ g/kg 49.7±7.0 -111.8±16.7 SHR 3 μ g/kg 19.6 ±4.3 -15.1±2.4(n=10) 6 μ g/kg 32.6 ±6.6 -41.0±10.5**15 μ g/kg 60.7 ±5.4* -78.7±12.7**
Tab.2 NP induced dose-dependent depressor and reflex bradycardia in SHR and control groups(±s)

Tab.2 NP induced dose-dependent depressor and reflex bradycardia in SHR and control groups(±s)
SHR:Spontaneously hypertention rats;NP:Nitroprusside;MAP:Mean aortic pressure;HR:Heart ratie*P<0.05,**P<0.01 vs control group
Group Δ MAP(mmHg) ΔHR(b/min)Control 3 μ g/kg -9.4 ±3.2 10.6±4.1(n=12) 6 μ g/kg -17.3 ±5.1 23.2±6.81 15 μ g/kg -41.9 ±8.2 54.2±12.8 SHR 3 μ g/kg -13.3 ±3.1 6.6±2.1(n=10) 6 μ g/kg -29.8 ±7.0* 15.9±5.41 15 μ g/kg -55±9.7** 31.7±8.9**
将心率变化与血压变化进行直线相关分析,该直线的斜率代表平均的BRS。PE诱导高血压大鼠的BRS为-1.3(r=0.89)明显小于正常大鼠-2.3(r=0.92,P<0.01,图 1);同样地,NP诱导的BRS,高血压组为-0.6(r=0.88)也小于正常大鼠-1.3(r=0.94,P<0.01,图 1)。
2.2 Tempol和DETC对高血压和正常大鼠BRS的影响
为了判断高血压大鼠压力反射敏感性降低是否与脑内氧化应激有关,侧脑室缓慢注射超氧阴离子捕获剂Tempol。与注射生理盐水相比(表3),Tempol能增强高血压大鼠BRS(P<0.05),但对正常大鼠BRS无明显影响;而侧脑室给予SOD抑制剂DETC,则显著降低正常大鼠BRS(P<0.01,表3),DETC轻度抑制高血压大鼠BRS(P<0.05)。
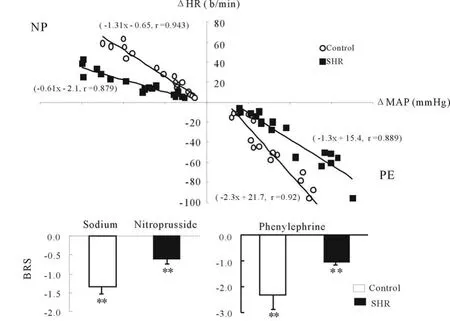
Fig.1 Linear regression slopes represent average BRS obtained from the data on MAP-HR relationship induced by phenylephrine and nitroprusside in SHR and Control group
Tab.3 Effects of intracerebroventricular infusion of tempol and DETC on BRS in SHR and control group(±s)

Tab.3 Effects of intracerebroventricular infusion of tempol and DETC on BRS in SHR and control group(±s)
NS:Normal saline;BRS:Baroreflex sensitivity;SHR:Spontaneously hypertention rats*P<0.05,**P<0.01 vs NS
Group n BRS BRS NS Tempol NS DETC Control 6 2.1±0.38 2.2±0.45 2.3±0.32 1.52±0.46**SHR 5 1.06±0.361.84±0.31*0.94±0.12**0.61±0.13*
2.3 高血压大鼠下丘脑MDA含量、总抗氧化能力和抗氧化酶活性改变
脂质过氧化产物丙二醛(MDA)是代表氧化应激水平的重要标志物。高血压大鼠下丘脑MDA明显高于正常大鼠(P<0.01,图2A)。相反,高血压大鼠下丘脑总抗氧化能力(T-AOC)比正常大鼠降低41%(P<0.05,图2B),而且总SOD和Cu-ZnSOD活性较正常大鼠明显降低(P<0.05,图2C;P<0.05,图2D)。
过氧化氢酶(CAT)是降解H2O2的抗氧化酶,高血压大鼠下丘脑CAT为19.7±9.1 U/mg prot。较正常大鼠44.36±15 U/mg prot.降低了53%(P<0.01)。
3 讨论
动脉压力反射功能减弱与高血压发病密切相关,本实验采用血管舒缩剂PE和NP激活压力反射,以BRS评价压力反射功能。结果显示,高血压大鼠压力反射调节心率的作用明显降低,无论是PE的升压还是NP的降压反应,高血压大鼠BRS均明显低于正常大鼠,表明高血压状态下压力反射功能减弱。这与高血压患者[1,2]和高血压大鼠[8]所观察的结果一致。
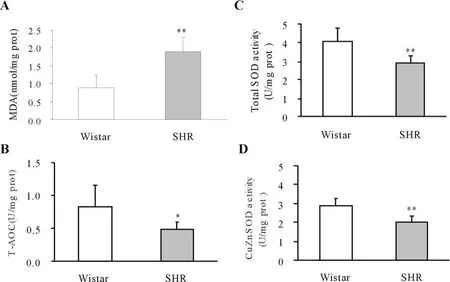
Fig.2 Changes in MDA content,total antioxidant capacity and antioxidant enzyme activity in hypothalamus.
压力反射功能减弱主要与感受器敏感性降低和反射中枢整合功能异常有关。有研究认为,高血压动脉硬化降低颈动脉窦和主动脉弓压力感受器敏感性,传入冲动减少,导致压力反射功能减弱,因此,刺激压力感受器能增强压力反射功能,产生降压作用[5]。压力反射功能降低的外周机制已有较统一认识,但其中枢机制较复杂,目前尚未完全阐明。
下丘脑是压力反射重要的整合中枢,其下行纤维投射到延髓头端腹外侧区和脊髓中间外侧柱,影响交感传出神经活动,从而调节压力反射功能。Gao等[10]报道心衰家兔延髓头端腹外侧区超氧阴离子增加削弱压力反射功能,我们实验室曾报道心衰大鼠压力反射功能衰减与下丘脑活性氧水平升高密切相关[9]。本实验也观察到,高血压大鼠下丘脑MDA水平明显高于对照组,表明压力反射功能降低与心血管中枢氧化应激有关。为了进一步明确氧化应激对压力反射功能的影响,本实验应用侧脑室给药,结果显示SOD拟似剂Tempol能增强高血压大鼠压力反射调节心率的作用,恢复受损BRS;相反,SOD抑制剂DETC则明显抑制高血压和正常大鼠压力反射功能,降低两组大鼠BRS。Botelho-Ono等[8]人在肾性高血压大鼠也观察到,静脉给予NADPH氧化酶抑制剂apocynin和维生素C能恢复受损的BRS。上述结果提示降低氧化应激能恢复受损的压力反射功能,从另一方面证明中枢氧化应激降低压力反射功能。
机体氧化应激取决于自由基生成与清除之间的平衡,SOD是体内重要的抗氧化酶。有报道,高血压患者血浆SOD、过氧化氢酶及谷胱苷肽过氧化酶等活性下降[6],提示抗氧化酶活性降低可能是高血压氧化应激的原因之一。本实验结果显示,高血压大鼠下丘脑总抗氧化能力低于正常大鼠,总SOD活性和CuZn-SOD活性较正常对照组分别降低了30%和32%,过氧化氢酶活性也比正常大鼠降低53%。本实验结果表明高血压大鼠中枢氧化应激可能源于下丘脑抗氧化酶活性降低。
总之,本实验证明高血压压力反射调节心率功能减弱与下丘脑氧化应激密切相关,中枢抗氧化酶活性降低可能是导致氧化应激的重要机制。
[1]Narkiewicz K,Grassi G.Impaired baroreflex sensitivity as a potential marker of cardiovascular riskin hypertension[J].J Hypertens,2008,26(7):1303-1304.
[2] Krontor ádová K,Honz í ková N,Fiser B,et al.Overweight anddecreased baroreflex sensitivity asindependent risk factors for hypertension in children,adolescents,and young adults[J].Physiol Res,2008,57(3):385-391.
[3] Celovská D,Stasko J,Gonsorc í k J,et al.The significance of baroreflex sensitivity in hypertensive subjects with stroke[J].Physiol Res,2010,59(4):537-543.
[4]Johansson M,Gao S A,Friberg P,et al.Baroreflex effectiveness index and baroreflex sensitivity predict all-cause mortality and sudden death in hypertensive patients with chronic renal failure[J].J Hypertens,2007,25(1):163-168.
[5]Heusser K,Tank J,Engeli S,et al.Carotid baroreceptor stimulation,sympathetic activity,baroreflex function,and blood pressure in hypertensive patients[J].Hypertens,2010,55(3):619-626.
[6]Redón J,OlivaM R,Tormos C,et al.Antioxidant activities and oxidative stress by products in human hypertension[J].Hypertens,2003,41(5):1096-1101.
[7]Chen X,PatelK,ConnorsSG,et al.Acute antihypertensive action of Tempol in the spontaneously hypertensive rat[J].Am J Physiol Heart Circ Physiol,2007,293(6):H3246-3253.
[8]Botelho-Ono M S,Pina H V,Sousa K H,et al.Acute superoxide scavenging restoresdepressedbaroreflex sensitivity in renovascular hypertensive rats[J].Auton Neurosci,2011,159(1-2):38-44.
[9]潘燕霞,王 玮.中枢活性氧升高介导心力衰竭时压力感受性反射功能衰减[J].中国病理生理杂志,2009,25(5):833-838.
[10]Gao L,Wang W,Li Y L,et al.Superoxide mediates sympathoexcitation in heart failure:roles of angiotensin II and NADPH oxidase[J].Circ Res,2004,95(9):937-944.

