他克莫司联合小剂量激素治疗成人激素依赖或激素抵抗微小病变肾病的疗效
于 锐,田 密,刘大军,李德天
微小病变肾病(Minimal change disease,MCD)又称微小病变型肾小球病,是指临床表现为肾病综合征,光镜下肾小球结构大致正常,电镜下仅以组细胞足突广泛消失为主要特点的一类肾小球疾病。其发病高峰在儿童及青少年,成人肾病综合征中约10%-30%为原发性MCD。MCD治疗首选糖皮质激素,90%可缓解,但易于复发。近年来,他克莫司越来越多地用于肾小球疾病中。本研究旨在观察他克莫司联合激素在不同疗程中对于成人MCD治疗效果,为临床治疗成人MCD提供合适的理论依据。
1 研究对象与方法
1.1 研究对象 2007年5月至2010年2月我院收治经皮肾活检诊断微小病变性肾病26例,年龄16~68岁,平均(35.1±14.2)岁,男17例,女9例,见表1。入组标准:(1)病理诊断为 MCD。(2)血肌酐(Scr)<133 μmol/L。(3)应用足量糖皮质激素1 mg/(kg·d)治疗8~12周不缓解,或缓解后复发者。(4)育龄女性患者妊娠试验结果阴性,并同意采取避孕措施。排除标准:(1)近1个月未接受其他细胞毒性药物、免疫抑制剂等药物治疗。(2)伴严重合并症,如重症感染、恶性肿瘤、人类免疫缺陷病毒(HIV)感染史、乙型肝炎病毒(HBV)血清学指标 HBsAg、HBeAg和抗 HBcAb阳性。(3)其他严重肾脏疾病、糖尿病。(4)对大环内酯类药物过敏者。将26例患者随机分为短疗程组(给药治疗6个月)和长疗程组(给药治疗18个月),其中短疗程组12例,长疗程组14例。随访时限为长疗程组治疗结束。
1.2 治疗方案 两组均采用他克莫司联合口服泼尼松治疗。他克莫司给药方案:他克莫司起始口服剂量0.05 mg/(kg·d),分2次于餐前1 h服用,连续6个月,短疗程组治疗结束;每周检测血药浓度,达目标血药浓度后每月检测血药浓度,要求维持血药浓度4~8 ng/mL,如果浓度偏低,相应加大用药剂量,但不超过0.15 mg/(kg·d)。长疗程组则在治疗6个月后继续给予他克莫司1 mg/d,分2次口服,12个月后停药。治疗过程中出现下列情况,需要调整剂量:(1)药物浓度>8 μg/L,用 药 剂 量 减 少 30%,药 物 浓 度<4 μg/L,剂量增加30%。(2)服用他克莫司过程中出现肾功能恶化(肾功能正常者出现肾功能不全,或者肾功能不全者血清肌酐上升≥30%),剂量应减少30%,2周后复查肾功能无好转,则停药。(3)用药后如果出现白细胞减少,WBC 2×109/L~3×109/L,他克莫司剂量减半,1周后不能恢复则停药。WBC<2×109/L,或中性粒细胞绝对值<1×109/L,暂时停药,如不能恢复则退出。(5)出现严重感染或其他不可解释的严重并发症时退出试验。泼尼松在两个治疗组中均从0.5 mg/(kg·d)开始,8周后每周用量减少10%,减至10 mg/d维持至短疗程组治疗结束。

表1 入组患者基线数据
1.3 其他治疗 两组均联合应用调脂药物。如治疗前已经使用血管紧张素转换酶抑制剂(ACEI)或血管紧张素Ⅱ受体阻滞剂(ARB)4周以上,则继续使用,试验过程中不增加剂量。治疗过程中如果其他降压药物能将血压控制在140/90 mmHg以下,则不用ACEI或ARB。不能同时应用其他免疫抑制剂或者细胞毒药物。
1.4 观察指标 他克莫司治疗后第1个月每周随访1次,以后每月随访1次。随访指标包括尿常规、24 h尿蛋白定量、肾功能,血清白蛋白、肝功能、血常规、血糖、他克莫司血药浓度。
1.5 疗效评价 完全缓解(CR):尿蛋白转阴或微量保持3 d以上。部分缓解(PR):24 h尿蛋白定量0.3~3.0 g,且尿蛋白下降超过基础值的50%,血清白蛋白≥30 g/L,Scr正常。无效(NR):24 h尿蛋白定量≥3.0 g,或血清白蛋白<30 g/L。复发:缓解后再出现3 d以上的2+的蛋白尿[4]。
1.6 统计学方法 采用SPSS 11.5软件处理数据,计量资料用均数±标准差表示。组间各种构成比应用卡方检验,计量资料的比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效与复发情况 在治疗6个月后,短疗程组及长疗程组均有9例CR,2例PR,1例NR,长疗程组中有2例因严重不良反应中途退出研究。治疗过程中17例患者24 h尿蛋白定量在2周时开始明显下降,其中13例在治疗1个月时尿蛋白转阴。治疗2周时,所有病例血清白蛋白即有显著上升,2个月时有11例血清白蛋白升至正常。6个月治疗结束时,短疗程组及长疗程组缓解率均为91.6%,完全缓解率均为75%;且在6个月过程中短疗程组及长疗程组缓解病例无1例复发。脱落2例病例不计入统计。见表2及表4。
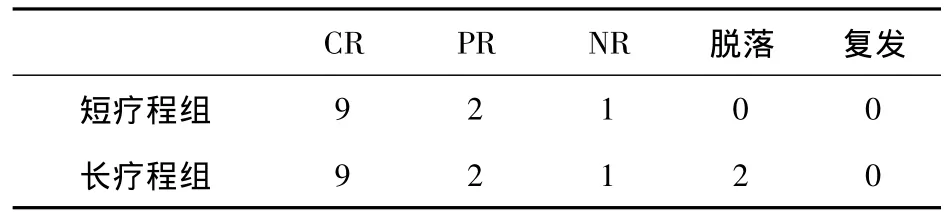
表2 6个月结束时疗效及复发情况
长疗程组疗程结束时,短疗程组6例复发,长疗程组有9例CR,2例PR,1例 NR,无新脱落病例,1例复发。脱落病例中1例为68岁患者用药2周后出现严重感染退出研究,另1例为用药2个月时尿蛋白定量明显下降,但尚未达部分缓解,出现白细胞明显下降,停药退出研究。研究结束时,短疗程组复发率为50%,长疗程组复发率为16.7%,两组有显著性差异(P<0.05)。见表3与表5。
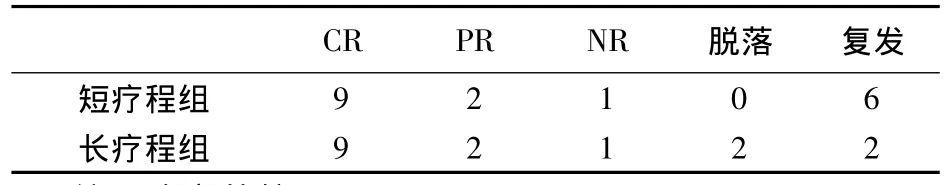
表3 18个月结束时疗效及复发情况(例)
2.3 严重不良反应 本研究中长疗程组有2例患者因严重不良反应退出研究,未计入统计,但2例严重不良反应均发生于治疗开始后前6个月内,6个月后至研究结束,未再出现严重不良反应,表明诱导缓解后小剂量他克莫司维持治疗并不增加严重不良反应发生率。
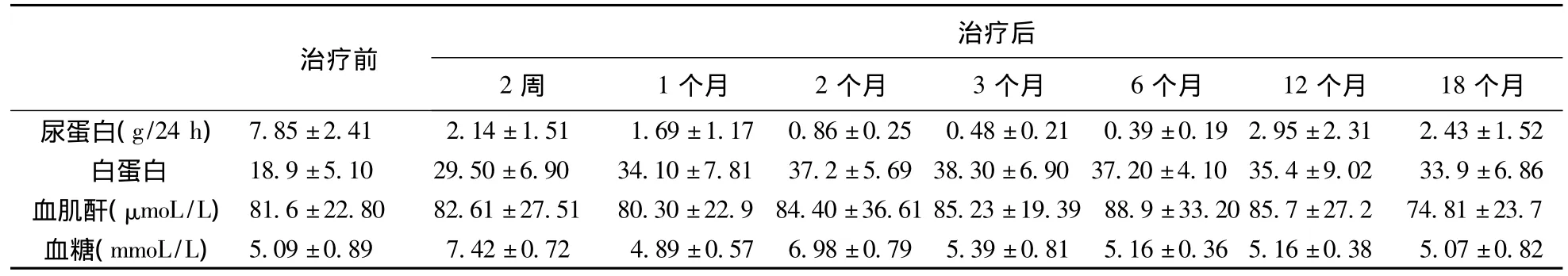
表4 短疗程组10例患者尿蛋白及生化指标变化
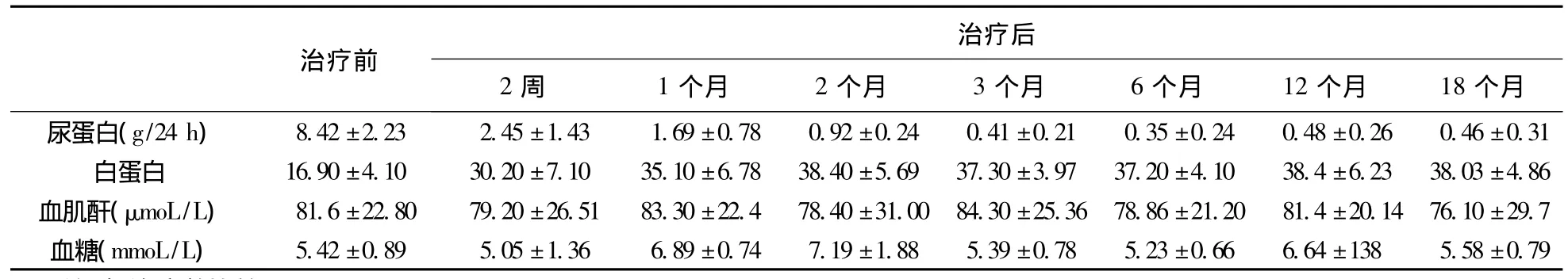
表5 长疗程组10例患者尿蛋白及生化指标变化
3 讨论
他克莫司(Tacrolimous,FK506)是新型强效免疫抑制剂,能全面抑制T淋巴细胞的作用[1],属于新一代的钙调神经磷酸酶抑制剂。其作用机制是通过干扰钙依赖性信号传导途径,引起钙离子内流,使细胞内钙离子浓度增高,启动钙依赖性细胞内转录体系,激活的T细胞核因子就不能去磷酸化,使转录IL2、IL2R、FIN-I等的基因受到遏制,从而阻止T细胞的增生,还可以抑制早期淋巴细胞聚集,并且阻止已聚集的淋巴细胞对其他炎症细胞的吸引[2]。他克莫司的这种双重抑制作用不仅可用于防止免疫反应的发生,还能治疗已发生的免疫反应及自身免疫性疾病[3]。大量动物实验、临床研究表明,它具有与CsA相似但更广泛的免疫抑制作用,效力比CsA高10~100倍,但毒副作用比CsA更少[4]。另外,他克莫司还可以直接作用于足细胞,保护足细胞的结构和功能,Synaptopodin是肾小球足细胞的表达蛋白,对于维持足细胞的正常形态及功能起着重要的作用。其活性受到抑制,可导致肾小球滤过膜的通透性增高,引起临床蛋白尿。钙调磷酸酶抑制剂(CsA和他克莫司)可通过抑制 Synaptopodin去磷酸化,维持其活性[5]。
目前,对激素依赖或激素抵抗MCD应用免疫抑制剂治疗,报道较多的是CTX或CsA,而应用他克莫司研究尚少,且多在儿童肾病中进行研究,成人鲜有报道。本研究首次前瞻性观察了他克莫司与小剂量激素联合应用在不同疗程组中治疗成人激素依赖或激素抵抗MCD的临床疗效及复发率。研究发现,无论在短疗程组(6个月)还是长疗程组(18个月),他克莫司联合激素治疗后患者能很快缓解,经过2个月的治疗,患者24 h尿蛋白定量显著下降、血清白蛋白明显升高,6个月完全缓解率及缓解率分别高达75%、91.6%,18个月治疗结束时,短疗程组复发率为50%,长疗程组复发率为16.7%,两组有显著性差异(P<0.05)。表明成人激素依赖或激素抵抗MCD应用他克莫司联合小剂量激素治疗能够成功诱导缓解,且长时间小剂量维持,可明显降低复发率。Xiayu等[6]的研究中,用药24周治疗成人激素依赖性MCD,给予他克莫司联合小剂量激素组(血药浓度维持在4~8 ng/mL),完全缓解率为90.9%,静脉环磷酰胺联合小剂量激素组缓解率为76.9%,在接下来(23.0±10.1)个月的随访中,两组的复发率为40%及50%。在Heng等[7]的研究中,他克莫司联合激素治疗成人激素抵抗性MCD 6个月缓解率为78.9%。本研究中6个月结束时完全缓解率为75%,明显低于Xiayu等的研究,结合Heng等的研究,考虑可能是因为本研究入组病例包括激素依赖性及激素抵抗性MCD病例。另有研究[8-10]显示,在儿童激素抵抗性肾病综合征的治疗中,他克莫司联合激素治疗是有效且安全的诱导缓解药物,其疗效与环孢素A联合激素治疗相当,但他克莫司能明显降低复发,减少不良反应。结合以上研究及本研究,表明他克莫司联合小剂量激素治疗成人激素依赖或激素抵抗微小变肾病是合适选择,且应长期小剂量维持,但具体维持剂量及持续时间,药物不良反应等尚有待于进一步研究。
:
[1]李红梅,施向东.他克莫司治疗激素抵抗性肾病综合征[J].实用医学杂志,2009,25(22):3871-3873.
[2]陈伟珍,陈德君,徐光标.他克莫司对特发性膜性肾病的治疗观察[J].实用医学杂志,2009,25(10):1674-1675.
[3]Undre NA,Stevenson P,Schafer A.Pharmacokinetics oftacrolimus:clinically relevant aspects [J].Transplant Proc,1999,31(7A):21s-24s.
[4]Jiang H,Wylln C,Pan F,et al.Tacrolimus and cyclosporin differ in their eapacity to overcome ongoing allograft rejection as a result of their differential abilities to inhibit inierleukin-10 Produetion[J].TransPlantatio,2002,73:1808-1812.
[5]Faul C,Donnelly M,Merscher-Gomez S,et al.The cytoskeleton of kidney podocytes a direct larget of the antiproteiuric effect of cyclosporine A[J].Nature Medice,2008,14(9):931-938.
[6]Xiayu Li,Heng Li,Jianghua Chen,et al.Tacrolimus as a steroid-sparing agent for adults with steroid-dependent minimal change nephrotic syndrome[J].Nephrol Dial Transplant,2008,23:1919-1925.
[7]Heng Li,Xiang Shi,Hong Shen,et al.Tacrolimus versus intravenous cyclophosphamide therapy in adults with steroid-resistant idiopathic minimal change nephropathy:a nonrandomized controlled trial in china.ASN2010[F-PO1202].
[8]ButaniL,RamsamoojR.experience with tacrolimus in children with steroid-resistant nephrotic syndrome[J].Pediatr Nephrol,2009,24(8):1517-1523.
[9]夏正坤,刘光陵,高原赋,等.他克莫司在儿童原发性肾病综合征中的应用[J].中华肾脏病杂志,2009,25(3):187-190.
[10]Choudhry S,Bagga A,Hari P,et al.Efficacry and safty of tacrolimus versus cyclosporine in children with steroid-resistant nephrotic syndrome:arandomized controlled trial[J].Am J Kidney Dis,2009,53:760-769.

