TRAIL联合顺铂诱导非小细胞肺癌细胞凋亡的作用
郑中华 国 巍 于洪泉 郭 敏 丁丽娟 赵丽微 齐 玲
(吉林医药学院病理学教研室,吉林 吉林 132013)
肿瘤坏死因子相关凋亡诱导配体(TRAIL)是体内天然的抗肿瘤药物,可由人体的免疫系统正常表达,目前在美国TRAIL已进入临床Ⅱ期研究阶段〔1〕。本课题组在以往研究中发现,TRAIL在胶质母细胞瘤诱导凋亡过程中,发生凋亡抵抗而不能引起肿瘤细胞凋亡〔2〕。因此,本文将研究TRAIL和化疗药物顺铂对非小细胞肺癌细胞联合诱导凋亡的作用,为TRAIL作为新药开发提供更进一步的理论依据,此方面研究国内还未见相关报道。
1 材料与方法
1.1 细胞培养 从液氮中取出冻存的非小细胞肺癌细胞H596细胞株,37℃水浴后离心弃上清,将细胞用含10%小牛血清的RPMI 1640(美国Gibco公司)培养液,在37℃,5%CO2及饱和湿度下培养,隔日换液,1∶3传代。
1.2 TRAIL和顺铂作用细胞后细胞死亡率检测〔3〕待细胞生长至90%时,用0.25%胰酶消化成单细胞悬液,以每孔8×103个细胞密度种于96孔培养板中,培养24 h后单独加入rhTRAIL(英国Peprotech公司,药物终浓度分别为0、0.01、0.1、1、10和100 ng/ml)或与10μg/ml顺铂联合作用,24 h后弃上清,0.01 mol/L PBS洗板,加入新鲜配制的酸性磷酸酶底物检测溶液(上海生物工程技术公司)100μl,继续培养90 min,每孔加入0.1 mol/L氢氧化钠10μl室温孵育5 min。酶标仪405 nm处测定各孔吸光度(A)值,计算细胞死亡率 =(1-100 ×A405测定组/A405对照组)×100%。
1.3 统计学分析 采用SPSS17.0软件进行分析,结果以x±s表示,采用t检验。
2 结果
TRAIL(0.01、0.1、1、10、和 100 ng/ml)单独或与10 μg/ml顺铂联合作用细胞24 h,通过酸性磷酸酶法分析结果显示:TRAIL单独作用时,TRAIL浓度为1 ng/ml时,细胞出现死亡,死亡率为4.37%;随着药物浓度升高,细胞死亡率增加,10和100 ng/ml组细胞死亡率可达到13.15%和19.33%,与对照组相比有显著性差异(P<0.05);加入顺铂后可以明显提高细胞的死亡率,0.1 ng/ml时细胞就会出现死亡,以后随着TRAIL药物浓度升高,死亡率仍增加明显,与对照组相比有显著性差异(P<0.05或 P<0.01),见表1。
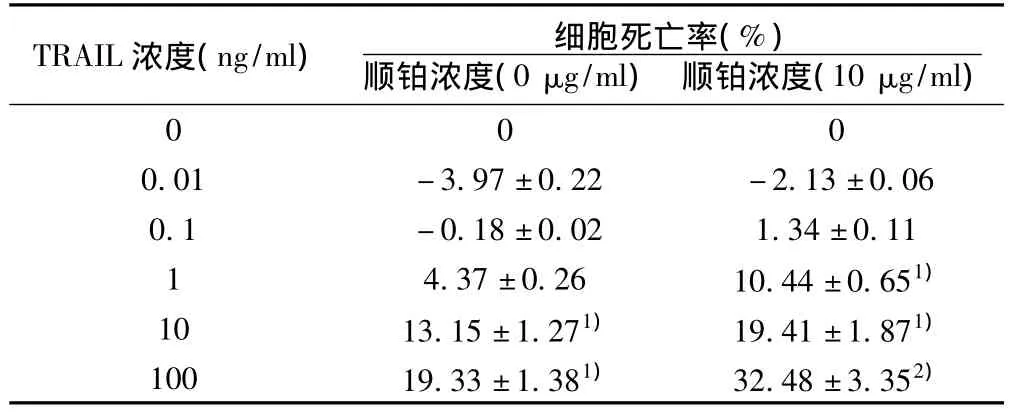
表1 TRAIL联合顺铂诱导非小细胞肺癌细胞凋亡的作用(x±s)
3 讨论
TRAIL是肿瘤坏死因子超家族中的成员之一,它能诱导多种肿瘤细胞发生凋亡,而对正常组织和细胞则无明显毒性作用〔1〕。TRAIL选择性诱导肿瘤细胞凋亡而不损伤正常细胞的特点,使其成为一种近年来研究较多的潜在的抗肿瘤药物〔4,5〕。TRAIL作用于细胞后,与细胞表面的死亡受体(DR)4或DR5结合后,结合细胞内的Fas相关死亡结构域(FADD),再募集半胱氨酸蛋白酶8,使半胱氨酸蛋白酶8发生活化〔6,7〕,引起细胞死亡。化疗药物可以非特异性的与肿瘤细胞结合,化疗药物在应用治疗量时,也会引起广泛的化疗副反应。最近的研究显示,非毒性剂量的化疗药物可以增加TRAIL对肿瘤细胞诱导凋亡作用〔8〕。也有一些明显的证据表明,TRAIL可以作为治疗非小细胞肺癌的药物,尤其是与化疗药物联合作用时可以克服TRAIL抵抗作用〔9〕。
本实验采用非小细胞肺癌细胞H596细胞株,应用不同浓度TRAIL单独作用24 h后发现:从1 ng/ml TRAIL组开始,随着药物浓度升高,细胞死亡率开始增加,10和100 ng/ml组细胞凋亡水平增加较为明显,与对照组相比有统计学意义。应用不同浓度TRAIL联合顺铂作用24 h后发现:加入顺铂后可以明显提高细胞的死亡率,0.1 ng/ml细胞就会出现死亡,随着TRAIL药物浓度升高,死亡率增加明显(P<0.05或P<0.01)。说明顺铂可以增加TRAIL对非小细胞肺癌的诱导凋亡作用,但还需要进一步深入研究两者作用的机制。
1 Anita C,Ling Qi,Mulligan P,et al.TRAIL agonists on clinical trials for cancer therapy:the promises and the challenges〔J〕.Rev Recent Clin Trials,(Online),2009;(4):34-41.
2 Li YC,Tzeng CC,Song JH,et al.Genomic alterations in human malignant glioma cells associate with the cell resistance to the combination treatment with tumor necrosis factor-related apoptosis-inducing ligand and chemotherapy〔J〕.Clin Cancer Res,2006;12(9):2716-29.
3 齐 玲,于洪泉,丁丽娟,等.Caspase-8在胶质母细胞瘤抵抗TRAIL诱导凋亡中的作用〔J〕.吉林大学学报(医学版),2011;37(4):612-6.
4 Walczak H,Miller RE,Ariail K,et al.Tumoricidal activity of tumor necrosis factor-related apoptosis-inducing ligand in vivo〔J〕.Nat Med,1999;5(2):157-63.
5 Ashkenazi A.Targeting death and decoy receptors of the tumour-necrosis factor superfamily〔J〕.Nat Rev Cancer,2002;2(6):420-30.
6 南栗岩,齐 玲,肖振晶,等.原代培养的恶性胶质瘤细胞表达死亡受体与TRAIL抵抗的关系〔J〕.中国老年学杂志,2011;9(31):3591-2.
7 Bellail AC,Tse MC,Song JH,et al.DR5-mediated DISC controls caspase-8 cleavage and initiation of apoptosis in human glioblastomas〔J〕.JCell Mol Med,2010;14(6A):1303-17.
8 Song JH,Tse MC,Bellail A,et al.Lipid rafts and nonrafts mediate tumor necrosis factor related apoptosis inducing ligand induced apoptotic and nonapoptotic signals in non small cell lung carcinoma cells〔J〕.Cancer Res,2007;67(14):6946.
9 Gajewski TF.On the TRAIL toward death receptor based cancer therapeutics〔J〕.J Clin Oncol, 2007;25:1305.

