白纹伊蚊体内Wolbachia和WO噬菌体的相对含量和侵染关系
张东京,吴 瑜,何 蔼,杨 潇,吴贤生,梁格豪,郑展图,李卓雅,詹希美,郑小英
2.中山大学中山医学院临床医学院本科生,广州 510080
共生菌Wolbachia最早于1924年由Hertig和Wolbach在尖音库蚊(Culexpipiens)的生殖细胞中发现,后来被命名为Wolbachiapipientis,其分类地位属于变形菌纲(Proteobacteria)的α亚群,立克次体目(Rickettsiaceae),无形体(Anaplasmataceae),沃尔巴克体属(Wolbachia)。Wolbachia在自然界中广泛存在,其主要宿主为节肢动物,整个自然界估计有20%~76% 种节肢动物受到感染。Wolbachia拥有A-H等八个菌群,在节肢动物中感染的类型主要是A、B两个菌群,其中A菌群可分为8个亚群,B菌群可分为4个亚群。在与宿主的长期进化中,Wolbachia对宿主的作用主要在生殖调控方面,如诱导细胞质不亲和(cytoplasmic incompatibility,CI)、诱导孤雌生殖(parthenogenesis-inducing,PI)、雌 性 化 (feminizing)和 杀 雄 作 用 (malekilling)等[1]。
噬菌体是一种专门寄生于细菌的一类专性病毒,Wolbachia虽然是一种胞内菌,但是在多种昆虫中已经发现有噬菌体侵染该共生菌。Masui等[2]最早是在地中海粉斑螟(Ephestiakuehniella)的Wolbachia中分离出噬菌体颗粒,并命名为 WO噬菌体(phage WO)。通过电镜观察,发现该颗粒直径约为40 nm,具有尾状结构。WO噬菌体基因组约含20 kbp片段,是一种线性双螺旋DNA。Fujii等[3]在感染有Wolbachia的蚊虫体内也观察到了 WO噬菌体广泛存在于Wolbachia的基因组中,它既可以嵌入到Wolbachia的染色体中,也可以自由地存在于细胞质中。WO噬菌体被认为是促进Wolbachia基因组进化的遗传因子,不仅参与了Wolbachia入侵宿主的机制,还和Wolbachia两者一起相互作用调控宿主的生殖[4]。
在自然界中,大部分白纹伊蚊(Aedesalbopictus)都感染WolbachiaA、B组两个菌株系,分别为wAlb A和wAlbB[5]。在笔者前期的研究中,通过PCR方法也发现白纹伊蚊雌蚊的各个组织部位均有wAlb A和wAlbB的双重感染。但是各个组织部位是否也都有 WO噬菌体侵染仍不清楚,因此本实验通过引物PCR的方法来检测白纹伊蚊雌蚊的各个组织器官是否存在 WO噬菌体侵染。
在蚊虫中,Wolbachia对宿主的影响主要是细胞质不亲和作用(CI)。CI是指精子和卵子之间的细胞质不融合,直接结果是导致宿主卵不能孵化。CI在对蚊虫的种群数量的压制上具有非常显著的效果[6]。目前细胞质不亲和的机制仍不清楚,但研究发现,CI的强度可能与Wolbachia的密度、菌系和宿主有关,最近有学者认为也可能与噬菌体 WO的侵染有关系[7]。因此我们通过荧光实时定量PCR(Q-PCR)方法对白纹伊蚊雌蚊各个组织器官的Wolbachia和 WO噬菌体进行时空定量分析,试图在量上寻找Wolbachia、WO噬菌体和宿主三者之间的相关性,为进一步揭示这三者之间相互作用的分子机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 蚊种及来源 白纹伊蚊广州株实验种群由中山大学中山医学院寄生虫教研室驯养传代保种50代。饲养条件为温度27±1℃,湿度80±5%,光照周期16 h/d,幼虫饲以酵母片,成蚊饲以10%葡萄糖水。
1.1.2 主要试剂和仪器 试剂:动物组织基因组提取试剂盒(艾德莱)、DNA 聚合酶(Promega)、DNA Ladder、凝胶回收试剂盒、质粒提取试剂盒(东盛公司)、p MD 18-T Vector(Ta KaRa)、荧光实时定量PCR试剂(Thunder Bird)、其他(国产分析纯试剂)
仪器:电动匀浆器(Kontes,美国)、电泳仪(DYY-6C,北京)、梯度PCR扩增仪(Bio Metra,德国)、凝胶成像系统(Tanon,上海)、Milli-Q型纯水仪(Millipore,美国)、荧光实时定量PCR检测仪(Roche 480)、超微量紫外分光光度计(NanoDrop 200c)
1.2 方法
1.2.1 白纹伊蚊雌蚊基因组DNA抽提 取刚羽化24 h以内的白纹伊蚊(雌雄均有)于40×40×40 cm 的空笼子中饲养。分别于第1、5、10、15、20、30、40 d各取雌蚊5只,麻醉后于解剖镜下解剖蚊虫的头部、卵巢、中肠、马氏管、脂肪体和胸部,分别置于含有180μL裂解液的1.5 m L离心管中,利用组织研磨杵进行匀浆后,按照艾德莱公司产品动物组织基因组提取试剂盒操作说明提取蚊虫不同组织的基因组DNA。将提取到的DNA用超微量紫外分光光度计进行OD值测定,取OD260/OD280比值在1.7~2.1之间的样本进行下一步实验。1.2.2 PCR检测 白纹伊蚊为wAlb A与wAlbB的双重感染,也叫“超感染”。PCR 扩增Wolbachiawsp基因(编码Wolbachia的表面膜蛋白基因)和 WO噬菌体orf7基因(编码 WO噬菌体的衣壳蛋白基因),引物序列等见表1[8,10]。PCR 反应体系:Go Taq®Master Mix(Go Taq®DNA 聚合酶,d NTPs,MgCl2和反应缓冲液1X溶液)10μL,引物(20μmol/L)各0.5μL,DNA模板1μL,dd H2O 8 μL。反应条件:95℃3 min;95℃60 s,55/52℃60 s,72℃1 min,35个循环;72℃延伸7 min。取5μL PCR产物于0.1%的琼脂糖凝胶电泳,紫外灯下观察并记录结果。
1.2.3 Q-PCR检测 采用SYBR Green荧光染料法,利用Roche LightCycler®480实时定量PCR仪进行Q-PCR检测,观察wAlb A、wAlbB与 WO噬菌体基因组DNA在白纹伊蚊体内不同组织器官内的动态变化。取第1、5、10、15、20、30、40 d的白纹伊蚊雌蚊各5只,在显微镜下解剖其组织器官。每个时间点取样1次,每个样检测3次,结果取3次的平均值。测定的平均值用相同时期蚊虫内参基因-核糖体蛋白S7(rpS7)的DNA表达平均水平进行标准化处理,得到wAlb A、wAlbB与 WO噬菌体基因组DNA在白纹伊蚊不同组织的相对含量。QPCR 的引物序列见表1[8-9]。20μL的 Q-PCR 反应体系包括:10μL 2 X SYBR qPCR MIX,上下游引物各0.5μL,1μL DNA模板和8μL水。反应条件是:95℃3 min;95℃15 s,58/52/59℃30 s,72℃30 s,40个循环。将wAlb A、wAlbB与 WO噬菌体三者重组质粒用超微量紫外分光光度计进行浓度测定,然后用去离子水进行10倍梯度稀释,用作QPCR的标准品。Q-PCR结果用 LightCycler 480 software release 1.0.5软件进行数据结果分析、标准曲线绘制和融解曲线分析。

表1 PCR和Q-PCR检测引物序列表Tab.1 The primer sequences of PCR and Q-PCR
1.2.4 统计学方法分析 数据结果用SPSS 10.0统计软件包对不同组织间Wolbachia和 WO噬菌体含量进行单因素方差分析(one-way ANOVA),对wAlbB和WO噬菌体含量进行关联性分析(correction anaiysis)。
2 结 果
2.1 白纹伊蚊雌蚊不同组织器官Wolbachia的感染情况 用PCR方法对实验室饲养的白纹伊蚊雌蚊(第5 d)进行wAlb A与wAlbB的wsp基因扩增,分别在的头部、卵巢、中肠、马氏管、脂肪体和胸部中均扩增出501 bp和380 bp大小的片段(图1),将PCR产物交华大基因公司测序,将测序片段在美国生物信息中心(NCBI)网站进行BLAST搜索,证实为wAlb A和wAlbB,这说明在白纹伊蚊雌蚊的各个组织器官中均存在wAlb A与wAlbB双重感染。
2.2 白纹伊蚊雌蚊不同组织器官 WO噬菌体的侵染情况 对白纹伊蚊雌蚊 WO噬菌体的orf7基因进行PCR扩增,分别在的头部、卵巢、中肠、马氏管、脂肪体和胸部中扩增出232 bp大小的片段(图2),将PCR产物交华大基因公司测序,将测序片段NCBI网站进行BLAST搜索,发现本序列与Gen-Bank中已注册的 WO噬菌体orf7基因序列同源性达99%以上,可证实为 WO噬菌体,这说明在白纹伊蚊雌蚊的各个组织器官中均有 WO噬菌体的侵染。
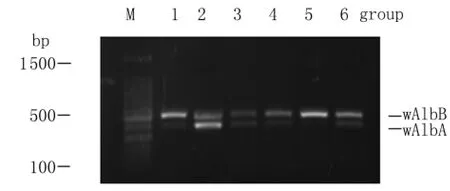
图1 白纹伊蚊雌蚊不同组织Wolbachia wsp基因扩增Fig.1 The amplification of wsp gene of Wolbachia in different tissues of female Ae.albopictus1:Head;2:Ovary;3:Midgut;4:Malpighian tubules;5:Fat body;6:Thorax;M:DL 1 500 Marker

图2 白纹伊蚊雌蚊不同组织WO噬菌体orf7基因扩增Fig.2 The amplification of orf7 gene of phage WO in different tissues of female Ae.albopictus1:Head 2:Ovary 3:Midgut 4:Malpighian tubules 5:Fat body 6:Thorax M:DL 1 500 Marker
2.3 白纹伊蚊雌蚊不同组织器官Wolbachia和WO噬菌体的平均相对含量 将rpS7、wAlb A、wAlbB和WO噬菌体的重组质粒10倍梯度稀释后,制作标准曲线。用Q-PCR的方法,首先测定白纹伊蚊各个组织器官在不同时期(第1、5、10、15、20、30、40 d)时内参基因rpS7的拷贝数,并用其对不同时期的Wolbachia和WO噬菌体基因组DNA的拷贝数做标准化处理,得出Wolbachia和WO噬菌体在不同组织中的时空平均相对含量。由表2可知,在整个实验周期内,Wolbachia和WO噬菌体在蚊虫的卵巢中的含量是最大的,其次是脂肪体、马氏管和头部,而中肠和胸部含量最小。Wolbachia和WO噬菌体在蚊虫的卵巢中分布远大于其他组织器官,相比较存在着显著性差异(P<0.01),而其他组织之间的差异并不显著(P>0.05)。在卵巢中,Wolbachia和 WO噬菌体的含量如此高,反映了这两者参与宿主的生殖调控的可能性非常大。对于整个实验周期,在卵巢中WO噬菌体相对含量平均相对含量大于wAlb A、wAlbB,但其间无显著性差异(P<0.05),而在于其它的各个组织中,wAlbB平均含量最大,WO 噬菌体决之,wAlb A最小。wAlbB和 WO噬菌体,平均含量与wAlb A间存在显著性差异(P<0.01)。
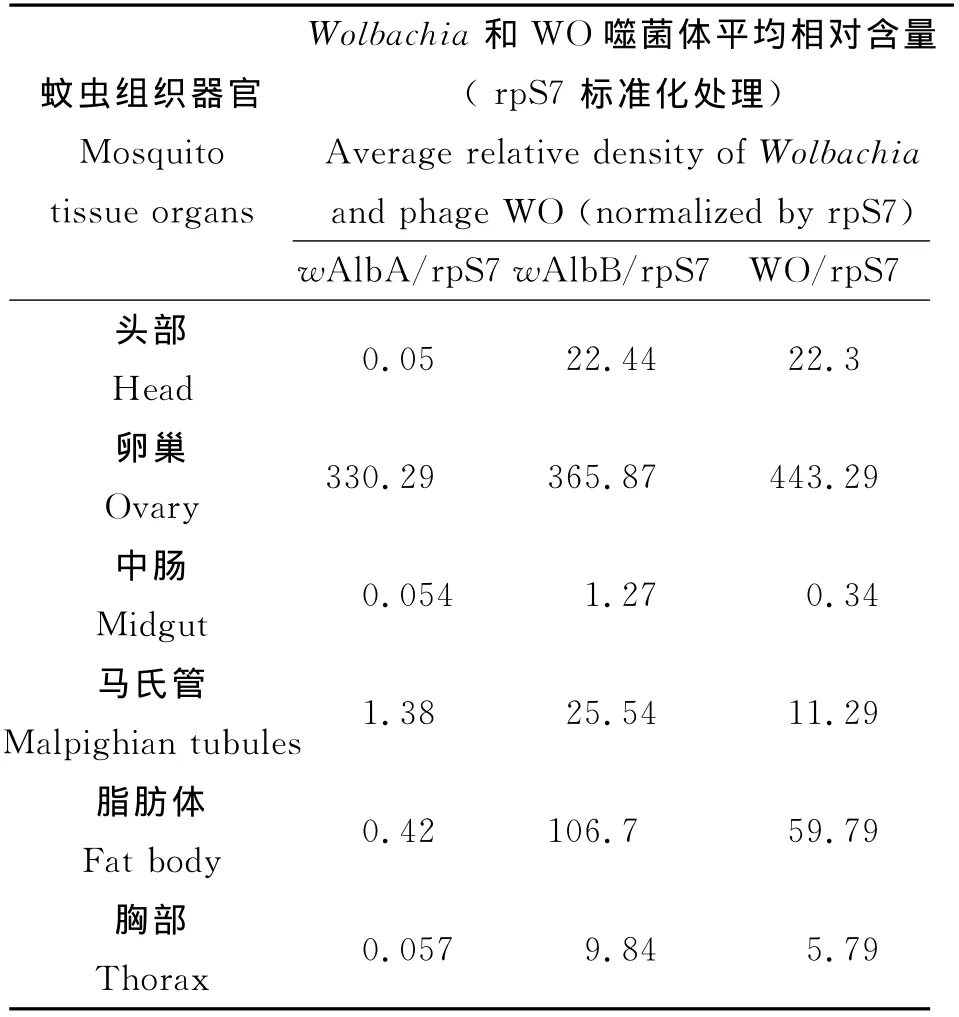
表2 Wolbachia和WO噬菌体在白纹伊蚊不同组织器官内的平均相对含量Tab.2 Average relative density of Wolbachia and phage WO in different Ae.albopictus organs
2.4Wolbachia和WO噬菌体在白纹伊蚊雌蚊不同组织器官内的定量动态变化 将雌蚊不同时期的各个组织器官wAlb A、wAlbB和 WO噬菌体进行Q-PCR扩增后,得出样品浓度,然后将样品浓度转换成拷贝数。以时间天数为X轴,以拷贝数为Y轴建立坐标系,观察Wolbachia和WO噬菌体在这些组织器官内的定量动态变化。
由图3可得,在白纹伊蚊雌蚊的头部、中肠、马氏管和胸部,随着蚊虫生长天数的增加,wAlb A含量在逐渐下降,并且在第30 d的头部、胸部和第40 d的中肠和马氏管已经检测不到wAlb A的拷贝数,说明了这四个部位在30~40 d之间已经没有wAlb A感染。脂肪体中,wAlb A含量则是先逐渐升高,并在第30 d达到最大值,而后又慢慢下降。在蚊虫的各个组织器官中,wAlb A在卵巢中的含量是最高的,远远大于其他非生殖器官。随着宿主生长天数的增加,wAlb A含量是逐渐上升,并在第20 d达到最大值。
wAlbB在头部、卵巢、中肠和马氏管的含量是随着宿主生长天数的增加而逐渐下降,而在脂肪体和胸部中则是先下降后升高。由图3可知,在卵巢中,wAlb A含量刚开始小于wAlbB,但是在第15 d之后,wAlb A含量便超过了wAlbB,但在整个实验周期内,wAlb A的平均相对含量仍小于wAlbB的平均相对含量(wAlb A=76.71,wAlbB=104.23)。从图3可看出,在各个组织器官中,噬菌体 WO的变化趋势与wAlbB基本上是趋于一致的,随着wAlbB含量的升高而升高,降低而降低。而跟wAlb A的变化趋势总体上则没有明显的相关性,说明可能WO噬菌体侵染的主要对象是wAlbB,而不是wAlb A。
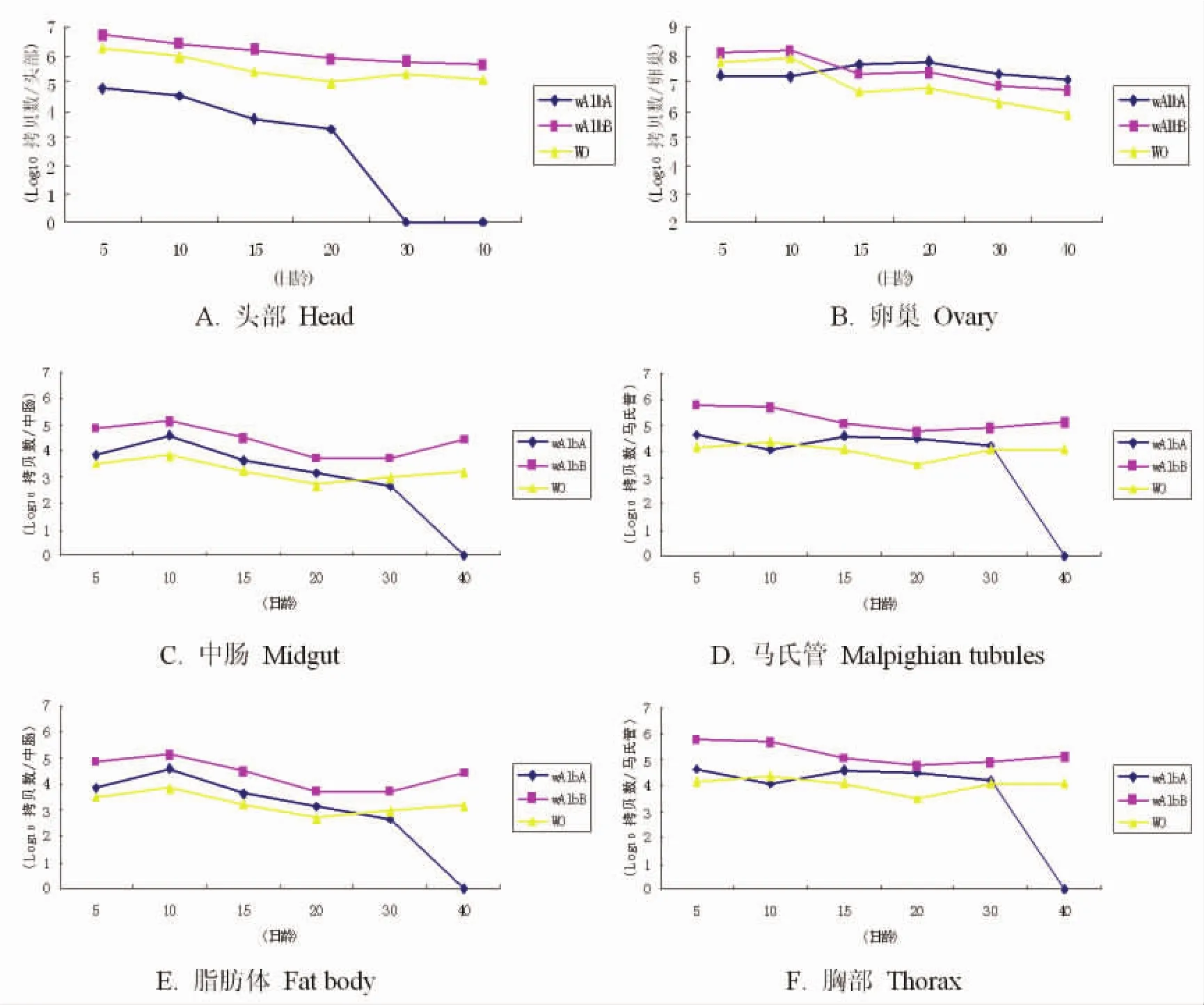
图3 Wolbachia和WO噬菌体在白纹伊蚊雌蚊不同组织器官内的定量动态变化Fig.3 Kinetics of Wolbachia and phage WO replication in female Ae.albopictus organs
2.5 白纹伊蚊雌蚊体内wAlbB与WO噬菌体的相关性 为了确定wAlbB与 WO噬菌体两者之间的相关性,我们将不同时期蚊虫卵巢、中肠和胸部体内wAlbB与WO噬菌体这两者的拷贝数进行量化关系的转化,以 WO噬菌体的拷贝数为X轴,以wAlbB拷贝数为Y轴,建立两者之间的量化关系。由图4可以看出在卵巢、中肠和胸部中,这两者之间呈正相关性(n=18,相关系数rA=0.9550,r2A=0.9162,P<0.01;rB=0.8505,r2B=0.728,P<0.05;rC=0.9692,r2C=0.343;P<0.01)。反之,用wAlb A和WO噬菌体两者拷贝数则建立不起量化关系(无显示该图)。因此我们推论 WO噬菌体在白纹伊蚊体内的含量可能主要取决于wAlbB的含量,其遗传物质在宿主体内随着wAlbB基因组的复制而复制,也反映了 WO噬菌体主要侵染的对象可能是wAlbB。
3 讨 论
对Wolbachia的研究长期以来一直都集中于宿主的生殖组织中,然而在非生殖组织中也发现了Wolbachia的存在。在笔者的前期研究中,也发现了广州株白纹伊蚊的各个组织器官中均存在着Wolbachia的双重感染,而对蚊虫各个组织器官中WO噬菌体的检测,发现也均是阳性,说明在蚊虫的各个部位均有 WO噬菌体的侵染。

图4 白纹伊蚊雌蚊体内w AlbB与WO噬菌体拷贝数的相关性Fig.4 The correlation between w AlbB and phage WO copies in female Ae.albopictus
通过Q-PCR方法对白纹伊蚊各个组织器官定量检测,发现在整个试验周期中,Wolbachia在白纹伊蚊雌蚊的卵巢中含量是最大的,这与Zouache[10]等的研究结果是一致的。而在各个组织器官,wAlb A含量均小于wAlbB。一般来说,Wolbachia在生殖器官中的含量是远远大于其他组织器官的,但是在第40 d的时候发现,蚊虫脂肪体的wAlbB含量(Log10Copies=6.99)已经超过蚊虫卵巢wAlbB的含量(Log10Copies=6.59),而脂肪体的wAlb A含量(Log10Copies=4.30)则远远小于卵巢脂肪体的wAlb A的含量(Log10copies=6。372)。对于年老的蚊虫,Wolbachia此时在非生殖腺中的含量如此之高,有可能是因为随着天数的增加,蚊虫的免疫器官(脂肪体为蚊虫重要的免疫器官)能力慢慢下降,从而导致共生菌大量侵入到脂肪体中,而脂肪体中wAlbB的含量明显大于wAlb A含量,说明可能是由于wAlbB的入侵效率大于wAlb A。
在蚊虫传播蚊媒病的过程中,蚊虫的卵巢、唾液腺和中肠是3个重要的器官,本实验室张美春博士通过白纹伊蚊胸腔注射登革病毒,发现唾液腺是病毒拷贝数最高的器官,在中肠,病毒也是呈不断增加的趋势,而在卵巢中病毒的拷贝数非常低[11]。此研究中,发现蚊虫的胸部(唾液腺所在部位)和中肠中的Wolbachia和WO噬菌体的含量是所有组织器官中最小的部位,而卵巢中这两者的相对含量是最高的。因此,Wolbachia和 WO噬菌体含量高的部位病毒的复制拷贝数低,而两者含量低的部位登革病毒的复制拷贝数则非常高,这说明了Wolbachia可能对病毒存在着抑制作用。L.Mousson等[12]发现感染有Wolbachia的白纹伊蚊感染基孔肯亚病毒(CHIV)时,对比没有感染Wolbachia的白纹伊蚊感染CHIV时,没有感染Wolbachia的蚊虫体内病毒拷贝数远大于有感染Wolbachia的蚊虫。自然感染Wolbachia的白纹伊蚊仍然是我国登革热主要媒介,这说明,白纹伊蚊现有自然感染的Wolbachia的两个菌系对登革病毒抑制方面未有明显影响[13]。因此如果要运用Wolbachia来抑制登革病毒在蚊虫媒介体内的复制,必须从其他昆虫物种中寻找到一个可以抑制病毒在蚊虫体内复制的Wolbachia菌系,将该菌系通过显微注射的方法转移到白纹伊蚊体内,建立有3个菌株系感染的白纹伊蚊种群。该菌系必须满足3个条件:一是可以随母代传播;二是可以引起细胞质不亲和(CI);三是必须在蚊虫的传播疾病的重要器官中含量达到抑制病原体的最低限度。因此对这两个部位的Wolbachia含量的测定与监测便显得非常重要。
通过Q-PCR的方法测定Wolbachia和WO噬菌体在宿主体内不同组织器官的时空定量动态变化来分析这三者之间的相关性,为进一步揭示这三者之间的相互作用的分子机制奠定基础。在整个实验周期中,发现 WO噬菌体随着wAlbB含量的改变而改变,二者的变化趋势基本一致,如图4所示,因此认为 WO噬菌体主要是取决于wAlbB含量而不是wAlb A。这结果与Chauvatcharin等[14]的研究结果刚好相反,在对泰国北碧(Kanchanaburi)野外捕捉到的白纹伊蚊的检测中,通过Q-PCR,他们认为WO噬菌体主要是取决wAlb A含量。这可能是因为不同地区的蚊虫存在着差别而引起的,也有可能是因为白纹伊蚊体内的 WO噬菌体也存在着两种类型,一种存在于wAlbB中,另一种存在于wAlb A中,而存在于wAlb A中的WO噬菌体密度较少还达不到最低的检测密度,需要进一步的实验研究来证明。
[1]Mercot H,Poinsot D.Infection byWolbachia:from passengers to residents[J].C R Biol,2009,332(2-3):284-297,DOI:10.1016/j.crvi.2008.09.010
[2]Masui S,Kamoda S,Sasaki T,et al.Distribution and evolution of bacteriophage WO inWolbachia,the endosymbiont causing sexual alterations in arthropods[J].J Mol Evol,2000,51:491-497,DOI:10.1007/s002390010112
[3]Fujii Y,Kubo T,Ishikawa H,et al.Isolation and characterization of the bacteriophage WO fromWolbachia,an arthropod endosymbiont[J].Biochem Biophys Res Commun,2004,317:1183-1188.DOI:10.1016/j.bbrc.2004.03.164
[4]Olivier D,Philippe F,Myle`ne W.Hypervariable prophage WO sequences describe an unexpected high number ofWolbachiavariants in the mosquitoCulexpipiens[J].Proc R Soc B,2006,273:495-502.DOI:10.1098/rspb.2005.3336
[5]Zhou W,Rousset F,O'Neill1 S.Phylogeny and PCR-based classifcation ofWolbachiastrains usingwspgene sequences[J].Proc R Soc Lond,1998,265:509-515.
[6]Sinkins SP.Wolbachiaand cytoplasmic incompatibility in mosquitoes[J].Insect Biochem Mol Biol,2004,34:723-729.DOI:10.1016/j.ibmb.2004.03.025
[7]Seth RB,Michelle LM,Adam JF,et al.The tripartite associations between bacteriophage,Wolbachia,and arthropods[J].PloS Pathog,2006,2(5):e43.DOI:10.1371/journal.ppat.0020043
[8]Tortosa P,Courtiol A,Moutailler S,et al.Chikungunya-Wolbachiainterplay inAedesalbopictus[J].Inse Mole Bio,2008,17(6):677-684.
[9]Wu Y,Zheng XY,Zhang MC,et al.Cloning and functional expression of Rh50-like glycoprotein,a putative ammonia channel,inAedesalbopictusmosquitoes[J].J Insect Physiol,2010,56:1599-1610.DOI:10.1016/j.jinsphys.2010.05.021
[10]Zouache K,Voronin D,Tran-Van V,et al.PersistentWolbachiaand cultivable bacteria infection in the reproductive and somatic tissues of the mosquito vectorAedesalbopictus[J].PLoS One,2009,4(7):e6388.DOI:10.1371/journal.pone.0006388
[11]Zhang MC,Zheng XY,Wu Y,et al.Quantitative analysis of replication and tropisms of Dengue virus type-2 inAedesalbopictus[J].AM J Trop Med Hyq,2010,83(3):700-707.DOI:10.4269/ajtmh.2010.10-0193.
[12]Mousson L,Martin E,Zouache K,et al.Wolbachiamodulates Chikungunya replication inAedesalbopictus[J].Mole Ecology,2010,19:1953-1964.DOI:10.1111/j.1365-294X.2010.04606.x
[13]Moreira LA,Iturbe-Ormaetxe I,Jeffery JA,et al.AWolbachiasymbiont inAedesaegyptilimits infection with Dengue,Chikungunya,and Plasmodium[J].Cell,2009,139:1268-1278.DOI:10.1016/j.cell.2009.11.042
[14]Chauvatcharin N,Ahantarig A,Baimai V,et al.Bacteriophage WO-B andWolbachiain natural mosquito hosts:infection incidence,transmission mode and relative density[J].Mol Ecol,2006,15:2451-2461.DOI:10.1111/j.1365-294X.2006.02947.x

