甲型H1N1流感病毒HA基因与沙门菌flj B基因的融合表达与鉴定*
杨 芸,潘志明,马全刚,张 磊,康喜龙,耿士忠,焦新安
目前,国内外对甲型H1N1流感的防治主要采用灭活裂解疫苗进行免疫预防,效果确实,在疾病的防治中发挥了巨大的作用[1]。但是灭活苗也存在一些缺陷,如不能有效激发细胞和黏膜免疫应答等[2]。因此,有必要研究一种安全、高效的新型甲型H1N1流感疫苗以弥补上述不足。
血凝素(hemagglutinin,HA)是流感病毒的一种主要保护性抗原,诱导中和抗体。HA裂解为HA1和HA2两个亚基,这两个亚基通过一个二硫键连接。HA1亚基参与细胞受体结合,HA2亚基则在病毒与细胞膜融合中起主要作用[3]。
研究显示,鞭毛蛋白被细胞TLR5(Toll-like receptor 5,TLR5)分子识别后,激发机体产生先天性免疫应答,继而启动并促进针对外源抗原的获得性免疫应答,包括体液免疫、细胞免疫以及局部黏膜免疫,显示出鞭毛蛋白免疫佐剂的特性[4-5]。鞭毛蛋白由D0、D1、D2、D3四个功能区域构成,其中D1区域是高度保守区域,含有TLR5结合位点,D2和D3则构成其高变区[6]。研究表明抗原序列插入鞭毛蛋白的末端或高突变区,都不会影响TLR5信号途径,但是这些插入位点对抗原序列具有选择性[7]。
本实验将 A/California/05/2009 H1N1 HA片段 HA1-2(K62-S284)通过柔性肽连接到鼠伤寒沙门菌Ⅱ型鞭毛蛋白的N端,利用大肠杆菌原核表达系统表达出融合蛋白,以期为新型甲型H1N1流感疫苗的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种、载体和细胞 鼠伤寒沙门菌SL7207、宿主菌E.coliDH5α、表达菌E.coliBL21(DE3)、表达载体p ET30a(+)均由江苏省人兽共患病学重点实验室保存,HEK293-m TLR5细胞由美国贝勒医学院李毅教授惠赠。
1.1.2 主要试剂 His·BindTMPurification Kit购自Novagen公司,ProteoSpin Endotoxin Removal kit micro for protein &peptides购自Norgren公司,Human IL-8 ELISA kit购自Excell公司,DNA片段快速纯化/回收试剂盒购自百泰克生物科技有限公司,质粒DNA抽提试剂盒购自TIANGEN生物科技有限公司,DMEM培养基、胎牛血清(FBS)购自Gibco○R公司,卡那霉素、T4 DNA连接酶、高保真Taq酶、EcoRⅠ、XhoⅠ、DL2000 DNA Marker、λ-Eco T14 digest DNA Marker、IPTG 等购 自宝生物工程(大连)有限公司,HRP-羊抗鼠IgG抗体购自Sigma公司,HA1-2蛋白、鞭毛蛋白、含有甲型H1N1流感病毒HA基因的重组质粒p ET-HA[8]、小鼠抗H1N1 HA蛋白和鼠伤寒沙门菌鞭毛蛋白多抗血清均由江苏省人兽共患病学重点实验室制备。
1.1.3 引物的合成和DNA的测序 基因扩增引物由北京六合华大基因科技股份有限公司合成,重组质粒DNA的测序由南京金斯瑞生物科技有限公司完成。
1.2 方法
1.2.1 目的基因 HA1-2-flj B的构建
1.2.1.1 引物的设计与合成 根据Gen Bank中鼠伤寒沙门菌SL7207基因组中flj B基因序列设计引物 fljB-F,fljB-R。 上 游 引 物 fljB-F:5′-GTGGAAGCGGCGGTGGCGGAAGCATGGCACAAG TAATCAACAC-3′, 下 游 引 物 fljB-R: 5′-CCGCTCGAGTTAACGTAACAGAGACAGC-3,(XhoⅠ酶切位点)。以含有甲型H1N1流感病毒HA基因的重组质粒p ET-HA为模板,设计合成一对引物,用于HA1-2基因的PCR扩增。上游引物HA1-2-F:5′-CCGGAATTCAGAGGGGTAGCCCCATTGCATTTGGG-3′(EcoRⅠ酶切位点),下游引物 HA1-2-R:5′-CACCGCCGCTTCCACCGCCACCAATGATAATACCAG-3′。
1.2.1.2 目的基因 HA1-2-flj B的克隆及鉴定以鼠伤寒沙门菌SL7207基因组为模板,fljB-F、fljB-R为引物扩增flj B基因。PCR扩增条件是:94℃预变性5 min;94℃变性50 s、50℃退火50 s、72℃延伸1.7 min,共30个循环;72℃终延伸10 min。以 重 组 质 粒 p ET-HA 为 模 板,HA1-2-F、HA1-2-R 为 引 物,PCR 扩 增 HA1-2 基 因 片 段。PCR扩增条件是:94℃预变性5 min;94℃变性50 s、50.5℃退火50 s、72℃延伸1 min,共35个循环;72℃终延伸10 min。再以上述两种PCR产物为模板,HA1-2-F、fljB-R为引物通过overlap PCR 拼接和扩增 HA1-2-flj B基因片段,预期片段大小为2 208 bp。PCR扩增条件是:94℃预变性5 min;94℃变性50 s、55℃退火50 s、72℃延伸2.2 min,共30个循环;72℃终延伸10 min。PCR产物用1%琼脂糖凝胶电泳回收。
1.2.2 原核表达质粒p ET-HA1-2-flj B的构建及鉴定 将PCR产物和原核表达载体p ET30a(+)用EcoRⅠ,XhoⅠ双酶切后回收,连接、转化E.coliDH5α感受态细胞,卡那霉素筛选阳性克隆,提取阳性克隆质粒双酶切和测序鉴定。将测序正确的重组质粒命名为p ET-HA1-2-flj B。
1.2.3 融合蛋白 HA1-2-fljB的表达及纯化 将重组质粒p ET-HA1-2-flj B转化宿主菌E.coliBL21(DE3),构建重组菌E.coliBL21(DE3)(pETHA1-2-flj B),重组菌接种于含50μg/m L卡那霉素的LB液体培养基中,37℃振荡培养至OD600为0.6~0.8,加入IPTG至终浓度为0.5 mmol/L,继续在37℃条件下振荡培养,诱导表达5 h。诱导产物裂解后离心,分别将诱导产物裂解上清及沉淀进行SDS-PAGE分析,判断融合蛋白的可溶性。按上述方法对阳性克隆进行大量诱导表达,离心收集菌体,无菌PBS重悬菌体,超声波裂解,离心收集上清,His·Bind○RPurification Kit纯化后,于-70℃保存备用。
1.2.4 Western blotting分析 将诱导表达的融合
蛋白 HA1-2-fljB经SDS-PAGE电泳后,转印到硝酸纤维素膜(NC)膜上,用含1%小牛血清的PBST室温作用过夜,次日用PBST洗涤4次后,将NC膜分为2组,分别以小鼠抗H1N1 HA和鼠伤寒沙门菌鞭毛蛋白多抗血清(均以1∶4 00稀释)室温孵育4 h,充分洗涤后以 HRP-羊抗鼠IgG(1∶5 000稀释)室温孵育2 h,PBST洗涤4次后,二氨基联苯胺(DAB)显色,蒸馏水终止反应。
1.2.5 TLR5生物学试验 目的蛋白刺激HEK293-m TLR5细胞,检测IL-8的分泌水平,评价目的蛋白的TLR5活性。每孔100μL含5×104个细胞置于96孔板中培养过夜。次日,将鞭毛蛋白、HA1-2 蛋 白、融 合 蛋 白 HA1-2-fljB 用 ProteoSpin Endotoxin Removal Micro Kit for proteins&peptides去除内毒素后,分别以5 pg/μL浓度刺激细胞5 h。收集上清,用Human IL-8 ELISA kit检测IL-8分泌水平。
2 结 果
2.1flj B、HA1-2和 HA1-2-flj B基因的扩增flj B、HA1-2和 HA1-2-flj B基因 PCR 扩增 产 物经1%琼脂糖凝胶电泳分析,分别在1521、669和2208 bp处出现特异性条带,与预期的基因片段大小相符(图1、2)。说明成功扩增出 HA1-2-flj B目的基因片段。

图1 flj B和HA1-2基因PCR产物电泳分析Fig.1 Electrophoresis analysis of PCR amplified fljB and HA1-2 geneM:DL 2000 DNA marker;1:PCR products of fljB gene;2:PCR products of HA1-2 gene
2.2 原核表达质粒p ET-HA1-2-flj B的构建与鉴定 用EcoRⅠ和XhoⅠ双酶切 HA1-2-flj B基因片段和p ET30a(+)表达质粒,电泳回收相应的目的基因片段和p ET30a(+)片段,T4 DNA连接酶连接,构建重组质粒p ET-HA1-2-flj B,并将提取的重组质粒转化,再将提取的质粒经EcoRⅠ、XhoⅠ双酶切,获得2208 bp大小的目的基因片段和5400 bp大小的载体片段(图3),表明重组质粒p ETHA1-2-flj B构建成功。
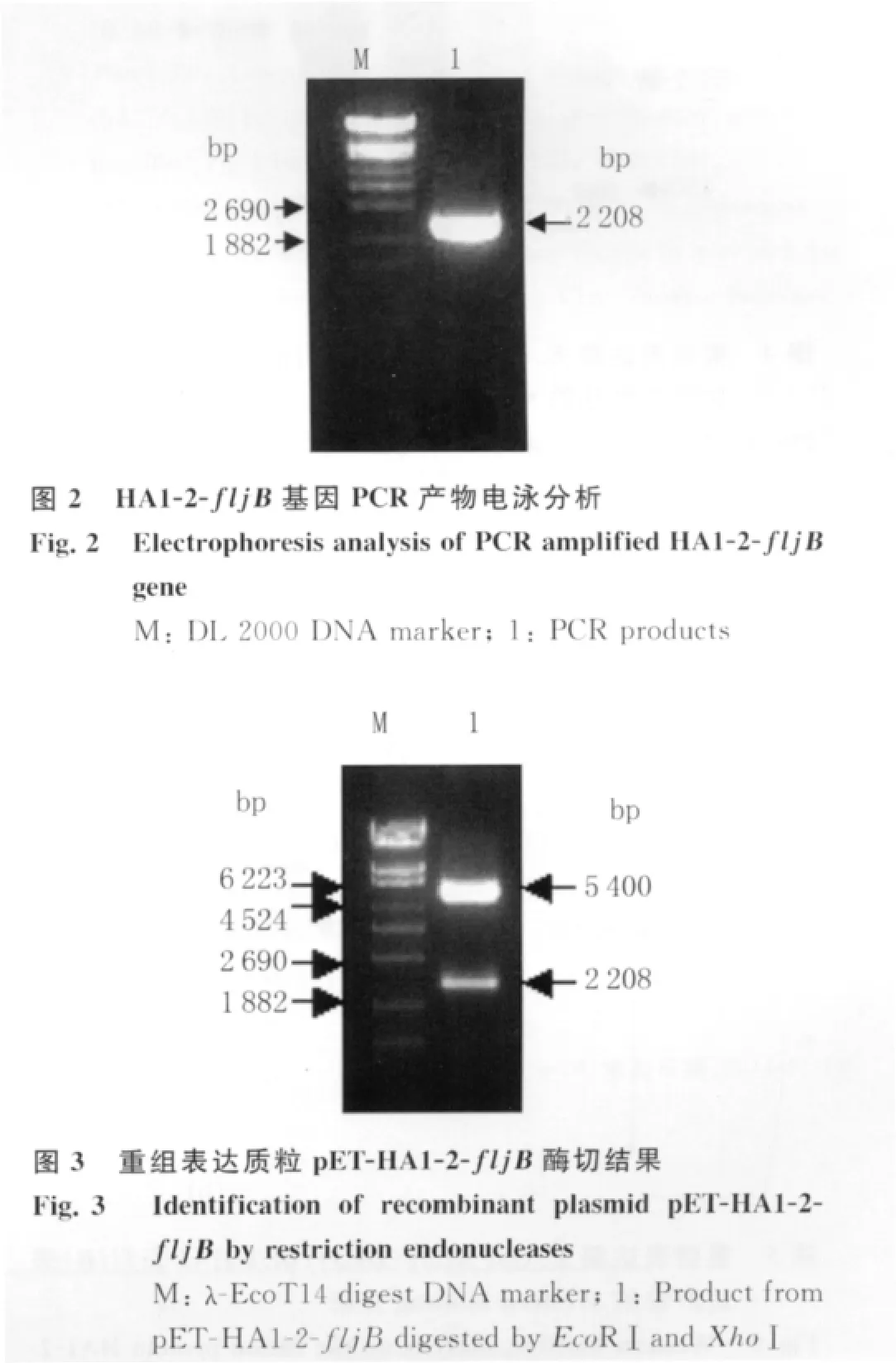
2.3 融合蛋白 HA1-2-fljB 的表达及纯化 SDSPAGE分析重组菌E.coliBL21(DE3)(p ET-HA1-2-flj B)的表达产物显示,在84 k D左右处出现一明显的新生蛋白条带,其大小与预期蛋白大小一致(图4),表明成功表达出融合蛋白 HA1-2-fljB,并主要存在上清(图略),且纯化后的表达产物只有一特异性条带(图4)。
2.4 Western blotting分析结果 融合蛋白经SDS-PAGE分析后转移至NC膜,用小鼠抗鞭毛蛋白多抗血清和抗H1N1 HA多抗血清作为一抗分别对融合蛋白进行Western blotting分析,NC膜上均出现了目的条带,大小均与SDS-PAGE表达的蛋白大小一致(图5)。表明融合蛋白HA1-2-fljB具有良好的免疫反应性。
2.5 融合蛋白HA1-2-fljB的TLR5生物活性 体外ELISA试验检测IL-8分泌水平,评价鞭毛蛋白激活TLR5的能力。与阳性对照鞭毛蛋白(fljB)相比,融合蛋白HA1-2-fljB能诱导细胞分泌高水平的IL-8(1 220 pg/m L),而 HA1-2蛋白刺激组分泌极低水平的IL-8(40 pg/m L)(图6)。
3 讨 论
近年对基于鞭毛蛋白的融合蛋白与鞭毛蛋白和抗原的联合免疫效果比较研究发现,前者更能有效促进抗原特异性的免疫应答,因为CD11c+抗原提呈细胞TLR5高亲和力结合鞭毛蛋白而摄取抗原;TLR5信 号 能 促 进 树 突 状 细 胞 激 活[9-10]。Steven等[7]比较总结多种基于鞭毛蛋白的融合蛋白的免疫效果后,认为鞭毛蛋白N末端是一个较好的设计位点。 据 此,本 文 选 择 将 A/California/05/2009 H1N1的HA片段HA1-2连接到鼠伤寒沙门菌Ⅱ型鞭毛蛋白fljB的N端。首先在设计下游引物HA1-2-R时引入柔性肽(Gly4Ser)3上游序列,上游引物fljB-F时引入柔性肽(Gly4Ser)3下游序列,然后通过overlap PCR技术将HA1-2和flj B基因连成融合基因 HA1-2-flj B,最终以原核系统表达HA1-2-fljB融合蛋白。
图6 不同蛋白的TLR5活性Fig.6 TLR5 activity of different proteins
本实验中,SDS-PAGE结果显示在84 k D左右处出现一较浓的条带,表明融合蛋白获得高效表达。Western blotting结果显示融合蛋白能识别A/California/05/2009 H1N1 HA蛋白多抗血清中的特异抗体,表明该融合蛋白中HA1-2片段具有良好的免疫反应性。理论上HA基因的表达需要宿主细胞的翻译后修饰,因此通常选择用真核细胞系制备HA蛋白[11],但研究发现HA蛋白的糖苷化不影响抗体应答,细菌表达系统也能表达保护性HA亚基[11-12]。本实验结果与此结论一致。另外 Western Blotting结果也显示出融合蛋白能与抗鼠伤寒沙门菌鞭毛蛋白多抗血清中的特异抗体发生反应,表明其鞭毛蛋白部分也具有较好的免疫反应性。
TLR5识别其配体鞭毛蛋白,启动衔接分子My D88募集IL-1受体相关激酶(IRAK),IRAK磷酸化被活化,结合TRAF6,激活NF-κB信号途径,最终调节IL-8[13-14]基因的转录翻译,所以检测IL-8的表达可以作为TLR5被鞭毛蛋白激活的标志,从而评价融合蛋白HA1-2-fljB中鞭毛蛋白基因是否获得正确表达。TLR5生物试验结果显示,鞭毛蛋白与融合蛋白均能强烈诱导HEK293-m TLR5分泌IL-8,而单独的 HA1-2蛋白诱导IL-8的分泌水平几乎与空白对照相同,表明融合蛋白具有激活TLR5的生物学功能。
本实验成功表达出融合蛋白,为进一步研究其免疫原性及H1N1甲型流感疫苗奠定了基础。此外利用大肠杆菌表达系统表达蛋白的方法不仅快速方便、成本低廉,而且能获得高水平蛋白,为甲型流感疫苗的大量有效制备技术提供了一条新途径。
[1]王晓中,张宝峰,唐修湖,等.甲型H1N1流感疫苗研究进展[J].口岸卫生控制,2010,15(4):47-50.
[2]Lambert LC,Fauci AS.Influenza vaccine for the future[J].N Engl J Med,2010,363(21):2036-2044.
[3]Xu W,Han L,Lin Z.Screening of random peptide library of hemagglutinin from pandemic 2009 A(H1N1)influenza virus reveals unexpected antigenically important regions[J].PLoS One,2011,6(3):e18016.
[4]Skountzou J,Del Pilar Martin M,Wang BZ,et al.Salmonellaflagellins are potent adjuvants for intranasally administered whole inactivated influenza vaccine [J].Vaccine,2010,28(24):4103-4112.
[5]Delaney KN,Phipps JP,Johnson JB,et al.A recombinant flagellin-Poxvirus fusion protein vaccine elicits complement-dependent protection against respiratory challenge with Vaccinia virus in mice[J].Vaccine,2010,23(2):201-210.
[6]Smith KD,Andersen-Nissen E,Hayashi F,et al.Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility [J].Nat Immunol,2003,12(4):1247-1253.
[7]Mizel SB,Bates JT.Flagellin as an adjuvant:cellular mechanisms and potential [J].J Immunol,2010,185 (10):5677-5682.
[8]马全刚,潘志明,游猛,等.甲型H1N1流感病毒HA基因的原核表达及免疫反应性分析[J].中国人兽共患病学报,2010,26(10):923-925.
[9]Bates JT,Uematsu S,Akira S,et al.Direct stimulation of tlr5+/+CD11c+cells is necessary for the adjuvant activity of flagellin[J].J Immunol,2009,182(12):7539-7547.
[10]Mizel SB,Graff AH,Sriranganathan N,et al.A fusion protein,flagellin/F1/V,is an effective plague vaccine in mice and two species of nonhuman primates [J].Clin Vaccine Immunol,2009,16(1):21-28.
[11]Song LZ,Zhang Y,Yun NE,et al.Superior efficacy of a recombinant flagellin:H5N1 HA globular head vaccine is determined by the placement of the globular head within flagellin[J].Vaccine,2009,27(42):5875-5844.
[12]Song LZ,Nakaar V,Kavita U,et al.Efficacious recombinant influenza vaccines produced by high yield bacterial expression:a solution to global pandemic and seasonal needs[J].PLoS One,2008,3(5):e2257.
[13]Takeda K,Akira S.TLR signaling pathways[J].Semin Immunol,2004,16(1):3-9.
[14]Yu YM,Zeng H,Lyons S,et al.TLR5-mediated activation of p38 MAPK regulates epithelial IL-8 expression via posttranscriptional mechanism [J].Am J Physiol Gastrointest Liver Physiol,2003,285(2):282-290.

