不同剂量固尔苏治疗40例新生儿呼吸窘迫综合征的临床研究
汪 丽,李仁君,马 娟,史 源,刘 蕾△
(1.第三军医大学大坪医院野战外科研究所儿科,重庆 400042;2.重庆市綦江县人民医院儿科 401420)
新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS),是新生儿出生后早期出现的以进行性呼吸困难为主要表现的呼吸系统疾病,是呼吸衰竭的主要病因,也是早产儿死亡的主要原因。其发病基础是肺表面活性物质(pulmanary surfactant,PS)缺乏。临床应用外源性PS可预防和治疗NRDS,这已被国内外大量研究所证实。但对于固尔苏临床应用的最佳剂量,目前仍无明确定论。大坪医院儿科应用不同首次剂量固尔苏治疗并发有呼吸窘迫综合征(RDS)的早产儿,对其临床疗效和安全性进行随机对照研究,现报道如下。
1 资料与方法
1.1 一般资料 2010年6月至2010年10月在大坪医院儿科NICU住院的早产儿(胎龄小于36周),共40例,均于生后12 h内入院。根据病史、临床表现、胸片结果,参照《实用新生儿学》,符合以下条件:出生后1~6h内出现进行性呼吸困难、鼻搧、吸气性凹陷、呻吟及发绀,听诊双肺呼吸音减低,胸片证实为NRDS。在家属签署知情同意书后,将患儿随机分为治疗组和对照组,治疗组20例,其中男16例,女14例,胎龄27~36周,平均(32.31±2.14)周;出生体质量890~3100g,平均(1528±321)g;根据胸片结果进行 NRDS分期,Ⅳ期2例,Ⅲ期5例,Ⅱ期13例。对照组20例,其中男17例,女13例;胎龄28~36周,平均(32.28±2.84)周,出生体质量1050~3080 g,平均(1624±364)g;根据胸片结果进行NRDS分期Ⅳ期3例,Ⅲ期4例,Ⅱ期13例。两组在性别、胎龄、出生体质量、胸片NRDS分期等方面比较差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 排除标准 出生前羊水检查已证实胎肺成熟;入选前已使用过外源性表面活性物质治疗;首剂肺表面活性物质使用前已使用高频通气;出生后5min内心率不能稳定在100次/min之上;出生后5min Apgar评分小于或等于3分;妊娠期间即明确诊断有主要脏器的先天畸形、或者出生时发现有主要脏器的畸形;有其他可能影响心肺功能的严重疾病(严重感染、败血症及颅内出血等);确诊或怀疑有染色体异常;出生后在产房内进行过心肺复苏或使用过升血压药物(肾上腺素、去甲肾上腺素、多巴胺等)、碳酸氢钠、静脉输液者;其他不适合入组的患者。
1.2.2 治疗方法 (1)给药方法:在确诊NRDS后,治疗组即给予固尔苏(意大利凯西制药公司生产,每1毫升固尔苏中含磷脂80mg)200mg/kg治疗;对照组即给予固尔苏100mg/kg治疗。如果病情无明显改善,两组患儿均可以在首剂之后的12h或更长时间再次给予固尔苏100mg/kg,必要时每12小时重复给药,但总量不得超过400mg/kg。患儿取仰卧位,用药前须吸净气道内分泌物,保证通气良好;先将固尔苏置于暖箱中复温至37℃,用5mL注射器吸取药液,注射器连接头皮针备用。气管插管操作尽量做到无菌操作、快速准确、动作轻柔、位置正确。将头皮针斜插入气管插管导管中,医师缓推退注给药,护士在旁持续用复苏囊加压通气。用药过程中严密监测患儿SaO2、心率、呼吸、血压变化。若患儿出现呼吸暂停、SaO2及心率下降,暂停注药,迅速加压给氧,使药液快速进入肺内,直至恢复稳定状态。(2)其他治疗:两组患儿根据病情需要行机械通气治疗,并同时给予同等对症支持治疗,包括暖箱保暖,上机期间多巴胺改善循环、镇静处理,广谱青霉素类或头孢菌素抗感染,丙种球蛋白支持及静脉营养等。
1.3 统计学处理 应用SPSS13.0统计软件对结果进行统计分析,结果以或率表示,组间均数的比较采用t检验,组间率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患儿需要接受第2剂固尔苏的比例 见表1。

表1 两组患儿需要接受第2剂固尔苏的比例
2.2 两组患儿需要接受第3剂固尔苏的比例 见表2。

表2 两组患儿需要接受第3剂固尔苏的比例
2.3 两组患儿生后28d内严重并发症比较 两组患儿出生后28d内严重并发症比较差异无统计学意义(P>0.05),见表3。

表3 两组患儿生后28d内严重并发症比较(n)
2.4 两组患儿用药12h血气分析结果比较 用药后12h比较两组患儿血气分析结果见表4。
表4 两组患儿用药12h血气分析结果()
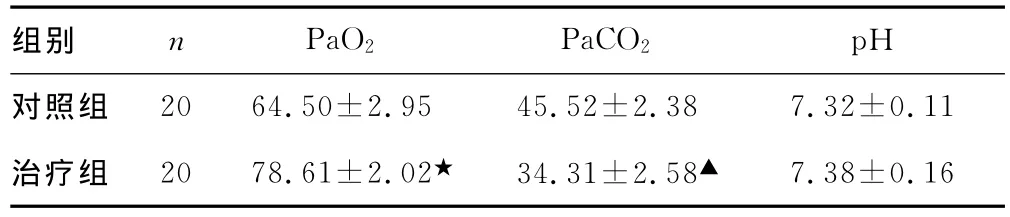
表4 两组患儿用药12h血气分析结果()
▲:P<0.01,★:P<0.05,与对照组比较。
组别 n PaO2 PaCO2 pH对照组2064.50±2.95 45.52±2.38 7.32±0.11治疗组 2078.61±2.02★ 34.31±2.58▲7.38±0.16
2.5 两组患儿用药12h后胸部X线变化 40例患儿入院后均立即行胸部X线检查,其中肺内细小颗粒影或斑片影32例,支气管充气征35例,肺野透亮度减低34例,白肺5例,所有病例至少有2种以上征象。根据胸片结果进行NRDS分期:Ⅳ期5例,Ⅲ期9例,Ⅱ期26例。给予PS治疗12h后X线治疗组患儿胸片显示肺部病变显著改善13例;对照组治疗12h后胸片结果显著改善8例。
2.6 两组患儿的平均机械通气和吸氧时间比较 治疗组平均机械通气及吸氧时间低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患儿的平均机械通气和吸氧时间比较()

表5 两组患儿的平均机械通气和吸氧时间比较()
▲:P<0.05,与对照组比较。
分组 n 平均机械通气时间(h) 平均吸氧时间(h)对照组20 182.34±112.23 256.43±112.27治疗组 20 116.03±62.48▲ 176.38±65.29▲
3 讨 论
NRDS是早产儿的一种严重疾病,是由于缺乏PS引起的。胎龄32周以下,或胎龄大于32周但有高危因素,如新生儿宫内窘迫、出生时发生窒息、母亲是糖尿病患者的早产儿发生NRDS的概率非常高[1]。PS是由Ⅱ型肺泡细胞产生并分布在肺泡表面的磷脂蛋白复合物,具有降低肺泡表面张力、防治肺不张和肺水肿、保持肺泡细胞稳定等重要功能[2-3]。胎儿在胎龄22~24周时Ⅱ型肺泡细胞已能产生PS,但量不多,且较少转移至肺泡表面[4],随着胎龄的增长,PS的合成逐渐增加,因此早产儿胎龄越小,肺中的PS量越少,NRDS的发生率也越高,所以在PS缺乏阶段补充外源性表面活性物质可以起到根本的治疗作用[5]。
尽管对于NRDS患儿的治疗方法已取得了很大的进步,但NRDS仍然是导致早产儿死亡的重要原因[6-7]。时至今日,国内外的新生儿学家对于如何更好地预防和治疗NRDS的研究从未停止[8-10]。
PS对于治疗NRDS患儿的临床疗效已被广泛证实,但PS价格高昂,很多患儿家庭无力承担反复用药。本研究表明,治疗组患儿需要接受第2剂及第3剂固尔苏的比例明显小于对照组,说明首剂应用200mg/kg疗效迅速,相对于100mg/kg而言,可以明显降低再次应用固尔苏的比例。比较平均机械通气和吸氧时间发现,治疗组患儿平均机械通气和吸氧时间都明显短于对照组,这是因为首剂给予足量PS,可以使PS充分扩散至肺泡表面,进一步扩张肺泡,保护肺泡上皮细胞,维持其稳定性,从而缩短其病理过程。比较两组患儿出生后28d内严重并发症差异无统计学意义,究其原因,可能与使用PS治疗后,部分患儿的通气、换气功能改善,血管阻力下降,血管扩张,肺、脑、肾、心等器官血流增加,在刺激、缺氧、内环境改变等外因诱导下导致出血或功能衰竭[11-12]。但此部分患儿大多集中于胎龄小、体质量低的早产儿,尤其是超未成熟儿,因此作者认为胎龄和体质量是决定并发症发生的首要原因而并非首剂PS的用量。对于胎龄小、体质量轻的早产儿及早地预防和治疗肺出血、颅内出血及心衰、肾衰、新生儿坏死性小肠结肠炎等并发症显得尤为重要。至于首剂应用200mg/kg固尔苏能否较100mg/kg有效减低此类并发症的发生率,作者将在今后的研究中加大样本量进一步观察。
综上所述,首剂使用200mg/kg固尔苏治疗并发有NRDS的早产儿疗效确切,相对于首剂使用100mg/kg固尔苏的患儿,能明显减少再次用药的比例,缩短住院治疗时间,在减少NRDS患儿病死率的同时为患儿家属节省治疗费用,因此值得临床进一步广泛推广应用。
[1]张志华.新生儿呼吸窘迫综合征的临床特点与高危因素[J].临床医学,2011,2:453-454.
[2]吴勇.肺表面活性物质与新生儿呼吸窘迫征[J].泸州医学院学报,2011,34(1):106-108.
[3]杨永胜,关键.肺表面活性物质相关蛋白与呼吸系统疾病[J].临床肺科杂志,2011,16(3):413-415.
[4]金汉珍,黄德珉,官希吉,等.实用新生儿学[M].3版.北京:人民卫生出版社,2003:395-400.
[5]刘博,韩万凤,黄晓戈.肺表面活性物质预防新生儿呼吸窘迫综合征临床分析[J].中国优生与遗传杂志,2010,18(12):99-104.
[6]Subramaniam P,Henderson-Smart DJ,Davis PG.Prophylactic nasal continuous positive airways pressure for preventing morbidity and mortality in very preterm infants[J].Cochrane Database Syst Rev,2005,(3):CD001243.
[7]陈洁,王敏,周光耀.肺表面活性物质早期治疗新生儿呼吸窘迫综合征[J].药学与临床,2010,13(6):866-868.
[8]Bradbury J.Could treatment of neonatal RDS improve further[J].Lancet,2002,360(9330):394-399.
[9]Almlen A,Stichtenoth G,Linderholm B,et al.Surfactant proteins B and C are both necessary for alveolar stability at end expiration in premature rabbits with respiratory distress syndrome[J].Appl Physiol,2008,104(4):1101-1108.
[10]Hilgendorff A,Aslan E,Schaible T,et al.Surfactant replacement and open lung concept-Comparison of two treatment strategies in an experimental model of neomatal ARDS[J].BMC Pulm Med,2008,14(8):10-21.
[11]陈超.肺表面活性物质在新生儿肺部疾病中的应用进展[J].中国实用儿科杂志,2003,18(11):652-653.
[12]杨树杰,易海英,徐舒,等.肺表面活性物质救治早产儿肺透明膜病108例并发症分析[J].中国现代医生,2009,47(36):157-158.

