闭环植入式神经刺激器的现状与发展趋势
袁 媛 郝红伟 李路明
(清华大学航天航空学院,北京 100084)
引言
神经功能失调是一大类神经系统疾病,具有较高的发病率,包括重症的帕金森病等运动障碍疾病、癫痫、顽固性疼痛等,其结果是病人明显残障。传统的神经功能失调疾病的治疗有药物方法和外科毁损手术方法。随着疾病的进展,药物治疗的效果往往越来越差,而且有副作用,如治疗帕金森的左旋多巴类药物易产生恶心、厌食、呕吐、血压轻度降低、精神异常等不适感[1],治疗癫痫的药物具有影响认知、睡眠-醒觉周期,视觉、情感、记忆、平衡或功能协调方面的不良反应,且对30%的病人控制无效[2-3];外科毁损手术法通过切除或射频毁损病灶达到治疗效果,但是手术存在极大风险,脑组织一旦毁损可能有不可预知的恶性后果,如偏瘫和其他并发症等。植入式神经电刺激方法通过刺激人体不同部位(如运动神经、感觉神经)调理,使人体机能恢复正常运作,是一种不破坏神经组织、可逆性神经调节的外科治疗方法,已被证实对20余种神经功能失调疾病具有确切疗效。例如,脑深部电刺激器(deep brain stimulation,DBS)治疗帕金森病、震颤、肌张力障碍和强迫症,迷走神经电刺激(vagus nerve stimulation,VNS)治疗难治性癫痫和抑郁,脊髓电刺激(spinal cord stimulation,SCS)治疗顽固性疼痛,骶神经电刺激(sacral nerve stimulation,SNS)治疗急迫性尿失禁,膈肌起搏器治疗呼吸障碍等[4]。
目前,绝大多数植入式神经刺激器采用开环控制,即电刺激参数(频率、脉宽、幅度等)由外科医生根据临床经验以及神经刺激器的出厂设计确定,患者刺激参数调节的平均周期为3~12个月[5],存在参数调节不及时、医生主观依赖性强以及刺激器电源管理不科学等问题。虽然临床证明植入式神经刺激器对诸多病症的治疗效果显著,但为了实现对不同患者的针对性治疗,提高刺激效率,延长刺激器使用寿命,Medtronic、Neuropace、Boston Scientific、St.Jude等医疗器械公司以及国内外的研究机构逐渐开展闭环植入式神经刺激器的研究和临床应用。
1 闭环植入式神经刺激器的研究
闭环植入式神经刺激器一般包括植入式脉冲发生器和电极(含记录电极和刺激电极),以及连接两者的延长导线。以脑深部刺激器为例(如图1所示),开环DBS通过植入的刺激电极以高频脉冲持续对目标核团进行刺激,刺激参数由外科医生手持外部编程器进行调整。闭环DBS的记录电极测量神经元电活动信号,信号被传输至脉冲信号发生器进行数据处理和算法实施,进而选择合适的刺激参数,通过刺激电极对目标靶点进行刺激;或者在刺激电极刺激后,记录电极采集人体的生理信息,判断参数设置的合理性,进而调整刺激参数,提高刺激效率。在两种模式下,系统均能根据患者的实际病症,自适应地调整刺激参数,实现最佳的治疗效果。

图1 开环和闭环深部脑刺激器[6]。(a)开环DBS;(b)闭环DBSFig.1 Illustration of an open-loop and an closed-loop deep brain stimulation [6].(a)Open loop DBS;(b)Closed loop DBS
目前,神经刺激的作用机制还未研究清楚,因此无论是参考信号的选取,或是由刺激引起的生理信号和生物化学信号的变化作为闭环神经刺激系统的反馈,均在探索阶段。虽然开环神经刺激器取得一定的临床治疗效果,但是心脏起搏器实现的闭环控制对于患者疗效的提高以及刺激器寿命的延长,使得近年来研究人员在闭环神经刺激器领域不断开拓,并且在以神经刺激作用机制为基础的参考信号和反馈信号的选取上取得了一定的进展。下面以脑刺激、迷走神经刺激和脊髓神经刺激等3种刺激器为例,分析和讨论闭环植入式神经刺激器的研究现状和发展趋势。
2 闭环脑刺激器
1997年美国食品和药物管理局(FDA)批准Medtonic公司的Activa脑深部电刺激系统治疗原发性震颤,2002年批准治疗帕金森病,2003批准治疗肌张力障碍,2009年批准治疗强迫症。至今,全球已有超过8万名患者接受了这种疗法,其疗效得到了临床验证和美国神经病学学会(AAN)的肯定,也得到了各国研究人员和医疗器械公司的重视[7-8]。尽管如此,目前临床使用的开环脑深部刺激器也反映出诸多问题,如刺激参数调整不及时,设置的参数与治疗结果之间缺乏有效的数据联系,刺激效率与刺激的副作用评估不足,等等。为解决上述脑深部刺激作用机制的相关问题,闭环脑深部刺激器的研究逐渐得到重视。
刺激参考信号的选取主要有电信号和化学信号:前者主要研究的对象是神经动作电位,后者则是测量相关神经递质的改变。在电信号作为参考信号的研究上,Santaniello等仿真并分析了下丘脑腹中间核局部场电位(LFP)在闭环脑深部刺激器应用中的可行性[9]。Rossi小组开发 FilterDBS系统,有效地消除了电刺激对丘脑底核(STN)局部场电位(LFP)记录伪迹的影响;系统在接受DBS刺激的帕金森患者体内和体外的实验表明,LFP可作为闭环脑机接口的反馈信号[10]。Kent和Grill团队设计了新型闭环DBS系统,将测量的电诱发复合动作电位(CAP)作为反馈信号,自动调整刺激参数并优化刺激效率;同时,还进行了植入猫丘脑的活体实验,验证了电诱发复合动作电位作为闭环脑深部刺激器反馈控制信号的可行性[11]。Boris Rosin等通过6个记录电极(其中,2根置于初级运动皮层,4根置于苍白球),实现 1-甲基 4-苯基-1,2,3,6-四氢吡啶(MPTP)造模的灵长类动物的闭环深部脑刺激(如图2所示);对比标准的130 Hz高频开环电刺激,以及相对参考信号不同延时的刺激信号,Boris Rosia认为闭环刺激能更好地改善帕金森症状[5]。

图2 闭环 DBS实验范例[5]Fig.2 The experimental paradigm of close-loop DBS[5]
作为另一种反馈信号,以神经递质为代表的化学信号检测在闭环DBS中的研究也取得了一定的进展。如果能发现和检测神经递质释放量与刺激之间的关系,则能实现DBS刺激参数评估的合理机制。Kendall H.Lee等制作了2.2 mm×2.2 mm的CMOS芯片,实现了麻醉大鼠内侧前脑束接受刺激后检测到多巴胺的检测,以及无线数据的传输[12],为实时检测刺激引起的神经递质变化创造了可能,如图3所示。

图3 基于多巴胺检测的闭环 DBS[12]Fig.3 Illustration of close-loop DBS based on the detection of dopamine[12]
虽然基础研究取得了进展,Alexander R.Kent以及Boris Rosin等设计的闭环系统在动物实验上也取得了成功,但是动物造模与实际患者病症的差异使其距离临床应用仍存在诸多问题。目前,应用于临床的闭环脑刺激器有美国Neuropace公司设计的RNS系统,如图4所示。该系统利用皮层电极,深部电极,和连接两者位于头皮下颅骨内的微型脉冲发生器,实现闭环DBS;将皮层电极记录的脑电信号作为参考,通过深部电极刺激来实现癫痫的闭环治疗[13]。Kostas N.Fountas等人报告,通过对 8个植入RNS系统的癫痫患者6~24个月的随访发现,7个患者的发作率减少了45%,其中2个更是减少了75%[14],说明了这一疗法对癫痫发作抑制的作用。然而,RNS系统没有通用的算法实现对癫痫发作的早期检测,且刺激器的使用寿命短,仪器费用昂贵,在一定程度上限制了它的临床应用[15]。

图4 RNS系统[13]。(a)RNS神经刺激器系统;(b)RNS神经刺激器Fig.4 Scheme of RNS system[13].(a)RNS system;(b)RNS stimulator
3 闭环迷走神经刺激器
1988年美国Texas Cyberonics公司成功研制迷走神经刺激装置(neurocybernet-ic prosthesis,NCP),同年开始用于临床试验,1997年7月16日FDA正式批准VNS作为一种辅助治疗手段用于药物难治性癫痫,2005年VNS被批准治疗抑郁,截止到2012年全球超过67000例癫痫和抑郁患者接受 VNS疗法[16]。同时研究表明,VNS对心衰等心脏疾病也有治疗作用[17-18]。过去的30年,癫痫发作的预测主要依据脑电信号(EEG)和心脏活动,但预测的结果距离临床应用仍有差距[19],目前迷走神经刺激的作用机制仍不明确,癫痫发作的预测以及刺激参数的评估一直是研究的热点。
在癫痫发作的预测研究方面,Nielsen等采集PTZ造癫痫模大鼠的脑电和心电信号作为癫痫发作的预判标准,实验结果表明该模型适用于VNS系统的治疗需求[20]。Harreby等利用 PTZ造癫痫模大鼠,探讨了颈部迷走神经电信号(VENG)作为早期癫痫发作预测的可能性,实验证明左侧的VENG能够有效预测麻醉老鼠的癫痫发作[21]。虽然上述系统均获得较好的实验结果,但系统对其他动物模型以及人类癫痫病患者的有效性需要精确的实验和可靠的评估。
在闭环VNS系统的刺激参数评估方面,Tosato等在前人用狗的动物模型记录心电信号RR峰的时间间隔作为迷走神经电刺激反馈信号的基础之上,用猪的动物模型将迷走神经与心电信号相关的神经纤维数目也考虑在内(如图5所示),评估了闭环VNS刺激参数临床应用中的可重复性和刺激的稳定性[16]。对于VNS的疗效随病人使用时间的延长而癫痫控制效果越好的这一临床发现,Amar等认为VNS抗癫痫可能涉及神经元的重塑及神经递质的改变,即导致兴奋性神经递质的释放减少而抑制性神经递质的释放增加[22]。这些迷走神经刺激对于生理特性的影响,将为反馈型VNS系统的研究提供理论支持。
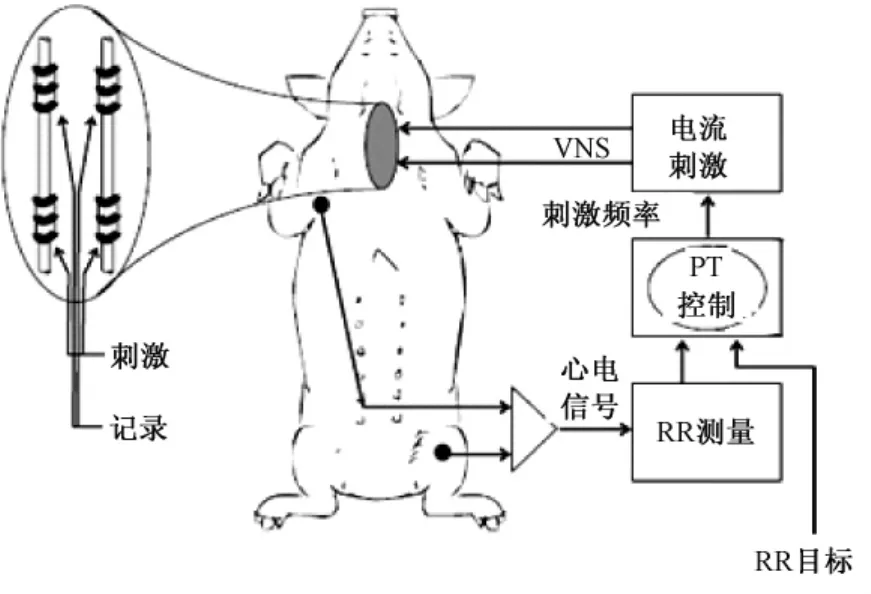
图5 闭环 VNS范例[16]Fig.5 The paradigm of close-loop VNS[16]
在临床应用研究方面,Shoeb等设计的初样系统利用实时测量的表面脑电信号(surface EEG)以及特定的算法成功地预测了癫痫发作,并自动开启了VNS治疗,同时临床试验评估了系统的敏感性和特异性[19]。传统的开环 VNS系统的刺激参数多为经验参数,设置的合理性无法有效评估。比利时的Neurotech公司 Tahry团队设计了 ADNS-300新型VNS系统,比 NCP系统在结构上增加了记录电极(如图6所示)。临床试验显示,在3名患者体内植入ADNS-300系统后,2名患者的癫痫发作率分别减少43%和40%,1名患者无明显改善,其中2名患者在接受刺激后检测到复合神经动作电位[23],为后续刺激参数的选择提供了参考。尽管ADNS-300系统为闭环VNS的实现提供了可能,但是Tahry在文中并未给出复合神经动作电位应用于闭环系统的方法和具体的实施过程,因此对闭环VNS系统仍然需要进行深入的研究分析。
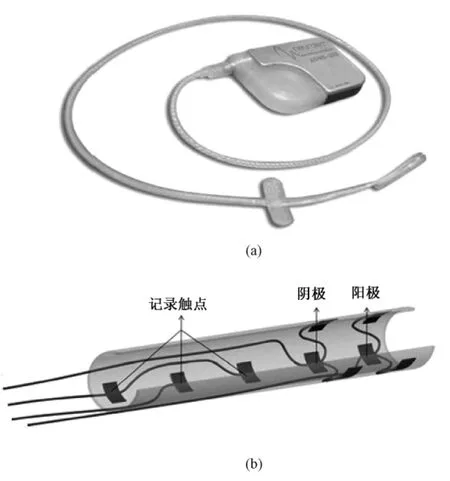
图6 ADNS-300 VNS刺激器及电极[23]。(a)VNS刺激器;(b)电极Fig.6 The ADNS-300 vagus nerve stimulator and schematic representation the ADNS-300 electrode[23].(a)VNS stimulator;(b)electrode
4 闭环脊髓神经起搏器
1965年,Shealey首先提出 SCS可用于治疗疼痛[24]。现在,Medtronic、St.Jude 和 Boston Scientific等3家公司都提供FDA批准的SCS系统,用于治疗躯干和四肢(背部、下肢和上肢)的疼痛,每年全球有超过5万名患者受益于这一治疗方案[4]。SCS系统主要通过抑制背角神经元的异常兴奋或交感神经系统达到神经刺激治疗的目的,但具体机制仍不明确,且临床应用中存在诸多问题,如脊髓神经刺激只对50%~70%的患者有效,术后需检查和随访确定刺激参数的有效性,且器械更换费用昂贵等,因此闭环脊髓治疗的研究具有很高的价值。
与闭环 DBS系统和 VNS系统类似,闭环 SCS系统的理论研究主要集中在治疗效果的评估以及刺激的作用机制。Muonocore等研究发现,SCS系统对于患者体感诱发电位(SEPS)具有抑制作用,从而推断SCS的治疗神经性疼痛的机制源于对大直径神经纤维动作电位传导的逆向碰撞[25],这一结论为闭环控制的反馈信号的选取提供了理论依据。Wolter等评估了影响SCS系统临床疗效的因素,通过61个患者的临床数据表明,间歇剌激和连续刺激两种模式的效率相同[26],这一研究结果为闭环 SCS系统刺激模式的预选以及疗效的评估提供了临床证明。
在临床应用方面,当患者的位置或活动状态发生变化时,刺激电脉冲的强度随硬膜外空间(电极位置)与脊髓靶区距离的变化而发生变化[27-28]。为减小刺激幅度变化带来的治疗效果变化,早在1997年,Dijkstra等根据超声测距的原理,确定电极与刺激靶区的距离,调整 SCS系统的刺激参数[27],但是距离的测量精度、轴向分辨率以及尺寸都无法满足临床的使用需求。2011年,Medtronic公司研发的RestoreSensor神经刺激器经美国FDA批准用于临床,该系统利用三轴加速度计采集电极与脊髓靶区距离的变化信息,自动调整输出电流幅度,如图7所示。随后进行了79个患者的临床实验,数据表明,与手动调整参数的脊髓刺激器相比,80.3%的患者在位置变化时舒适性增加,69%的患者活动能力提高,47.9%的患者睡眠质量得到改善,两种不同刺激器的不良反应没有显著差异[28]。

图7 RestoreSensor系统自适应检测[29]Fig.7 Illustration of self-adaptive detection of the RestoreSensor system[29]
经过近40年的发展,脊髓刺激器已实现可充电和可编程等的进展,不同类型的导联线和电极组合也使 SCS系统能够刺激脊髓的不同区域,提高了SCS方法治疗疼痛的疗效。尽管如此,闭环SCS系统在临床应用方面仍然进展甚微,选取合适的参考信号或反馈信号、改善刺激的效率等问题都有待解决。
5 闭环神经刺激技术发展
根据临床应用的需求以及神经生物学的发展,闭环刺激是一个必然的方向,其进展依赖如下基础或技术的进步。
5.1 神经科学的进展
目前,应用于临床的闭环脑刺激、迷走神经刺激以及脊髓刺激基本是依靠治疗效果的反馈进行刺激参数的调整,仅有Neuropace的RNS系统是根据病灶异常信号的检测来实现按需刺激。造成这一现状的主要原因是神经刺激的作用机制尚未完善,无法设计合理的反馈通路以及闭环系统。因此,神经科学的发展是实现按需刺激(病灶或病征预判后的有效刺激)的迫切需求。另外,人体生理信号的有效提取,即神经刺激器反馈信号的合理选择,是神经科学进行基础分析的必要条件。综上所述,神经科学与闭环神经刺激技术之间的发展是相互促进的。在神经科学的指导下,实现神经功能失调的早期判断,设置合理的刺激参数,然后根据人体反馈的生理信息来改善治疗效果,这一完整闭环过程的实施具有重要的临床意义。
5.2 反馈信号获取方法与传感装置
综合前文的分析,闭环神经刺激系统的反馈信号主要集中在两个方面:一是生理电信号,二是生物化学信号。前者的获取需要特殊结构的金属电极,如Neurotech公司用于复合神经动作电位检测的cuff电极等;后者的在体检测则需要使用可植入式的生物传感器,如Kendall H.Lee等用于多巴胺检测的生物传感器。随着纳米以及生物芯片技术的发展,反馈信号的检测装置逐步走向微型化,疾病信号以及治疗反馈信号的提取也将达到分子水平[30]。然而,需要指出的是,反馈信号采集装置的发展也给闭环神经刺激技术提出新的要求,如纳米管电极与刺激器的接口处理、金属电极的制作和性能评估以及生物芯片的生物相容性等均需要进一步研究。
5.3 集成微电子技术
闭环植入式神经刺激器由刺激、记录、信号处理、无线通信4个功能不同的模块组成,如何实现这些模块的片上集成、降低神经信号记录过程中的噪声、设计电极与组织界面以及电路结构的建模等,都是集成闭环神经刺激器研究应用所面临的问题。研究现状表明,植入式神经刺激系统集成芯片还处于实验室阶段,距离临床应用还有一定的距离。但是,Wentai Liu等进行研究,提出混合电压和混合信号技术结合高性能的工艺,将使低功耗的微型神经刺激技术成为可能[31]。
5.4 系统可靠性与高可靠性闭环算法
美国FDA的召回案例显示了神经刺激器的故障给患者带来的严重后果,部分甚至需要手术干预来解决[4]。在开环式神经刺激器的基础上,闭环系统增加了记录电极和采集处理电路,影响系统可靠性的因素增加。同时,对采集信号进行实时分析,正确检测病源,降低漏检率、误检率,减少算法用时,有效调整刺激参数的需求,使高可靠性嵌入式算法的重要性也显著提高。基于闭环神经刺激器特殊的工作环境,其系统可靠性的要求比航天设备更甚,因此高可靠性是闭环神经刺激技术发展的必要保障。
5.5 大容量电池技术或简单的充电技术
刺激器由于电路复杂以及附属配件的增加,使其系统功耗高于开环系统。有数据显示,RNS系统的寿命仅为12~26个月[15],患者必须适时重新更换刺激器,在增加治疗费用的同时,也带来手术的痛苦。目前,提高神经刺激器寿命的途径主要是增加电池容量和使用可充电电池两种方式,且取得了一定的进展。其中,Greatbatch公司生产的大容量电池比普通电池的能量密度提高 40%以上[32],Medtronic、St.Jude和 Boston Scientific已将经皮无线充电的神经刺激器应用于临床[33]。尽管如此,对于儿童癫痫病患者或者需植入时间较长的患者而言,延长闭环植入式神经刺激器的使用寿命将是研究设计人员不断追求的目标。
闭环植入式神经刺激器自适应的特性是神经刺激器研发成为热点的原因之一,然而神经刺激作用机制的未知性、刺激参数评估的有效性不足以及刺激器本身性能的不够完善是其发展的阻碍因素。随着神经科学和生物电子学的发展,这些问题的解决必然提升闭环植入式神经刺激器的临床应用价值。
[1]岑川,何建成.中医药防治帕金森病药物左旋多巴副作用研究进展[J].中华中医药学学刊,2009,27(12):2530-2532.
[2]孙伟,孟祥红,毛薇,等.神经电调控技术治疗难治性癫痫的研究与进展[J].癫痫与神经电生理学,2010,19(5):303-306.
[3]王湘庆,郎森阳.新型抗癫痫药物对认知功能的影响[J].海军总医院学报,2006,19(1):26-29.
[4]李路明,郝红伟.植入式神经刺激器的现状与发展趋势[J].中国医疗器械杂志,2009,33(2):107-111.
[5]Rosin B,Slovik M,Mitelman R,et al.Closed-loop deep brain stimulation is superior in ameliorating Parkinsonism [J].Neuron,2011,72(2):370-384.
[6]Fernando JS,Rui MC,Fatuel T.Stimulation on demand:Closing the loop on deep brain stimulation[J].Neuron,2011,72(2):197-198.
[7]Collins A.Activa® 脑深部电刺激疗法[EB/OL].http://www.medtronic.com.cn,2009-05-05/2012-04-24.
[8]Eberle W,Penders J,Yazicioglu RF.Closing the loop for deep brain stimulation implants enables personalized healthcare for Parkinson's disease patients[C]//33rd Annual International Conference of IEEE Engineering in Medicine and Biology Society.Boston:IEEE,2011:1556-1558.
[9]Santaniello S,Fiengo G,Glielmo L,et al.Closed-loop control of deep brain stimulation:A simulation study [J]. IEEE Transactions on Neural Systems and Rehabilitation Engineering,2011,19(1):15-24.
[10]Rossi L,Foffani G,Marceglia S,et al.An electronic device for artefact suppression in human local field potential recordings during deep brain stimulation[J]. Journal of Neural Engineering,2007,4(2):96-106.
[11]Kent AR,Grill WM.Instrumentation to record evoked potentials for closed-loop control of deep brain stimulation[C]//33 rd Annual International Conference of IEEE Engineering in Medicine and Biology Society,Boston:IEEE,2011:6777-6780.
[12]Lee KH,Blaha CD,Garris PA,et al.Evolution of deep brain stimulation:Human electrometer and smart devices supporting the next generation of therapy[J].Neuromodulation,2009,12(2):85-103.
[13]Morrell MJ.Overview & clinical trials[EB/OL].http://www.neuropace.com,2010-07-08/2012-04-24.
[14]Fountas KN,Smith JR,Murro AM,et al.Implantation of a closed-loop stimulation in the management of medically refractory focal epilepsy[J].Stereotactic Functional Neurosurgery,2005,83(4):153-158.
[15]Krames ES,Peckham PH,Rezai AR.Neuromodulation[M].Burlington:Academic Press,2009:661.
[16]Browne G. Cyberonics overview [EB/OL]. http://www.cyberonics.com,2012-01-01/2012-04-24.
[17]Tosato M,Yoshida K,Toft E,et al.Closed-loop control of the heart rate by electrical stimulation of the vagus nerve[J].Medical& Biological Engineering& Computing,2006,44(3):161-169.
[18]Anholt TA,Ayal S,Goldberg JA.Recruitment and blocking properties of the CardioFit stimulation lead [J].Journal of Neural Engineering,2011,8(3):034004.
[19]Shoeb A,Pang T,Guttag J.V,et al.Implementation of closedloop, surface EEG-triggered vagus nerve stimulation [J].Epilepsia,2007,48(S6):304.
[20]Nielsen KR,Sevcencu C,Rasmussen A,et al.Prediction of epileptic seizures for on-demand Vagus Nerve Stimulation[C]//14th Nordic-Baltic Conference on Biomedical Engineering and Medical Physics,Berlin:Springer,2008,20:290-293.
[21]Harreby KR,Sevcencu C,Struijk JJ.Early seizure detection in rats based on vagus nerve activity[J].Medical& Biological Engineering& Computing,2011,49(2):143-151.
[22]Amar AP, Apuzzo ML, Liu CY.Vagus nerve stimulation therapy after failed cranial surgery for intractable epilepsy:results from the vagus nerve stimulation therapy patient outcome registry[J].Neurosurgery,2008,62(Suppl 2):506-513.
[23]El Tahry R,Raedt R,Molleta L,et al.A novel implantable vagus nerve stimulation system(ANDS-300) for combined stimulation and recording of the vagus nerve[J].Epilepsy Research,2010,92(2-3):231-239.
[24]Kunnumpurath S,Srinivasagopalan R,Vadivelu N.Spinal cord stimulation:Principles of past,present and future practice:a review [J].Journal of Clinical Monitoring and Computing,2009,23(5):333-339.
[25]Buonocore M,Bodini A,Demaryini L,et al.Inhibition of somatosensory evoked potentials during spinal cord stimulationand its possible role in the comprehension of antalgic mechanisms of neurostimulation for neuropathic pain [J].Minerva Anestesiologica,2012,78(3):297-302.
[26]Wolter T, Winkelmüller M. Continuous versus intermittent Spinal Cord Stimulation:An analysis of factors influencing clinical efficacy[J].Neuro-modulation,2012,15(1):13-19.
[27]Dijkstra EA, Holsheimer J, Olthuis W, et al. Ultrasonic distance detection for a closed-loop spinal cord stimulation system[C]//Proceedings of the 19 th Annual International Conference of the IEEE Engineering in Medicine and Biology Society.Chicago:IEEE,1997,5:1954.
[28]Schultz DM,Webster L,Kosek P,et al.Sensor-driven positionadaptive spinal cord stimulation for chronic pain [J].Pain Physician,2012,15(1):1-12.
[29]Schultz DM.The choice of continuous motion [EB/OL].http://www.restoresensor.eu,2011-07-17/2012-04-24.
[30]Nama Y,Brownb EA,Rossc JD,et al.A retrofitted neural recording system with a novel stimulation IC to monitor early neural responses from a stimulating electrode[J].Journal of Neuroscience Methods,2009,178(1):99-102.
[31]Liu WT, Yang Z. Engineering hope with biomimetic microelectronic systems[C]//ESSCIRC 2010-36 th European Solid State Circuits Conference.Seville:IEEE,2010:17-26.
[32]Ambrosetti S.Medium-rate primary cells[EB/OL].http://www.greatbatchmedical.com/batteriesPrimary.aspx? s =product,2012-02-08/2012-04-24.
[33]Lovik RD,Abraham JP,Sparrow EM.Surrogate human tissue temperatures resulting from misalignment of antenna and implant during recharging of a neuro- modulation device [J].Neuromodulation,2011,14(6):501-511.

