复方乌梅对鲤鱼非特异性免疫的影响
向 桢 郑曙明 杨进才 龚鸿霞 刘 英
(西南大学鱼类繁育与健康养殖研究中心,重庆 402460)
近年来,中药因其毒性低、无耐药性和药物残留,以及广泛的抗菌、抑菌作用等特点,在水产养殖中得到广泛的应用。简纪常等[1]研究发现,以黄芪为主的中草药按1%比例添加到饲料中投喂建鲤15 d后,能明显提高NBT(氮蓝四唑)阳性细胞的数量,从而明显提高建鲤的非特异性免疫能力。罗庆华[2]在鲤鱼饲料中添加杜仲叶粉的试验结果表明,杜仲叶粉能明显提高鲤鱼免疫应答水平。胡兵等[3]发现饲料中添加不同水平的黄芪多糖对异育银鲫的非特异性免疫力具有明显的促进作用。刘丽平等[4]研究同样得出,中草药制剂能够增强中华绒螯蟹抵抗疾病的能力。本试验通过对鲤鱼进行攻毒并且在攻毒前后投喂复方乌梅药饵,进而探究复方乌梅对鱼体非特异性免疫功能的影响以及防治疾病的效果,为中药在提高鱼机体免疫力方面提供参考。
1 材料与方法
1.1 试验鱼
健康鲤鱼400尾,体重为(48±1.31)g,购自重庆市荣昌县梅石坝渔场。放养在水族箱里(100 cm×40 cm×50 cm)暂养一周,选择体格健康、规格均匀的个体进行试验。
1.2 药饵制备
试验饲料购自通威公司的鲤鱼基础饲料(其中蛋白质含量为35%)。复方以乌梅为主药,其他中药为辅药,经烘干、粉碎后将各种中药按一定比例混匀制成复方,再与通威鲤鱼基础饲料按照1%比例混匀后制成直径为2.00 mm颗粒,45℃烘干、分装、密封保存备用。
1.3 试验菌株
温和气单胞菌(Aeromonas Sobria)由西南大学荣昌校区微生物教研室分离鉴定。将温和气单胞菌接种于普通肉汤培养基中,28℃恒温培养24 h,选择形状规则、单一的菌落接种于液体培养基中,28℃振荡培养24 h,采用麦氏比浊法将菌液稀释成浓度3×109cfu/ml的应用菌液。
1.4 试验设计
将试验鱼随机分为5组:空白组(全程投喂基础饲料、不攻毒)、对照组(全程饲喂基础饲料并攻毒)、试验Ⅰ组(攻毒前投喂基础饲料、攻毒后投喂1%复方乌梅药饵)、试验Ⅱ组 (全程投喂1%复方乌梅药饵并攻毒)、试验Ⅲ组(攻毒前投喂1%复方乌梅药饵、攻毒后投喂基础饲料)。每组40尾,各设一个重复组。试验期间各组按照试验设计日投喂量为鱼体重1.5%~2.0%的基础饲料或药饵,每天9:00和17:00两次投喂,水温(26±1)℃,24 h 充气增氧,确保溶氧高于 6mg/l,每天换水2次,每次换水前用虹吸法吸出箱底的残饵和粪便。试验时间16 d,于试验第9 d对试验Ⅰ组、试验Ⅱ组、试验Ⅲ组和对照组进行攻毒,每尾试验鱼胸鳍基部注射0.1 ml应用菌液,空白组胸鳍基部注射0.9%的生理盐水。观察并记录各组鱼的症状及死亡数量,计算死亡率。
1.5 样品采集
正式试验开始后,每间隔3 d,分别从各组中随机捞取3尾供试鲤鱼,逐尾测量其体重后,对其尾静脉抽血。以肝素抗凝,制备抗凝血,置4℃冰箱备用。以供红细胞、血红蛋白、NBT阳性细胞和淋巴细胞吞噬活性的测定。
1.6 测定指标与方法
1.6.1 红细胞数的测定
用红细胞稀释液(姬姆氏液)将非抗凝血进行200倍稀释,用血球计数板计数红细胞。计算公式为:
红细胞数(106个/mm3)=计数板中的红细胞数×稀释倍数/计数室中格容积(稀释倍数为200,计数室中格容积为0.02 mm3)。
1.6.2 血红蛋白含量的测定
采用氰化高铁血红蛋白(HiCN)法。在一试管中准确加入5.0 ml HiCN稀释试剂,作为测定管。用血红蛋白吸管准确吸取全血20 μl,置于试剂中,冲洗3次,混合。混合液放置3 min后,倒入1 cm比色皿,于540 nm进行比色。以蒸馏水或HiCN稀释试剂作为空白管,读取测定管光密度值。
血红蛋白含量(g/l)=OD×(64 458/44 000)×251=OD×367.7。
式中:OD——测定管光密度值;
64458——目前国际公认的血红蛋白摩尔质量;
44000——国际血液学标准化委员会公布的血红蛋白摩尔吸光度;
251——稀释倍数。
1.6.3 NBT阳性细胞的测定
根据修改后的 Anderson等[5]的方法,取 50 μl血细胞滴加于盖玻片上,于室温下的湿盒中温育30 min后,在0.067 mol/l PBS(pH值6.4)中轻轻地洗涤盖玻片以完全去除红细胞,然后在载玻片上滴加50 μl 2mg/l NBT溶液,将盖玻片反扣在NBT溶液上,于湿盒中温育30 min,在显微镜下观察。染成黑色或棕黑色的细胞为NBT阳性细胞。随机选择10个视野观察结果,最后计算平均1个视野中NBT阳性细胞数。
1.6.4 淋巴细胞吞噬活性的测定
采用罗琳等[6]的方法取抗凝血,置小烧杯中,加入温和气单胞菌灭活菌苗轻轻搅动摇匀,37℃水浴中温育30 min,每隔10 min摇动1次,而后1 000 r/min离心10 min,弃上清液,用注射器吸取白细胞层细胞做血液涂片,风干后,置于瑞氏染色缸上染色,瑞氏染色液浸染5~6 min后,用缓冲液浸染3~5 min,而后用蒸馏水洗干净,涂片干燥后用油镜检测。根据下式计算淋巴细胞吞噬率(PP)及淋巴细胞吞噬指数(PI)。
吞噬率(%)=(100个吞噬细胞中参与吞噬的细胞数/100)×100;
吞噬指数(%)=(吞噬细胞内的细菌总数/参与吞噬的吞噬细胞数)×100。
1.6.5 免疫器官指数的测定
每次采血后剖检,观察试验鱼内脏器官的变化,分别将采血后的鲤鱼肝胰脏、肾脏和脾脏分离,分离的脏器用4℃的生理盐水冲洗干净后用吸水纸吸干水分,称重,并计算各免疫器官指数。
免疫器官指数(%)=免疫器官质量(g)/鱼体质量(g)×100。
1.7 数据分析
采用SPSS 17.0统计处理软件对数据进行单因素方差分析和Duncan's法多重分析,显著性水平为P<0.05,极显著水平为 P<0.01。
2 结果
2.1 攻毒试验结果
攻毒后,试验鱼在2 h后出现死亡,死亡集中在48~96 h。患病鱼表现为游动缓慢,摄食降低或不食,鳍基部、上下颌等处有点状充血,眼球充血突出,肛门充血,体表黏液增多,偶有鳞片脱落,腹部少许肿胀,解剖可见黄色或红色腹水,肝脏、肾脏、心脏肿大。呈典型的细菌性败血症症状,表明患病鱼体因细菌性败血症致死。
攻毒死亡率结果见表1,3个试验组的死亡率均显著低于对照组(P<0.05),其中,攻毒后投喂药饵的试验Ⅰ组和全程投喂药饵的试验Ⅱ组死亡率,极显著低于对照组,说明全程给药组能显著降低患病鲤鱼的死亡率,提高其抗病存活率。

表1 攻毒后鲤鱼的死亡率
2.2 红细胞含量测定结果(见图1)
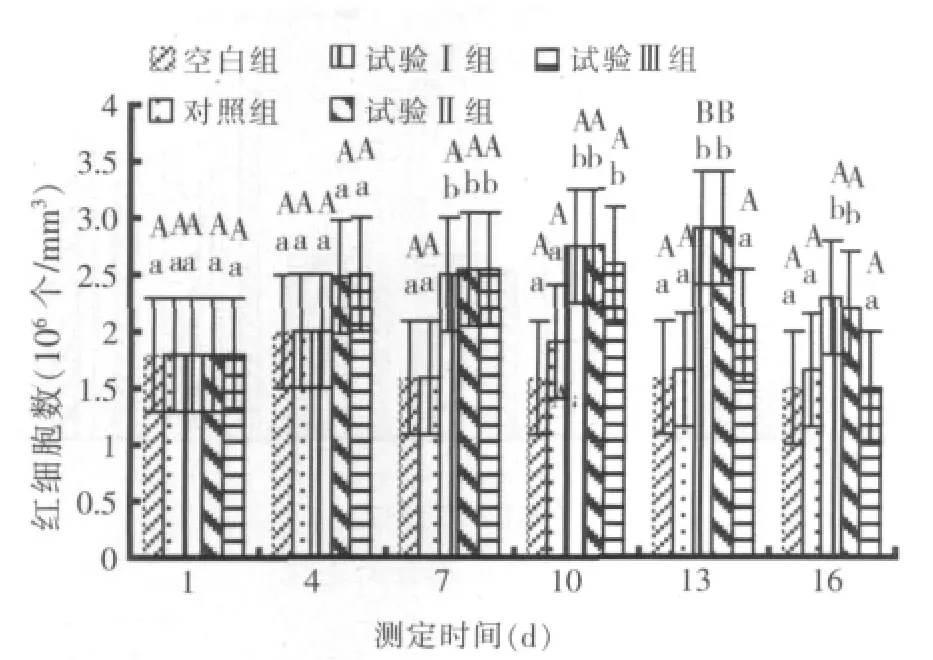
图1 红细胞含量的变化
全程投喂药饵的试验Ⅱ组和攻毒前投喂药饵的试验Ⅲ组在攻毒前红细胞数不断增加,试验7 d时两试验组红细胞数约2.5×106个/mm3,显著高于对照组1.6×106个/mm3(P<0.05);攻毒后,投喂基础饲料的试验Ⅲ组红细胞数呈下降趋势,而投喂药饵的试验Ⅰ组和试验Ⅱ组红细胞数持续增加,试验结束16 d时试验Ⅰ组和试验Ⅱ组红细胞数虽略有减少,但攻毒后期两试验组红细胞数约 2.2×106~2.9×106个/mm3,相对于对照组 1.6×106个/mm3,差异极显著(P<0.01)。说明复方乌梅能显著增加鲤鱼的红细胞数,而全程给药组(试验Ⅱ组)效果最佳。
2.3 血红蛋白含量测定结果(见图2)
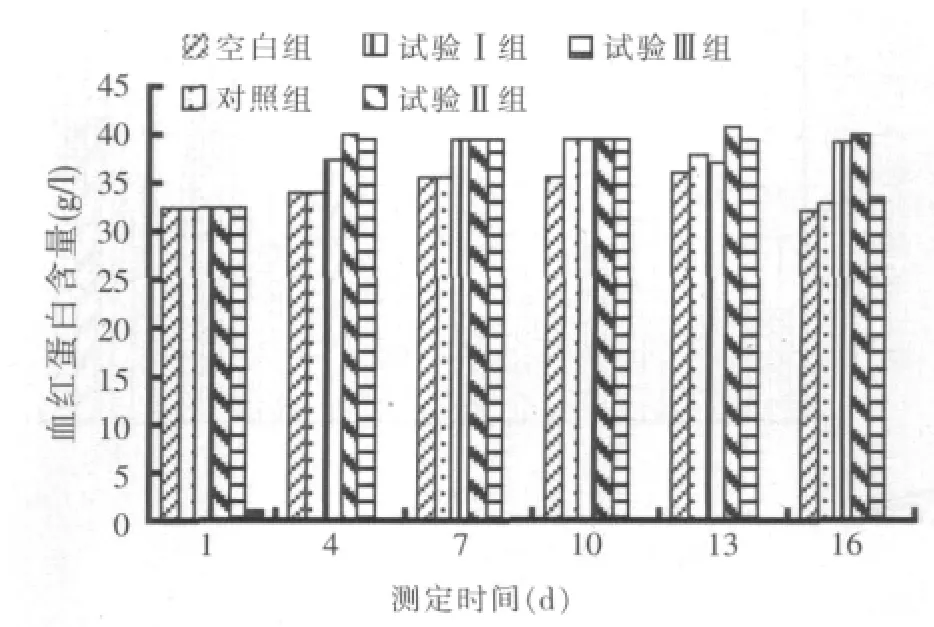
图2 血红蛋白含量的变化
攻毒前后,3个试验组血红蛋白含量的变化趋势不明显,与对照组相比血红蛋白含量差异不显著 (P>0.05),说明复方乌梅对鱼体血红蛋白含量的变化影响不大。
2.4 NBT阳性细胞数测定结果(见图3)
攻毒前,各试验组NBT阳性细胞数与对照组相比差异不显著(P>0.05);攻毒后,全程投喂药饵的试验Ⅱ组NBT阳性细胞数持续增加,且在试验结束16 d时,其NBT阳性细胞数增加到最大值,显著高于试验Ⅰ组、试验Ⅲ组和对照组(P<0.05)。说明持续投喂复方乌梅能明显增加鲤鱼NBT阳性细胞数。
2.5 淋巴细胞吞噬活性测定结果
淋巴细胞吞噬率和吞噬指数趋势见图4、图5。整个试验阶段,3个试验组淋巴细胞吞噬率和吞噬指数总体呈上升趋势,并在试验7 d以后,试验Ⅰ组和试验Ⅲ组淋巴细胞吞噬率和吞噬指数均显著高于对照组(P<0.05),而试验Ⅱ组极显著高于对照组(P<0.01)。说明复方乌梅能显著提高鲤鱼淋巴细胞的吞噬活性,尤以全程给药组(试验Ⅱ组)效果最佳。

图3 鲤鱼NBT阳性细胞数的变化
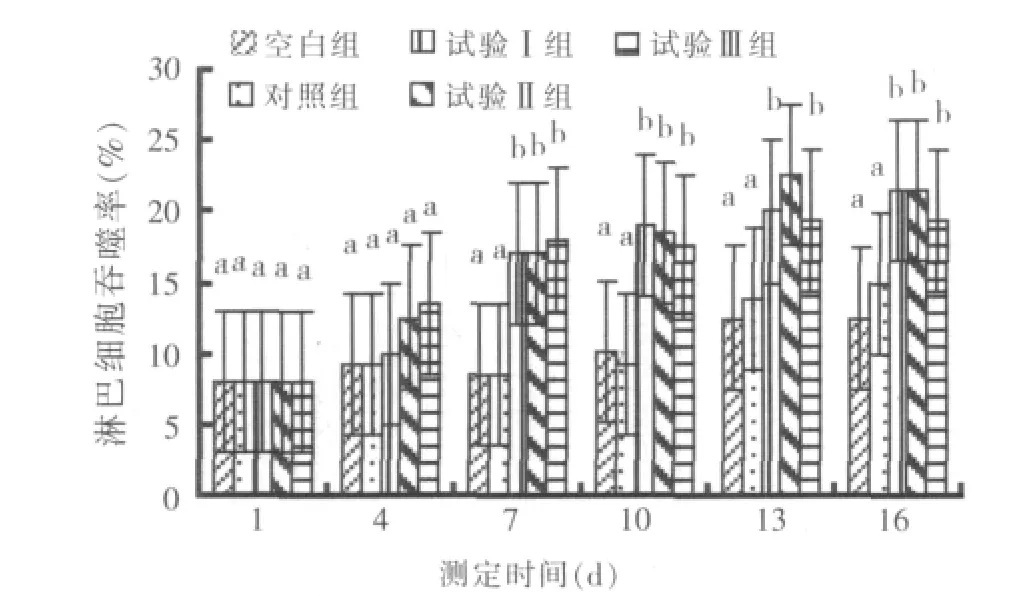
图4 淋巴细胞吞噬率的变化

图5 淋巴细胞吞噬指数的比较
2.6 免疫器官指数测定结果
各免疫器官指数的变化见图6、图7、图8。结果显示,整个试验阶段,各试验组肝胰脏指数呈现不同程度的上升,在试验结束16 d时各试验组肝胰脏指数与对照组相比差异不显著(P>0.05)。而试验Ⅰ组、试验Ⅱ组、试验Ⅲ组肾脏指数和脾脏指数在整个试验过程中均呈上升趋势,试验结束16 d时试验Ⅰ组、试验Ⅱ组、试验Ⅲ组的肾脏指数和脾脏指数均高于对照组,但差异不显著(P>0.05),说明复方乌梅对鲤鱼免疫器官的影响不明显。

图6 肝胰脏指数的变化

图7 肾脏指数的变化
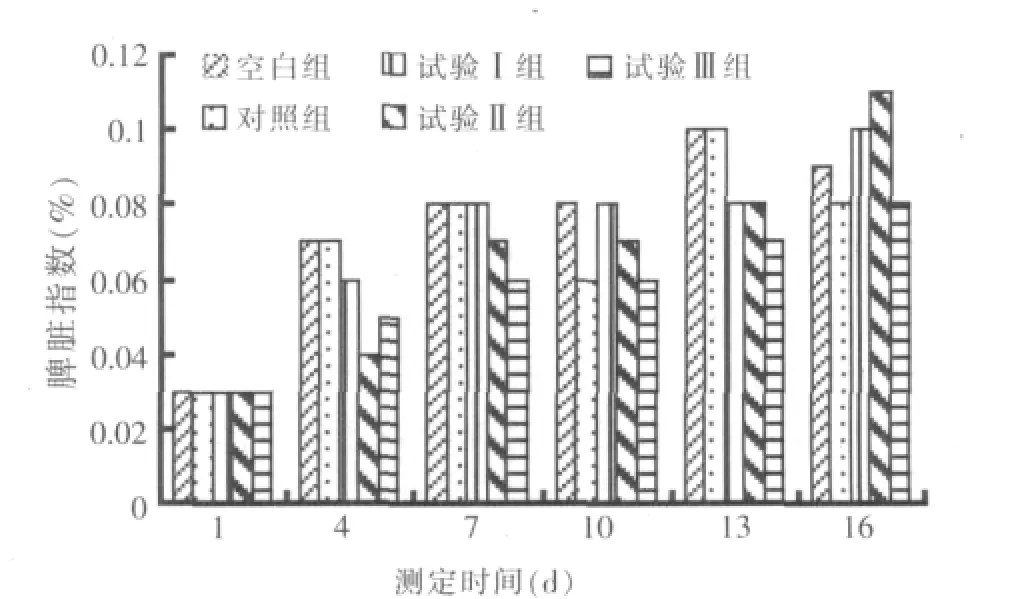
图8 脾脏指数的变化
3 讨论
3.1 中药对红细胞及血红蛋白含量的影响
Siegel等[7]在1981年提出红细胞免疫系统(Redcell immune system)的新概念,认为红细胞的数量直接或间接影响着机体的免疫能力,也可以间接的反应出此种药物对疾病的预防和治疗能力。本试验结果显示,试验Ⅰ、Ⅱ、Ⅲ组在投喂药饵时期,红细胞数均显著高于对照组,说明复方乌梅能迅速被鱼体吸收并达到药效积累,促进鱼体增加自身红细胞数,从而提高机体的免疫能力。廖立坤[8]曾以复方乌梅口灌鲫鱼后,发现短时间内血液药效浓度能够迅速达到峰值,也证明复方乌梅能被鲫鱼肠道迅速吸收,并达到抑菌作用,因为复方乌梅是以有机酸类、黄酮为主要有效成分的复方。已有许多报道[9-10]证明,有机酸类(Organic acids)具有较强的抑菌作用。而攻毒后,投喂基础饲料的试验Ⅲ组红细胞数不断减少,分析原因可能是体内药效不断减少所致;而投喂复方乌梅药饵的试验Ⅰ组、试验Ⅱ组红细胞数虽继续增加,但在试验13 d后表现为减少趋势,原因可能是复方乌梅的最佳药效是给药2周内,或者与机体免疫疲劳有关[11]。整个试验阶段,各试验组血红蛋白含量与对照组相比差异不显著;但在试验结束16 d,试验Ⅰ组、试验Ⅱ组血红蛋白数高于对照组,说明复方乌梅对鱼体血红蛋白的增加有一定的作用,只是没有红细胞增加明显,但与韩兆红等[12]研究中草药提取物对团头鲂生长及免疫力的影响结果一致。
3.2 中药对NBT阳性细胞数的影响
在鱼类血细胞中,吞噬细胞、中性粒细胞、巨噬细胞都具有吞噬异物的能力,是鱼类非特异性免疫的主要指标之一,它们的数量和吞噬能力的高低可直接反映出鱼类非特异性免疫能力的大小,在鱼类的非特异性免疫中起着至关重要的作用。NBT阳性细胞就是这3种细胞的总称。这些细胞吞噬了NBT(氮蓝四唑)后,胞质中的葡萄糖-6-磷酸氧化所脱下的氢被NBT接受,使淡黄色的NBT还原成棕黑色,因而,NBT是研究这3种细胞数量和吞噬能力的极好指示剂。国内外不少学者通过研究NBT阳性细胞数来研究机体非特异性免疫力。如Jian(2003)[13]按5:1的比例将黄芪、当归添加到饲料中投喂大黄鱼,结果在投喂后第20、25、30 d,添加量为1%和1.5%的试验鱼NBT阳性细胞数量都显著高于对照组。说明中草药能够增强大黄鱼非特异性免疫力。
本次试验结果表明,投喂药饵的试验组NBT阳性细胞数在攻毒前变化幅度不大,但含量高于对照组,与陈玉春[14]用复方中草药投喂镜鲤14 d后,其复方组与对照组差异不显著,但复方组NBT阳性细胞数均高于对照组的研究结果一致,说明复方乌梅已经开始对试验鱼的免疫系统产生刺激作用,只是药物在体内还未达到最大效能;而攻毒后,投喂药饵组的NBT阳性细胞数持续增加,且全程给药组(试验Ⅱ组)在试验结束16 d,其NBT阳性细胞数显著高于试验Ⅰ组、试验Ⅲ组和对照组,说明持续投喂复方乌梅药饵,其药效作用达到了积累,能明显促进鱼体NBT阳性细胞数的增加,这一规律与刘华忠等[15]研究添加1%复方中药到饲料中进行投喂彭泽鲫,14 d后NBT阳性细胞数显著高于对照组的研究结果一致。表明中药能够显著增加鲤鱼非特异性免疫细胞的数量,起到增强鱼体非特异性免疫功能的作用。
3.3 中药对淋巴细胞吞噬活性的影响
淋巴细胞是来源于淋巴样系列在免疫应答过程中起核心作用的白细胞,白细胞具有强大的吞噬功能,是机体非特异性免疫的重要部分。一般认为,动物体内的吞噬细胞可吞噬进入体内的异物,吞噬细胞在消化病原生物的同时,可保留有关的抗原信息并将其传递给有关的淋巴细胞,从而激发机体的细胞免疫和体液免疫。因此,吞噬细胞的吞噬活性直接与动物的免疫机能有关。蔡中华等[16]研究发现,大黄、黄连、花粉能引起鲤鱼吞噬细胞吞噬能力的增强,能显著提高鱼体非特异性免疫能力;刘金海等[17]通过对半滑舌鳎投喂添加中药的免疫饵料,30 d时白细胞吞噬活性增强,且与对照组相比差异显著;吴凡[18]在免疫刺激剂对水产动物免疫机能影响的研究中,发现4个投喂甘草素的试验组其异育银鲫白细胞的吞噬活性均显著增强,说明中药对鱼体非特异性免疫有促进作用。
本次试验结果表明,3个试验组的淋巴细胞吞噬活性总体呈上升趋势,并且在试验结束16 d,3个试验组的淋巴细胞吞噬率和吞噬指数均显著高于对照组和空白组,与上述类似研究结果符合。而在试验结束16 d,3个试验组的淋巴细胞吞噬活性变化趋于平缓,说明鲤鱼的最佳免疫时间段可能是在给药前2周,随着投喂药饵时间的延长,免疫指标保持在一个相对稳定的水平。但总的来说,试验组的免疫指标明显高于对照组,说明复方乌梅能显著提高鲤鱼淋巴细胞的吞噬活性,增强鱼体的非特异性免疫,而持续投喂药饵的免疫效果最佳。
3.4 中药对免疫器官指数的影响
脾脏、肾脏和肝胰脏是鱼的主要免疫器官。脾脏是机体内最大的外周免疫器官,是产生致敏淋巴细胞和抗体的场所之一[19];肾脏是鱼类重要的淋巴细胞组织。而鱼类的肝胰脏是重要的解毒器官,具有防御免疫能力[20];理论上免疫器官重量的变化与机体免疫状况的变化密切相关。在一定程度上,免疫器官内淋巴细胞的数量能够从免疫器官的重量得到体现,从而间接了解体内淋巴细胞总体水平。卢彤岩等[21]在饵料中添加1%的黄芪、板蓝根投喂鲤鱼45 d后,结果均可以明显提高鱼体免疫器官(胸腺、头肾和脾脏)的重量。王海华等[22]拟用3个复方中药方剂研究彭泽鲫的免疫系统,结果复方中药能显著增大鱼体的头肾指数和脾脏指数。但也有不同的研究结果:顾雪飞等[23]在配合饲料中添加刺五加、蒲公英等单方中草药饲喂鲤鱼,在试验第15 d与30 d后,所有试验组的各免疫器官指数与对照组相比均无显著性差异;胡兵等[3]研究饲料中添加不同水平的黄芪多糖对异育银鲫非特异性免疫力的影响,结果第15、30和45 d时,各试验组头肾指数差异不显著;而脾脏指数虽有一定变化,但与空白对照组比较无显著差异。
本次研究结果表明,试验鱼各免疫器官指数与对照组相比均无显著差异,说明此复方对鲤鱼免疫器官的增重影响不明显,分析原因可能是此复方对鲤鱼免疫器官的影响存在一定的“时效”关系,中药药效还没有积累达到一定程度,具体原因则有待于进一步研究。
4 结论
饲料中添加复方乌梅可显著提高鲤鱼攻毒后的存活率;饲料中添加复方乌梅可显著增加鲤鱼红细胞数和NBT阳性细胞数,以及提高鲤鱼淋巴细胞的吞噬活性;饲料中添加复方乌梅对鲤鱼血红蛋白含量及免疫器官指数的变化影响不大。
[1]简纪常,吴灶和.中草药对建鲤非特异性免疫功能的影响 [J].大连水产学院学报,2002,17(2):114-119.
[2]罗庆华.杜仲叶粉对鲤鱼免疫力的影响[J].湖南农业大学学报(自然科学版),2002,28(1):51-53.
[3]胡兵,刘军,侯永清,等.黄芪多糖对异育银鲫非特异性免疫力的影响[J].水利渔业,2008,28(3):108-111.
[4]刘丽平,薛晖,周刚.复方中草药对中华绒螯蟹免疫因子的影响[J].南京师大学报(自然科学版),2008(1):109-113.
[5]Anderson D P,Mori Famo T.Grooth R,Neutwphil,glass-adherent,nltroblne telrazolium assay gives earl yindication of immunization efectiveness in rainbow trout[J].Veterinary Immunology and Imnmnopatholy,1992,30:419-429.
[6]罗琳,陈孝煊,蔡雪峰.穿心莲对草鱼血液吞噬细胞吞噬活性的影响[J].西南农业大学学报,2001,23(1):33-38.
[7]Siegel I,Liu T L,Gieicher N.The-cell immune system[J].Lancet,1981,Ⅱ(8246):556.
[8]廖立坤.复方乌梅药代动力学及药效学研究[D].西南大学,2008.
[9]孙健,贺银凤,田建军.酸马奶酒中有机酸的抑菌作用[J].内蒙古农业大学学报,2003(1):94-97.
[10]梁玉芹,罗敏,宋炳彦,等.竹醋复合盐在番茄上的应用效果研究初报[J].河北农业科学,2006,10(1):116-117.
[11]吴桂玲.几种免疫增强剂对花鲈非特异性免疫力的影响及免疫疲劳初探[D].中国海洋大学,2007.
[12]韩兆红,叶元土,罗从彦.中草药提取物对团头鲂生长及免疫力的影响[J].饲料研究,2010(2):66-69.
[13]Jian J,Wu Z.Effects of traditional Chinese medicine on nonspecific immunity and disease resistance of large yellow croaker Pseudosciaena crocea(Richardson)[J].Aquaculture,2003,218:1-9.
[14]陈玉春.复方中草药对镜鲤(Cyprinus carpio L.)非特异性免疫及抗氧化功能的影响[D].东北农业大学,2008.
[15]刘华忠,刘定忠,赵学明.复方中草药对彭泽鲫非特异性免疫功能的影响[J].淡水渔业,2004,3(34):31-32.
[16]蔡中华,陈成勋,刑克智,等.四种中药对鲤鱼非特异性免疫功能的影响[J].天津农学院学报,1998,2(5):31-34.
[17]刘金海,周悬齐,凌空,等.中草药对半滑舌鳎非特异免疫活性的比较研究[J].饲料工业,2011,32(6):1-4.
[18]吴凡.免疫刺激剂对水产动物免疫机能的影响 [D].武汉:华中农业大学,2005.
[19]王宜艳,孙虎山,李光友.复合免疫药物对中国对虾血淋巴氧化酶和抗氧化酶活力的影响 [J].海洋科学进展,2002,20(3):79-83.
[20]谢麟,长青.论动物用中草药剂的新药开发[J].兽药与饲料添加剂,2002(3):24-26.
[21]卢彤岩,刘红柏,杨雨辉.两种中草药对鲤鱼非特异性免疫功能的影响[J].鱼类病害研究,2001,23(3):85.
[22]王海华,盛银平,曹义虎,等.鱼用免疫增强剂的作用机制及其应用研究进展[J].兽药与饲料添加剂,2005,10(2):25-27.
[23]顾雪飞,陈玉春,刘敏.中草药对鲤鱼非特异性免疫功能的影响[J].饲料工业,2007,28(8):24-26.

