高速逆流色谱法(HSCCC)分离制备香水莲花中的柚皮素
姜洪芳,石宝俊,赵伯涛,张卫明*
(1.南京师范大学,江苏南京 210046;2.南京野生植物综合利用研究院,江苏南京 210042)
香水莲花(Nymphaea hybrid)是睡莲科(Nymphaea)睡莲属热带大型睡莲,是一种多年生宿根水生花卉,有很高的观赏价值。香水莲花花朵硕大、色彩鲜艳,香气清雅宜人,集当今世界各地荷、莲珍贵品种之优点于一身,因而成为备受青睐的园林水生观赏花卉。近年来我国南方数省已开始引种,并且发展到了一定的规模。源于香水莲花的各种产品也开始不断开发,鲜花可供生食,亦可泡茶、浸酒或随其他食物炖煮,以子房连同雄蕊一起经高温烘焙制成的香水莲花茶,也有以其提取物制成的九品莲花酒等等,均具有一定的保健作用[1-3]。动物实验已经证明香水莲花具有降血脂、抗氧化、抑制酪氨酸酶及预防酒精肝[4-7]等生物活性,但化学成分研究相对较少。
高速逆流色谱(High-speed Countercurrent Chromatography,简称HSCCC)技术是应用两相互不混溶的溶剂系统在支撑管内高速行星运动的方式下进行天然产物的分离纯化,因而没有不可逆吸附,具有样品无损失、无污染、高效、快速和大制备量分离的优点。所以,在国内外已被广泛应用于生物、医药、环保和农业等领域中活性物质的分离纯化[8-10]。本文应用高速逆流色谱(HSCCC)对香水莲花的黄酮类化合物进行了纯化,经鉴定为柚皮素,此化合物为首次从该植物中分离得到,为香水莲花的进一步开发应用奠定了化学基础。
1 实验部分
1.1 仪器、试剂与材料
高速逆流色谱仪:TBE-300A半制备型(上海同田生化技术有限公司),TBD-2000紫外检测仪,TBP-50A恒流泵,TC-1050恒温循环器,聚四氟乙烯(PTFE)管分离柱(内径1.6 mm,分离柱体积280 mL),N2000色谱工作站和溶剂选择系统(浙江大学智达信息工程有限公司),进样环20 mL。
高效液相色谱仪:Agilent 1200 HPLC(美国安捷伦公司),G1354A四元泵,G1313A自动脱气机,G1316柱温箱,G1315B二极管阵列检测器。
HP1100LC-MSD型质谱仪;BRUKER AVANCE 500型核磁共振仪;
色谱柱:Ф7.8 cm ×75 cm;
超声波清洗器:KQ-600DE型 (昆山市超声仪器有限公司)
薄层层析用硅胶H,柱层析硅胶160~200目,青岛海洋化工厂生产;
萃取及硅胶柱分离、HSCCC分离用的试剂石油醚、氯仿、甲醇、乙酸乙酯和正己烷均为分析纯,高效液相色谱(HPLC)分析用甲醇为色谱纯,实验用水为超纯水。
香水莲花带雄蕊的干燥花托,浙江省温州市三心美德投资有限公司提供。七月采摘,剥去萼片和花瓣,贴近花托基部切去花梗,晒干或烘干。经鉴定其基原为Nymphaea hybrid。
1.2 实验方法
1.2.1 粗提物的制备
称取70℃干燥2 h的香水莲花2.74 kg,用75%乙醇浸泡过夜,加热回流提取2次,1 h/次,提取液合并浓缩至无醇味,加入少量的水,离心后得到3个不同部分:上层为橙黄色油状物;中间层为橙红色水溶液;底层为黄色沉淀物,薄层层析检测表明底层黄色沉淀物以黄酮类物质为主,用乙酸乙酯回流提取3次,回收乙酸乙酯,干物质重40 g,作为硅胶柱分离用样品。
1.2.2 硅胶柱层析分离
称取160~200目柱层析用硅胶2000 g,干法装柱(Ф7.8cm ×75cm)。将1.2.1 中得到的样品以适量醋酸乙酯溶解,硅胶拌样上柱。以石油醚-乙酸乙酯梯度洗脱,每500 mL为一流分,经薄层层析检测后合并相同流分,108-112流分经鉴别主要为黄酮类化合物,作为高速逆流分离用样品。
1.2.3 两相溶剂系统的选择
对不同配比的正己烷-乙酸乙酯-甲醇-水组成的溶剂系统进行试管实验,通过分层时间和上下相体积比粗筛溶剂系统,选取其中的5种配比,用HPLC法分析,计算目标化合物 C的分配系数K[11-12]。
分别按照 1∶1∶1∶1、1∶1∶2∶1、1∶2∶1.5∶1、1∶1.2∶1.5∶1、1∶1.2∶2∶1这 5 种体积比配制各溶剂系统。分别取相同体积的上相与下相置于试管中,加入一定量的样品,剧烈振摇使样品充分溶解,静置分层。达到分配平衡后,分别取上相和下相各1.0 mL,挥干溶剂后用等量的甲醇溶解,经HPLC分析得到目标化合物C在上相中的峰面积(AU)与下相中的峰面积(AL),按照公式K=AU/AL计算得到目标化合物C的分配系数。
1.2.4 HSCCC分离用溶剂体系和样品溶液的配制
用分液漏斗中配制正己烷-乙酸乙酯-甲醇-水(体积比为1∶1.2∶2∶1)两相溶剂体系,充分振摇后静置分层。将上相和下相溶液分离后,超声脱气20 min,备用,上相为固定相,下相为流动相。
准确称取在1.2.2中分离得到的300 mg样品,溶解于20 mL流动相(下相溶液),过滤后备用。
1.2.5 HSCCC 分离纯化方法
将已脱气的固定相(上相)以10 mL/min的速度泵入HSCCC分离管,待固定相充满整个分离管后,开启循环水浴并将温度设定为25℃。开启主机电源,调节主机转速为830 r/min,正向旋转,以2 mL/min的流速泵入流动相(下相),待流动相从柱出口流出、且固定相不再流出,表明上下相在分离管中达到平衡后,基线稳定后,由进样阀注入20 mL样品溶液进行分离,检测波长为280 nm,记录色谱图,根据色谱图手动收集各峰组分,HPLC检测其纯度。分离结束后,停止转动主机,用无水乙醇将分离管吹洗干净。
1.2.6 HPLC分析条件及结构鉴定
HPLC色谱条件:Eclipse XDB-C18分离柱(4.6 mm ×150 mm,5 μm);流动相为甲醇∶1.0%磷酸 =50∶50,流速为 1.0 mL/min;柱温为 25 ℃,DAD检测器,检测范围190~400 nm;进样量10 μL。
HSCCC分离得到的组分的结构根据质谱、核磁共振氢谱(1H-NMR)和核磁共振碳谱(13C-NMR)的数据进行鉴定。
2 结果与讨论
2.1 HSCCC溶剂系统的优化选择
溶剂系统是决定HSCCC分离样品效果的最关键因素。不同的溶剂系统由于黏度、极性和密度等性质的差异,对相同的成分会产生不同的溶解、分配能力,因而形成分配系数的差异。根据色谱理论,利用HSCCC分离样品的必要条件是目标物能稳定的溶于两相溶剂;目标物在两相中具有合适的分配系数,必须在0.5和2之间。若K远小于1,样品会很快随流动相流出,达不到分离效果;若K远大于1,样品的出峰时间会延长,形成宽峰。本研究根据香水莲花提取物的目标化合物C在不同组成比例的正己烷-乙酸乙酯-甲醇-水溶剂系统中的分配系数,从中优选出具有合适分配系数的溶剂体系,结果见表1。

表1 化合物C在不同比例的溶剂体系中的分配系数(K)
由表1可见,在溶剂体系1、3、4条件下,化合物C的分配系数偏大,在固定相中的保留时间过长,不适合分离,而在2的条件下,化合物C易和不被保留的杂质几乎同时流出而没有达到很好的分离,在溶剂体系5中,化合物C的分配系数接近1,而且所需分离时间较短,5是较为适宜的HSCCC分离溶剂体系。
2.2 HSCCC检测波长的选择
化合物C的HPLC-DAD检测图谱(见图1)可知,由220~230 nm、280~300 nm 2个较强的的吸收带组成,320~340nm处的吸收带为肩峰。虽然色谱峰在225 nm吸收强度大,但由于样品中的其他化合物及流动相(乙酸乙酯、甲醇等)在210~230 nm下均有较强的吸收,在HSCCC分离中这种溶剂吸收带来的基线背景吸收值过高,且影响基线的平稳。因此,综合考虑选择HSCCC分离的检测波长为280 nm。
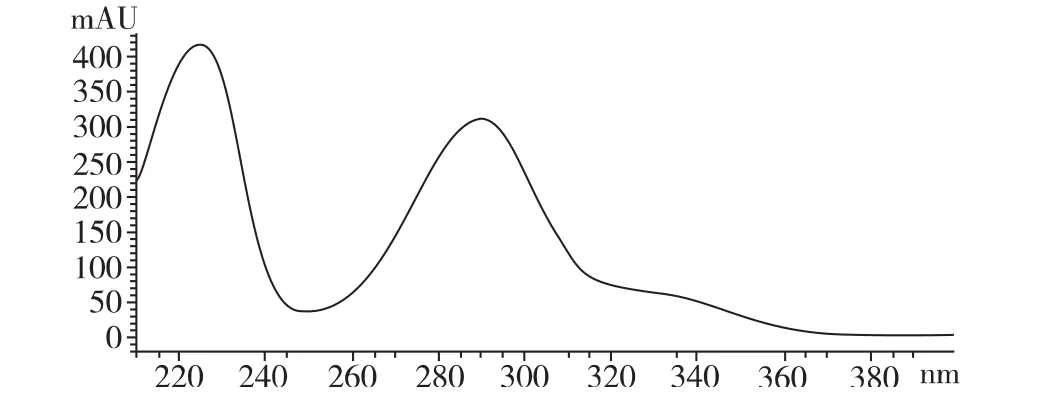
图1 化合物C的HPLC-DAD检测图谱
2.3 HSCCC分离纯化结果
采用1.2.5 节的条件对 1.2.2中得到的108-112流分进行分离纯化,分离时间为1.5h,固定相保留率为80%。根据HSCCC图谱手动收集得到3个组分(见图2),经检测发现其中A、B二峰均为杂质峰,C峰较纯。将其收集,浓缩干燥,质量为80 mg。
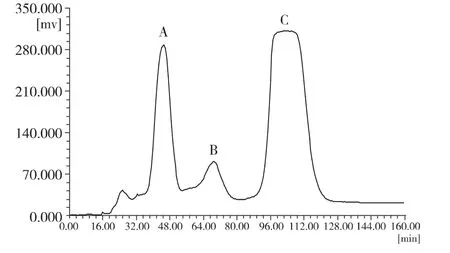
图2 香水莲花底层黄色物质硅胶柱分离108-112流分的HSCCC分离图
2.4 化合物C高效液相色谱检测纯度
采用1.2.6节的条件,对2.3中的分离产物C峰进行HPLC分析,结果见图3。使用面积归一法测定所得组分的纯度为98.6%。

图3 HSCCC分离所得化合物C的HPLC的色谱图(290nm)
2.5 化合物C的结构鉴定
化合物C:白色粉末,分子式C15H12O5,FABMS m/z:272[M]+,1H- NMR(500 MHz,Acetone-d6)δ:12.18(1H,s,5- OH),9.51(1H,s,4'- OH),8.47(1H,s,7- OH),7.41(2H,d,J=8.5 Hz,H-2',6'),6.91(2H,d,J=8.5 Hz,H- 3',5'),5.97(1H,d,J=2.1 Hz,H- 6),5.96(1H,d,J=2.1Hz,H-8),5.47(1H,dd,J=12.8 Hz,2.9Hz,H-2),3.19(1H,dd,J=12.8Hz,17.1Hz,H-3a),2.75(1H,dd,J=17.1 Hz,2.9Hz,H- 3b)。13C- NMR(500 MHz,Acetone- d6)δ:80.0(C- 2),43.6(C- 3),197.3(C-4),165.4(C-5),96.9(C-6),167.4(C-7),95.9(C-8),164.5(C-9),130.9(C-1'),129.1(C-2'),116.2(C-3'),158.8(C-4'),116.2(C-5'),129.1(C-6')。从 NMR 可以看出化合物C为黄酮类化合物,1H-NMR显示B环为4'一羟基取代(δ 6.91,3',5'- H;7.41,2',6'- H),另外A环还含有2个酚羟基取代。根据H-2和H-3的化学位移及偶合常数,确定C-2为S构型,提示此化合物为二氢黄酮。其NMR数据与文献[13-15]报道的(2s)一柚皮素数据基本一致,故化合物鉴定为(2s)一柚皮素(naringenin)。
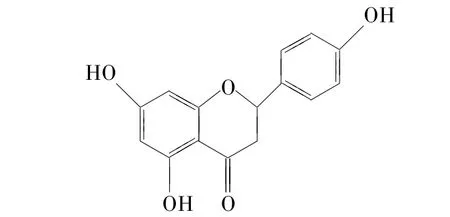
图4 柚皮素的结构式
3 结论
本研究将HSCCC应用到香水莲花黄烷酮类化合物的分离制备,采用正己烷-乙酸乙酯-甲醇-水(1∶1.2∶2∶1,V/V/V/V)四元溶剂系统,香水莲花粗提物硅胶柱分离流分经进一步HSCCC分离纯化,结合薄层层析(TLC)和HPLC-DAD光谱,结果表明:分离得到的化合物C为黄烷酮类化合物,并根据MS分析及1H-NMR、13C-NMR谱图分析结果鉴定为(2s)一柚皮素。所建立的HSCCC分离方法可用于快速、高效、低成本地分离制备香水莲花中柚皮素对照品,可为该成分的药理活性与作用机制研究以及香水莲花相关产品的质量控制方法的完善提供必要的物质基础。
[1]陈培栋.‘九品香水莲花’问世[J].中国花卉园艺,2003(24):38-39.
[2]黄家祥.四季开花-香水莲[J].北方园艺,2005(3):44-45.
[3]唐裕芳.荷叶研究现状与展望[J].食品研究与开发,2004,25(4):14-16.
[4]张卫明,姜洪芳,徐辉,等.香水莲花降血脂作用的实验研究[J].食品工业科技,2009(2):111-112.
[5]任红荣,张卫明,姜洪芳,等.香水莲花醇提物抗氧化活性的研究[J].食品科技,2010(3):200-203.
[6]徐辉.香水莲花的化学成分及活性功能研究[D].南京:南京农业大学,2008:6.
[7]姜洪芳,金敬红,张卫明,等.香水莲花总提取物对小鼠急性酒精肝损伤的实验研究[C]∥江苏省植物学会2012年学术年会论文集.南京:东南大学出版社,2012:104-105.
[8]邸多隆,郑媛媛,陈小芬,等.高速逆流色谱技术分离纯化天然产物中黄酮类化合物的研究进展[J].分析化学,2011,39(2):269-275.
[9]曹学丽.高速逆流分离色谱与应用[M].北京:化学工业出版社,2005:8-273.
[10]Peng Jinyong ,Fan Guorong,Wu Yutian ,et a1.Preparative isolation and separation of a novel and two known f lavonoids f rom Patrinia villosa Juss by high speed counter-cu r rent chromatography[J].Journal of Chromatography A,2005,1092:235-240.
[11]宫静静,谢静,沈平孃,等.高速逆流色谱技术在中药及天然产物领域中的应用[J].中国现代中药,2007,9(1):1-4.
[12]彭爱一,曲学伟,李慧,等.高速逆流色谱分离纯化九里香中的黄酮类化合物[J].色谱,2010,28(4):383-388.
[13]穆丽华,张东明.紫荆的化学成分研究[J].中国中药杂志,2006,31:1795-1797.
[14]Prescott G A,Stanford P J,Whaleler G,et al.Invitro properties 0f a recombinant flavonol synthase from Arubidoposis thaliana[J].Phytochem,2002,60:589-593.
[15]胡慧,吴意轩,何祥久.牛奶菜中黄酮类成分的研究[J].天然产物研究与开发,2011,23(6):1045-1048.

