马衔山黄芪水提物抗肿瘤转移及生长初步研究*
杜文静,魏育才,董信芳,崔芬芬,沈世林
(兰州大学第一临床医学院,甘肃兰州 730000)
近年来,随着肿瘤发病率的逐年上升,由于肿瘤的转移及其产生的效应严重影响了患者的生存。黄芪及其制剂的抗肿瘤作用,受到医学界广泛关注。研究显示黄芪辅助化疗可抑制肿瘤生长,减少毒副反应,并可提高机体免疫功能,改善肿瘤患者的生活质量[1]。为了合理使用有限药用植物资源,了解马衔山黄芪抗肿瘤转移效果及其作用机理,本实验就马衔山黄芪水体取物抗肿瘤转移与生长进行了观察研究。
1 材料
1.1 瘤株与动物
H22肝癌细胞株,由兰州大学药理学研究所提供。清洁级昆明种雄性小鼠60只,体重(20±2)g,由兰州大学实验动物中心提供,合格证号:14-005。
1.2 黄芪水提物制备
黄芪200 g购于兰州市,经鉴定为马衔山黄芪(Astragalus mahoschanicus Hand.-Mazz.)。按传统方法水煎煮3次,合并3次滤液后加热浓缩制成含生药量为1 g·mL-1的黄芪水煎液。
1.3 试剂
环磷酰胺(CTX),每支 0.2 g,批号 20100905,山西普德药业有限公司生产。其它试剂均为国产分析纯。
2 方法
2.1 造模、分组及给药
取传代6 d后的H22肝癌小鼠无菌抽取腹水,台盼蓝染色计数肿瘤细胞存活率≥95%,调整细胞浓度为1×107个mL-1。小鼠60只,每只自尾静脉注射H22细胞悬液0.2 mL,建立H22肝癌血道转移模型。随机分为6组,分别为NS组、CTX组、马衔山黄芪低、中、高剂量组以及马衔山黄芪合并CTX组(简称合并组)。
以正品黄芪15 g的临床用量作为参照中剂量,按人与小鼠药物换算方法计算出小鼠等效剂量。依次为马衔山黄芪低剂量 0.46 g·kg-1、中剂量2.08 g·kg-1、高剂量为 6.23 g·kg-1[2]。造模 1 d后,马衔山黄芪组每天给予水体取物灌胃,NS组每天给予生理盐水0.2 mL·10g-1灌胃,CTX组每天给予CTX 20 mg·kg-1腹腔注射,马衔山黄芪合并CTX组每天给予马衔山黄芪水煎液2.08 g·kg-1灌胃以及CTX 20 mg·kg-1腹腔注射。以上均每天1次,共 20 d。
2.2 检测指标
2.2.1 一般状况观察及体重变化
每天观察并记录小鼠精神状态、皮毛光滑度及活动情况等,定期测量体重,比较实验前后体重变化。
2.2.2 巨噬细胞吞噬功能测定
治疗结束次日,小鼠腹腔注射2%无菌淀粉溶液1 mL,24 h后再次注射2%无菌淀粉溶液1 mL。1 h后腹腔注射10%鸡红细胞悬液1 mL,30 min后处死小鼠取腹腔液涂片。自然晾干甲醇固定1 min后,瑞氏染液染色1 min后用蒸馏水冲洗、晾干。油镜下计数100个巨噬细胞,计算吞噬率和吞噬指数。
吞噬率=吞噬鸡红细胞的巨噬细胞数/计数的巨噬细胞总数×100%
吞噬指数=巨噬细胞吞噬鸡红细胞总数/计数的巨噬细胞总数×100%
2.2.3 脾脏指数和胸腺指数测定
取脾脏和胸腺分别称重,计算脾脏指数和胸腺指数。脾脏指数=脾重/体重,胸腺指数=胸腺重/体重。
2.2.4 肺转移瘤生长情况及病理组织学观察
摘取小鼠肺脏,称重;Bouin氏液固定24 h后用无水乙醇漂洗至黄色褪去,以单盲法计数肺表面转移瘤结节数,计算肺结节抑制率、肺转移瘤生长指数以及生长抑制率。
肺结节抑制率=(1-给药组结节数/造模组结节数)×100%
肺转移瘤生长指数=载瘤肺重/体重
生长抑制率=(1-给药组转移瘤生长指数/造模组肺转移瘤生长指数)×100%
另取部分标本,4%甲醛固定,石蜡包埋切片,HE染色后光镜观察。
2.2.5 统计分析
3 结果
3.1 小鼠一般状况观察及体重变化
实验后期,马衔山黄芪各组小鼠皮毛光滑度以及活动情况好于CTX组和NS组,表现为毛发润泽、善于活动、反应灵敏。实验后,各组小鼠体重均有所增加,NS组、合并组、马衔山黄芪各组增加较为明显。马衔山黄芪各组与CTX组比较,体重增加较为明显(P <0.01)。结果见表1。
表1 马衔山黄芪对转移性肝癌(H22)小鼠体重影响()

表1 马衔山黄芪对转移性肝癌(H22)小鼠体重影响()
注:与NS组比较aP <0.05、bP <0.01,与CTX 组比较cP <0.05、dP <0.01
组别 n 1 d(g) 21 d(g) 体重增幅(g)9 19.56 ±1.08 26.90 ±0.83 7.34 ±0.48 CTX 组 10 20.23 ±0.81 20.45 ±0.73 0.22 ±0.62b合并组 10 19.60 ±0.94 25.16 ±0.52 5.20 ±1.27bd NS组马衔山黄芪低剂量 10 20.28 ±0.92 26.54 ±0.94 6.26 ±0.78bd 10 20.39 ±0.82 25.95 ±0.94 5.56 ±0.81bd马衔山黄芪中剂量 10 20.20 ±0.83 25.99 ±1.40 5.79 ±1.27bd马衔山黄芪高剂量
3.2 对小鼠胸腺和脾脏质量及指数影响
马衔山黄芪各组胸腺重量及指数较CTX组明显增加(P<0.05或 P<0.01),CTX 组较 NS组有所下降(P<0.01)。马衔山黄芪高剂量组的脾脏重量高于CTX组和NS组(P<0.01),马衔山黄芪各组的脾脏指数明显高于CTX组和NS组(P<0.05或P<0.01)。结果见表2。
表2 马衔山黄芪对转移性肝癌(H22)小鼠胸腺和脾脏质量及指数影响()

表2 马衔山黄芪对转移性肝癌(H22)小鼠胸腺和脾脏质量及指数影响()
注:与 NS组比较aP <0.05、bP <0.01,与 CTX 组比较cP <0.05、dP <0.01
组别 n脾脏重量(g) 指数(mg·g-1) 重量(g) 指数(mg·g-1胸腺)0.09 ±0.01 3.20 ±0.25 0.13 ±0.02 4.28 ±0.63 CTX 组 10 0.06 ±0.01b 2.82 ±0.72 0.11 ±0.02 4.17 ±0.92合并组 10 0.06 ±0.01b 2.23 ±0.32bc 0.11 ±0.01a 4.36 ±0.43马衔山黄芪低剂量 10 0.09 ±0.01d 3.34 ±0.30c 0.13 ±0.04 5.51 ±0.36ac马衔山黄芪中剂量 10 0.09 ±0.01d 3.39 ±0.46c 0.13 ±0.02c 5.57 ±0.68bd马衔山黄芪高剂量 10 0.10 ±0.02d 3.79 ±0.39c 0.16 ±0.02bd 6.62 ±1.01 NS组9 bd
3.3 对小鼠巨噬细胞吞噬功能影响
马衔山黄芪各组巨噬细胞吞噬率和吞噬指数均明显高于NS组和CTX组(P<0.01),CTX组吞噬指数低于NS组(P<0.05)。结果见表3。
3.4 对肺内肿瘤转移灶抑制及生长影响
马衔山黄芪各组、CTX组和合并组的肺重量、瘤结节数,生长指数均低于NS组(P<0.05或P<0.01)。与CTX组比较,马衔山黄芪组与合并组的肺重量升高(P<0.05或P<0.01),马衔山黄芪中、高剂量组和合并组肺内瘤结节数明显减少(P<0.01)。结果见表4。
表3 马衔山黄芪对转移性肝癌(H22)小鼠巨噬细胞吞噬功能影响()
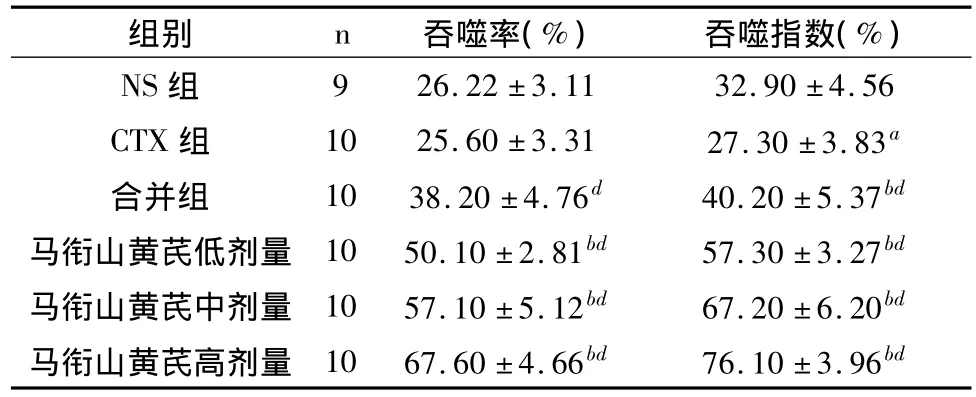
表3 马衔山黄芪对转移性肝癌(H22)小鼠巨噬细胞吞噬功能影响()
注:与NS组比较aP <0.05、bP <0.01,与CTX 组比较cP <0.05、dP <0.01
组别 n 吞噬率(%) 吞噬指数(%)9 26.22 ±3.11 32.90 ±4.56 CTX 组 10 25.60 ±3.31 27.30 ±3.83a合并组 10 38.20 ±4.76d 40.20 ±5.37bd马衔山黄芪低剂量 10 50.10 ±2.81bd 57.30 ±3.27bd马衔山黄芪中剂量 10 57.10 ±5.12bd 67.20 ±6.20bd马衔山黄芪高剂量 10 67.60 ±4.66bd 76.10 ±3.96 NS组bd
表4 马衔山黄芪对小鼠肝癌(H22)转移瘤抑制及生长影响()

表4 马衔山黄芪对小鼠肝癌(H22)转移瘤抑制及生长影响()
注:与 NS组比较aP <0.05、bP <0.01,与 CTX 组比较cP <0.05、dP <0.01
组别 n 肺重量(g)瘤结节 肺转移瘤结节数(个) 抑制率(%) 生长指数-1×103 生长抑制率(%)NS组17.289 0.24 ±0.02 26.22 ±4.35 - 8.94 ±0.52 -CTX 组 10 0.15 ±0.04b 13.10 ±3.84b 50.04 7.56 ±1.90a 15.16合并组 10 0.19 ±0.01bc 4.40 ±3.60bbd 83.22 7.58 ±0.30b 15.28马衔山黄芪低剂量 10 0.21 ±0.02bd 9.80 ±4.52b 62.63 8.06 ±0.75b 9.91马衔山黄芪中剂量 10 0.20 ±0.02bd 7.50 ±1.58bd 71.40 7.62 ±0.82b 14.79马衔山黄芪高剂量 10 0.19 ±0.01bc 8.60 ±2.63bd 67.20 7.40 ±0.54b
3.5 肺转移瘤病理组织学观察
病理切片镜下观察显示,马衔山黄芪组,CTX组以及合并组的肺转移程度均低于NS组。NS组肺内广泛分布的肿瘤转移灶,肿瘤细胞病理性核分裂相及异型性较明显。马衔山黄芪中、高剂量组、CTX组以及合并组的肺组织较为完整,肺内转移灶较少,病理性核分裂象少见。马衔山黄芪组与CTX组比较无明显差异。见附图。
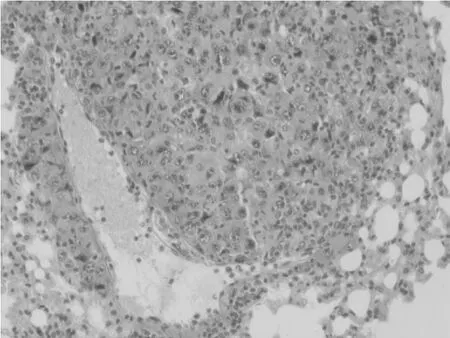
图1 N.S组 肿瘤细胞弥漫全视野,几乎浸润肺组织,瘤细胞核体积异常增大,核浆比接近1∶1,出现双核甚至多核,病理性核分裂象较多,异型性特别明显。(×200)

图2 CTX组 视野内肿瘤组织较少,残存肺组织较多,瘤细胞异型性较小。(×200)

图3 合并组 视野内肿瘤组织较少,残存肺组织较多,瘤细胞异型性较小。(×200)
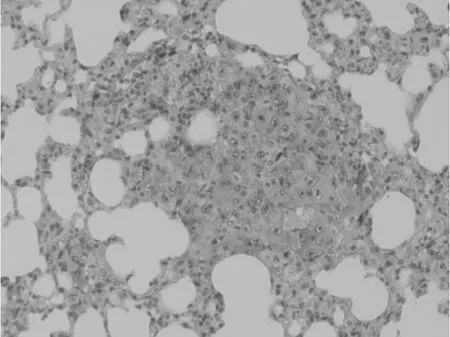
图4 THPS低剂量组 肿瘤细胞异型性不是特别明显,并可见免疫细胞浸润。(×200)

图5 THPS中剂量组 有较完整肺组织,肿瘤细胞大小较一致,病理性核分裂象少见,肿瘤细胞异型性不明显,视野内只能见极少量肿瘤血管。(×100)

图6 THPS高剂量组 有较完整肺组织,肿瘤细胞少,呈散在分布,肺组织,肿瘤细胞少,呈散在分布,象少见,肿瘤细胞异型性小,视野下无肿瘤血管。(×200)
4 讨论
黄芪(Radix Astragali)始载于《神农本草经》,性温味甘,具有补气固表、利尿托毒、敛疮生肌、益气补中等功效。现代研究发现[3-4]黄芪能抗炎、抗氧化和增强免疫功能,具有抗肿瘤作用。正品黄芪来源于豆科黄芪属蒙古黄芪(Astragalus membranaceus(Fisch)Bge.var.mongholicus(Bge.)Hsiao)和膜荚黄芪(Astragalus membranaceus(Fisch.)Bge.)的干燥根,由此2种植物所产的黄芪为甘肃产五大宗药材之一,也是我国道地药材黄芪的主要来源。黄芪属植物在甘肃有13种1变种,在民间均有广泛地用药基础。马衔山黄芪(A.mahoschanicus Hand.-Mazz.)[5]主要分布在甘肃马衔山周围地区,当地作为黄芪的代用品。近年来由于黄芪野生资源过度采挖和种植方面存在的一系列问题,因此扩大药源和促使资源合理使用很有必要。
肿瘤转移是肿瘤细胞从原发灶脱落后,经血道运行并逃避免疫系统攻击,到继发部位组织粘附,形成克隆并增生生长[6]。肿瘤的免疫逃逸生物学特性决定了肿瘤的复发和转移,是患者死亡的主要原因[7]。“正气存内,邪不可干”,“邪之所凑,其气必虚”,肿瘤的转移发病机制在中医认为是由于正气不足,正不胜邪而邪气侵犯、走串的结果,现代研究证实[8]补气中药有较好的抗肿瘤作用。本实验在建立小鼠肝癌(H22)细胞血道转移模型基础上,采用不同剂量的马衔山黄芪水提物以及合并CTX进行干预,观察其抑制肿瘤转移及其生长状况。结果显示马衔山黄芪可使小鼠体重增加、促进发育,胸腺、脾脏质量升高,巨噬细胞吞噬功能增强,可见能明显提高机体的免疫功能。马衔山黄芪各组的肺重下降,肺表面瘤结节数明显减少,证实有抑制肿瘤转移和瘤体生长作用;其中合并组抑制肿瘤生长的能力较CTX组明显,尤以马衔山黄芪中剂量组抑瘤效果最佳。本实验证实马衔山黄芪具有良好的抗肿瘤转移及其抑制肿瘤生长的作用,为其研究和开发奠定了基础。因此有必要深入研究其有效成分和抗肿瘤机理,或许能为当地农村经济发展提供一定的支持。
[1]李文建,宋佳佳,王润田.中药黄芪抗肿瘤研究进展[J].按摩与康复医学,2010,01(11):44.
[2]方永顺.人参配伍黄芪对放射损伤小鼠免疫功能调节作用的实验研究[D].沈阳:辽宁中医学院,2003:1-15.
[3]杨雁,陈敏珠.黄芪总苷对肝癌细胞凋亡及wtp53基因表达的影响[J].中国药理学通报,2001,17(4):447-451.
[4]Cho W C,Leung K N.In vitro and in vivo anti—tumor effects of Astragalus membraneceus[J].Cancer Lett,2007,252(1):43.
[5]中国科学院中国植物志编辑委员会.中国植物志:第42卷第1分册[M].北京:科学出版社,1993:124-169.
[6]高萍,张俊杰.肿瘤转移机制的研究进展[J].国际外科学杂志,2011,38(1):40-43.
[7]曹雪涛.肿瘤生长与转移中的免疫学问题[J].中国肿瘤生物治疗杂志,2011,14(1):2-6.
[8]张永军,包素珍.十全大补汤抗肿瘤转移的作用机制[J].中医药学刊,2006,24(6):927-928.

