DNA识别受体在天然免疫反应中的作用
何小兵,房永祥,贾怀杰,陈国华,曾 爽,景志忠
(中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室农业部兽医公共卫生重点实验室,甘肃兰州 730046)
近年来,随着人们对哺乳动物模式识别受体(Pattern recognition receptors,PRRs)的发现和研究的不断深入,PRRs对病原,尤其是对病原生命物质基础——DNA和RNA的识别成为天然免疫学研究的热点和重点领域[1]。PRRs主要包括 Toll样受体(TLRs)家族、RIG-I样受体(RLRs)家族和蛋白激酶 R(RNA-ativated protein kinase R,PKR)、NOD样受体(NLRs)家族、C型凝集素受体(CLRs)家族、天然免疫特异性PRRs以及最近发现的DNA依赖的干扰素调节因子受体(DAI)家族、黑色素瘤缺乏因子2(AIM2)样受体(ALRs)家族和RNA聚合酶 Ⅲ(RNA PolⅢ)等PRRs[2-3]。这几类PRRs通过识别病原生存必不可少的特异性保守成分和机体应激或损伤时释放的结构成分,即病原/危险相关分子模式(PAMPs/DAMPs),诱导Ⅰ型干扰素(Ⅰ-IFNs)、炎性细胞因子、趋化因子和共刺激分子等的释放和表达发挥天然免疫防御功能,同时诱导获得性免疫的建立。
TLRs家族中的TLR3、7、8, NLRs家族中的NOD2(Nucleotide binding oligomerization domain 2)、NALP1(NACHT leucine rich repeat protein 1),RLRs家族中的维甲酸诱导基因 I(RIG-I)、黑色素瘤分化相关基因 5(MDA5)、遗传学和生理学实验室 2(LGP2)、PKR等通过识别病原RNA发挥天然抗病毒免疫反应作用;而TLRs家族中的TLR9,NLRs家族中的NALP3(NACHT leucine rich repeat protein 3),ALRs家族中的 AIM2和 IFI16,以及DAI和RNA PolⅢ等通过识别病原DNA,活化信号转导通路,激活天然免疫系统发挥天然免疫防御作用[4-6]。根据对病原核酸识别的差异,将其分别命名为RNA识别受体和DNA识别受体;根据DNA识别受体定位的不同,将其分别命名为胞膜DNA识别受体和胞质DNA识别受体。由于近两年DNA识别受体的研究有新的突破(表1、2),因此本文重点介绍DNA识别受体及其介导的天然免疫反应最新研究进展,以期为抗感染免疫研究、药物和疫苗的研发与设计以及抗病育种等提供参考与借鉴。

表1 DNA识别受体及其配体
1 胞膜DNA模识别受体
TLR9是TLRs家族中的重要成员之一,也是唯一识别DNA的胞膜识别受体。TLR9主要表达于浆样DCs(pDCs)和B细胞等细胞器膜(如细胞内体、溶酶体或内质网膜)。在静息状态下,TLR9定位于免疫细胞内质网,当相应配体刺激后,TLR9则从内质网转位到内体-溶酶体。TLR9的这种转位需要内质网蛋白UNC93B1和高尔基体(Golgi)参与,负责转运到内体区室内,通过髓样分化因子 88(MyD88),活化丝裂原活化的蛋白激酶(MAPKs)、核转录因子(NF-κB,NF-κB)和干扰素调节因子 7(IRF7),诱导Ⅰ-IFNs和炎性细胞因子等的释放[7-8]。TLR9属于Ⅰ型跨膜蛋白受体,由胞外区、跨膜区和胞内区组成,胞外区为病原结合结构域(ECD),由富含亮氨酸的重复序列区(LRRs)和半胱氨酸形成了一个高度保守的马蹄形的空间结构,与PAMPs/DAMPs的识别和结合有关;跨膜区是富含半胱氨酸的区域,与TLR9的亚细胞定位有关;胞内区为TIR(Toll/IL-1 receptor domain,TIR)结构域,其与白介素-1受体(IL-1R)家族的胞内区高度同源,称为TIR(Toll/IL-1R)结构域,与下游的信号传导有关[1-3]。

表2 DNA识别受体识别的病原
1.1 TLR9对病原细菌DNA的识别 细菌DNA中含有一些具有免疫刺激活性的短核苷酸序列,其结构特征是以非甲基化的胞嘧啶和鸟嘌呤二核苷酸(CpG)为核心的CpG重复基序。细菌DNA非甲基化的CpG重复基序出现的频率约为1/16;而在脊椎动物基因组以甲基化形式存在的频率则很低。因此,脊椎动物的免疫系统正是通过识别细菌的CpG DNA来发挥抗感染免疫防御用。
2000年,日本研究人员发现,TLR9识别细菌的CpG DNA。他们以裸露的CpG DNA为基础制备的疫苗,能刺激机体获得性免疫系统产生针对该疫苗的免疫反应[9]。这表明由于细菌DNA中存在非甲基化CpG DNA才具有免疫刺激活性,也进一步证明了两大免疫系统间的联系。TLR9主要表达于pDCs和B细胞的内体区室内,因此细菌DNA必须被运送到细胞的内体区室内,内体区室内的酸性环境(pH=5.5~6.5)导致双股DNA降解成多个含有CpG基序的单股DNA后被TLR9识别,从而发挥免疫防御作用。内体区室内的酸性环境能被氯喹或氯喹类似物所破坏。这表明TLR9在监测和识别非甲基化的CpG DNA中起关键作用,也证明TLR9可能主要通过这种区室化来区分自我和非我,从而避免发生自身免疫性疾病(表 1、2,图 1)[1-6,10]。
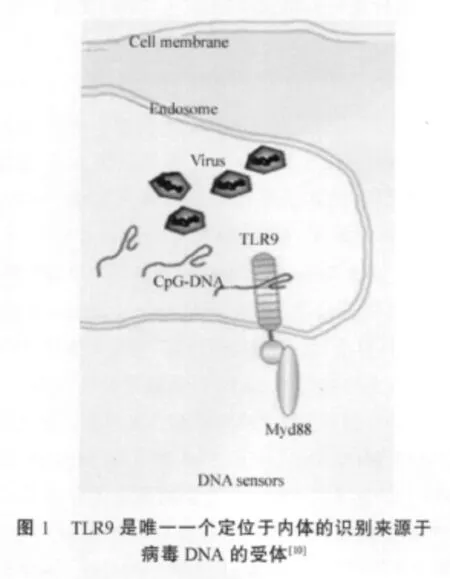
卡介苗中的CpG DNA具有抗肿瘤活性,能诱导人PBMCs产生大量的 IFN-α、IFN-β 和IFN-γ;还发现,用CpG DNA刺激TLR9-/-小鼠时,B细胞增殖、巨噬细胞分泌的炎性细胞因子和DCs的成熟等细胞反应均消失。CpG DNA能活化野生型小鼠免疫细胞的NF-кB、JNK和IRAK等信号分子,而在TLR9-/-小鼠免疫细胞的中其信号分子的活化显著降低[10]。因此,TLR9-/-小鼠对CpG DNA诱导的致死性休克综合症有抵抗力。研究显示,灭活的流产布鲁氏菌(HKBA)以依赖于TLR9-MyD88的方式刺激小鼠的DC分泌IL-12、IFNs等Th1型细胞因子,发挥抗细菌感染的保护作用,同时也增强了HKBA疫苗的免疫效应。Macedo等发现用HKBA刺激TLR9-/-小鼠来源的DC时,IL-12p40分泌减少[11];同时TLR9-/-小鼠对布鲁氏菌更易感。这表明HKBA是依赖于TLR9-MyD88介导IL-12p40的分泌。BHan等经小鼠气管给予嗜肺军团菌,TLR9-/-小鼠的死亡率显著增加,其肺脏菌落形成单位比野生型小鼠高达10倍左右,这表明机体通过TLR9来增强对胞内嗜肺军团菌的抗菌免疫作用是一种有效途径[12]。由此可见,TLR9在不同细菌感染的情况下所扮演的不同角色反映了其功能的复杂性。
1.2 TLR9对病毒DNA的识别 CpG DNA基序首先在细菌DNA中发现,后来发现单纯疱疹病毒(HSV)、细胞巨化病毒(CMV)、腺病毒(AV)、人乳头状瘤病毒(HPV)和杆状病毒等多种DNA病毒基因组也富含CpG DNA基序,它们通过依赖于TLR9-MyD88的方式诱导pDCs分泌大量的Ⅰ-IFNs和炎性细胞因子(表1、2,图 1)。其中HSV-1和HSV-2的CpG DNA基序特异性诱导pDCs释放IFN-α,说明pDCs是介导TLR9依赖性应答的关键细胞。
研究发现,纯化的HSV-2 DNA能刺激来源于野生型小鼠的pDC产生IFN-α,抑制性CpG ODN能导致HSV-2诱导的 IFN-α分泌减少,而HSV-2 DNA未诱导TLR9-/-小鼠分泌IFN-α,TLR9-/-小鼠比野生型小鼠具有较高的病毒滴度和死亡率,同时TLR9通过内体识别HSV-2的效应能被氯喹和Bafilomycin A1所抑制[13]。这显示TLR9在抗DNA病毒的免疫应答中具有重要作用。pDCs对HSV-2的识别并不需要HSV-2的复制,活的还是紫外线或加热灭活的HSV-2均能诱导pDCs分泌Ⅰ-IFNs,不能诱导巨噬细胞分泌Ⅰ-IFNs,但能诱导TNF-α分泌,而MyD88-/-和TLR9-/-小鼠能够抵御和抑制HSV-1的感染与复制[14]。这可能是TNF-α的释放是依赖于TLR9-MyD88信号转导通路的,而Ⅰ-IFNs的释放是不依赖于TLR9-MyD88信号转导通路的。CpG ODN能被局部粘膜的APCs递呈给生殖道的免疫细胞,诱导生殖道上皮细胞快速增生和上皮增厚以及炎性细胞的大量募集,使小鼠对HSV-2引起的致命性阴道感染具有抵抗力;同时用CpG ODN局部处理也能抑制HSV-2复制,但对HSV-2侵入生殖道粘膜无影响;同时,用CpG ODN处理过的Sup-/-小鼠也不受致死剂量HSV-2的感染[15]。证明CpG ODN的抗病毒活性是由TLR9所介导。
1.3 TLR9对DNA合成类似物的识别 在合成的含有CpG基序的ODN中,至少有3类具有不同结构的CpG ODN能被免疫细胞,尤其是pDCs和B细胞的TLR9所识别。以硫代磷酸为骨架(Ps)的富含多重CpG基序的CpG ODN,即B/K型ODN,能刺激B细胞和单核细胞的增殖、DC的成熟、适度诱导pDC分泌IFN-α以及炎性细胞因子如IL-12、IL-10、IL-6、TNF-α的分泌和CD80、CD86和MHCⅡ的上调[16]。相反,A/D型ODN含有磷酸二酯骨架(Po),并且含一个以自身互补碱基侧翼形成茎环结构,在3'端和5'端含有一个硫代修饰的poly G尾,能诱导pDC产生大量的IFN-α以及适度的IL-12,而诱导B细胞活化的能力较弱;而产生的IFN-α又诱导单核细胞发育成熟为有功能活性的DCs,并且 DCs分泌IP-10(IFN-inducible protein-10)和 IL-15刺激NK细胞和γδ型T细胞分泌 IFN-γ,形成了一个Th1型免疫应答环境[16]。C型ODN含有一个Po和Ps混合结构,既能诱导IFN-α的产生,又能诱导B细胞的激活[17]。因此,C型ODN含有Ps和Po的混合骨架,能诱导IFN-α的产生和B细胞的激活。A/D型与B/K型ODN活性的差异,可以由其在细胞区室内的不同定位来解释。A/D型ODN优先保留在pDCs的早期内体中,与下游信号分子MyD88和IRF7形成一个复合物,强烈诱导IFN-α的分泌;B/K型ODN优先转位于成熟内体中,诱导炎性细胞因子的分泌;C型ODNs在细胞内的定位尚不清楚[18]。因此,TLR9的配体ODNs的序列特异性和限修饰可能对于激活机体的天然免疫反应是必不可少的。然而,最近有人认为糖骨架才是TLR9的基本配体,由于含有磷酸二酯的2'脱氧核糖寡聚体能结合并激活TLR9,即使3'端poly G的DNA序列中没有CpG基序也可以被TLR9识别的能力[19]。值得注意的是,最近报道几个抑制性的ODNs能抑制TLR7和/或TLR9的激活[20]。因此,可以应用激活剂或拮抗剂通过激活或抑制TLR9的活性来预防和治疗一系列的感染性疾病、癌症、变态反应和自身免疫性疾病。
1.4 TLR9对病原真菌和原虫DNA的识别 烟曲霉非甲基化的CpG DNA以TLR9依赖的方式刺激鼠骨髓来源的DCs(BMDCs)和人的DCs分泌炎性细胞因子如 TNF-α,这种现象可被甲基化酶抑制,但TLR9是如何与胞外烟曲霉DNA相互作用的,还有待进一步研究[21]。克氏锥虫富含CpG基序的基因组DNA可作为TLR9的配体,引发宿主抗锥虫的炎症反应[22];而TLR9识别疟原虫基因组中富含AT的DNA序列如5'-TATAATTTTTACCAACTAGC-3'[23]。有趣的是,除了DNA,恶性疟原虫的血红蛋白代谢产物疟原虫色素作为诱导物,能通过TLR9激活巨噬细胞和DCs分泌炎性细胞因子和表达趋化因子[24]。值得注意的是,有研究发现,疟原虫色素之所以能通过TLR9激活免疫细胞是因为其中含有DNA,疟原虫色素如同阳性脂质体作为载体运输DNA到内体[25]。用CpG ODN治疗利什曼原虫感染者,可明显减轻病损的严重程度,并且利什曼原虫是HIV感染者常见的继发感染病原[26]。研究还发现,TLR9可以识别自身DNA,在系统性红斑狼疮(SLE)等自身免疫病的发病中发挥重要作用(表1、2)[3]。
胞内蛋白酶对TLR9的剪切对于内体的DNA的识别、MyD88的募集和信号转导通路的使动至关重要。全长TLR9在内质网上合成后被内质网蛋白UNC93B1转运至Golgi,随后被Golgi的多种组织蛋白酶和天冬酰胺内肽酶(AEP)对其弯曲环的LRR14和LRR15剪接,形成了一个含有部分ECD、跨膜区和胞浆TIR区的剪切体,然后此剪接体通过Golgi普通分泌通道运至内体-溶酶体,并与MyD88结合后形成一个功能性信号复合体,这个功能性信号复合体直接识别DNA并激活信号转导通路[7-8,27]。尽管全长的和加工后的TLR9均能结合配体,然而只有后者才能进行下游信号的转导,这可能是TLR9防止识别自身核苷酸的一种策略,也证明剪接后的TLR9才具有完整的生物学功能。
2 胞质DNA识别受体
近年来,DNA识别受体颇受关注。通过对TLR9拮抗剂和TLR9-/-小鼠的一系列研究表明,除了TLR9可以识别CpG DNA外,机体内还存在大量非依赖于TLR9的胞质DNA识别受体。现已发现了DAI、ALRs、RNA PolⅢ和LRRFIP1等多个胞质DNA识别受体。
2.1 DAI对病毒DNA的识别 2007年,Taniguchi等研究发现胞质蛋白DLM-1或ZBP-1能感知胞质DNA并能够调节Ⅰ-IFNs的免疫应答,因此将其命名为 DAI(表1、2)。DAI分别由两个Z-DNA结构域(),即Za和Zb,DNA结构域3(D3)和信号传导结构域(SD)4个结构域组成,其中Za、Zb和D3结构域与DNA的结合有关;SD含有多个丝/苏氨酸磷酸化位点,与信号的转导过程有关[28]。
人工合成的 B-DNA如poly(dA∶dT)和IFN刺激 DNA(ISD)能上调小鼠胚胎成纤维细胞(MEFs)和L929细胞中DAI的表达,诱导Ⅰ-IFN的分泌。DAI通过与N端的DNA 结合区识别 poly(dA∶dT)、poly(dG∶dC)、细菌 DNA和哺乳动物的DNA,C端(SD)依赖于DNA招募TBK1(TANK2 binding kinase 1)和 IRF3,然后通过 TBK1和STING,活化IRF3,使其发生核转位,诱导I-IFNs的产生;同时SD也可以通过RHIM结构域与RIP1和RIP3形成复合物从而介导了 NF-κB的激活(图 2)[10,28]。有趣的是,接头分子TRIF/TICAM1和IPS/VISA/Cardif/MAVS(Interferon-βpromoter stimulator 1/Virus-induced signaling adapter/CARD adaptor inducing IFN-β/Mitochondrial antiviral signaling)也参与DAI的信号转导通路,然而它们在信号转导通路中扮演的具体角色尚不清楚[10,28-29]。最近发现,DAI通过识别HSV-1、VACV、RV以及嗜肺军团菌、大肠杆菌、产单核细胞李氏杆菌和S.Flexneri等病毒和细菌诱导了大量IFN-β的释放[28]。
最初发现,DAI高表达于肿瘤基质,后来又发现它在脾脏、胸腺、淋巴结、扁桃体、骨髓、肝脏、肺脏、小肠和心脏中均有表达,并且在淋巴细胞以及巨噬细胞中高表达,能被I-IFNs诱导产生[30]。DAI与 dsDNA以粒状结构共定位在胞内,但并不与胞内细胞器共定位。由于自噬体在抗病毒的免疫反应和抑制病毒的复制方面发挥了重要的作用,因此认为自噬体或其它胞内小体可能为其提供了一个场所。Takaoka等用各种突变体鉴定D3结构域,同时发现DAI的激活依赖于DNA的长度,但对小于100 bp的DNA仅有很小的反应性[10,28]。无论DNA是否存在,只要DAI能形成多聚体就能启动下游信号,这也和DAI激活的DNA长度依赖性的结论相一致。研究证实,siRNA敲降DAI导致HSV-1诱导的Ⅰ-IFNs的分泌水平下降;基因敲除分析证实,DAI的缺失并不影响DNA诱导IFNs的产生[28],这提示还存在新的DNA识别受体。
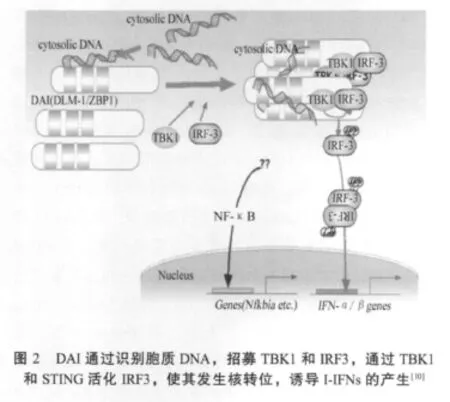
目前DAI的具体信号转导通路、识别的配体以及如何区分“自我”和“非我”的机制等尚不清楚,同时DAI在识别病毒DNA中的确切作用及其重要性也受到一些人的质疑,因为DAI-/-小鼠在感染病毒之后,Ⅰ-IFNs的分泌能力几乎未受影响,反映了机体抵御病毒感染机制的复杂性。
2.2 AIM2对病毒DNA的识别 AIM2是另一个新的胞质DNA识别受体,它不依赖于炎症小体(Inflammasome)NALP3-ASC-Caspase-1,但能够作为胞质DNA识别受体激活炎症小体的形成,与dsDNA介导的炎性细胞因子的激活有关(表1、2,图3)[31-32]。结构分析表明,AIM2属于IFNs诱导蛋白家族,是HIN200(Hematopoietic IFN-inducible nuclear protein)家族中的一员。目前已鉴定出人的4个成员:MNDA(Myeloid cell nuclear differentiation antigen)、IFIX(Pyrin and HIN domain family member)、IFI16 和 AIM2,其中MNDA、IFIX位于胞核,AIM2主要位于胞质,而IFI16分别位于胞核和胞质;在小鼠中,该家族中含有6个成员:p202、p203、p204(IFI16)、p205、p206和 p210(AIM2)[31-32]。AIM2含有2个结构域,N端的Pyrin结构域(PYD)属于效应结构域,负责和下游的ASC结合;C端HIN结构域含有2个相邻的可以和寡聚核苷酸结合的结构域(OB),其中F165负责结合dsDNA。AIM2识别dsDNA,与ASC形成炎症小体,活化NF-κB和Caspase-1,诱导炎性细胞因子IL-1β的高水平分泌,从而介导天然免疫反应、细胞分化、凋亡以及癌症等生理和病理过程[31-32]。
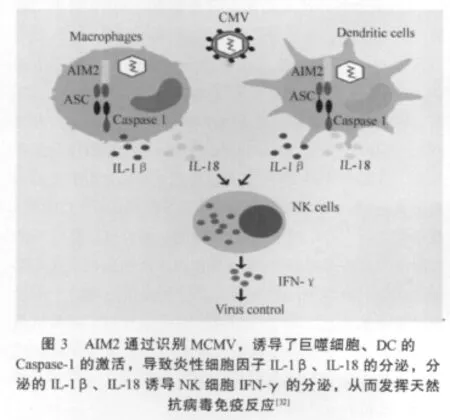
Bürckstümmer等发现,当用dsDNA刺激巨噬细胞时,能诱导炎症反应,同时细胞内AIM2的含量急剧增加;通过siRNA敲降AIM2表达后,导致IL-1β的分泌量显著减少[31];应用活细胞成像技术观察到带标记的dsDNA可诱导带特定标签的AIM2寡聚化,这进一步表明两者关系密切。体外实验也显示,AIM2可通过OB与DNA直接结合,而这种结合与DNA存在的状态和长度有关,而与DNA来源和序列无关:AIM2结合dsDNA,但不结合ssDNA;dsDNA越长,对AIM2激活效应越明显,诱发的免疫反应也越强烈;病毒、细菌、哺乳动物和人工合成的dsDNA均可诱导AIM2的激活。也有研究证明,AIM2是dsDNA激活Caspase-1所必需,并且还发现小鼠HIN-200家族的p202可抑制p210诱导的免疫效应[33]。研究证实,AIM2通过识别MCMV和痘苗病毒(VACV),诱导了巨噬细胞、DC的Caspase-1的激活,导致炎性细胞因子如IL-1β和IL-18的分泌,分泌的IL-1β、IL-18能诱导NK细胞IFN-γ的分泌;而AIM2-/-的巨噬细胞、DC和小鼠对MCMV与VACV反应性降低,导致IL-1β、IL-18的分泌减少[31-32]。表明AIM2在抗病毒免疫反应中发挥了重要的作用。
最近发现,IFNs诱导蛋白家族的成员IFI16(P204)通过识别来源于VACV的核苷酸长度为70个碱基的dsDNA以及来源于HSV的核苷酸长度为60个碱基dsDNA激活了THP-1、MEFs、人PBMCs和小鼠骨髓来源的巨噬细胞和 DCs的信号分子 TBK1、STING、IRF3和 NF-κB,最终诱导了IFN-β的分泌[34]。由此可见,IFI16识别DNA病毒VACV和HSV。由于IFI16和AIM2同属HIN200家族,不仅结构类似,而且均识别DNA病毒,因此将它们命名为AIM2样受体家族(ALRs)。
2.3 RNA PolⅢ对DNA的识别 RNA PolⅢ识别侵入细胞内的DNA病毒,然后以病毒DNA为模板,将病毒DNA转变成5'-ppp的dsRNA,再通过胞内RNA的识别受体RIG-I分子所识别,最终由RIG-I激活细胞的特定信号转导通路,诱导IFNs产生,从而诱导机体的抗病毒免疫(表1、2)。RNA PolⅢ由多个基因编码,经典理论认为RNA PolⅢ能识别基因中一些高度保守的特异序列即RNA PolⅢ的启动子序列而启动基因的转录,介导包括5sRNA、tRNA、7SLRNA和U6SnRNA在内的一些小的稳定的RNA的合成,并参与RNA的加工过程。RNA PolⅢ还可以介导启动子非依赖的Poly(dA∶dT)的转录。RNA PolⅢ是胞质dsDNA的识别受体,但这个信号转导通路是否是广谱的、在时空上如何被调控、是否还有其它分子参与,以及RNA PolⅢ如何区分自身与外源DNA的同时,是否对DNA病毒或细菌感染的靶细胞中的DNA同样有反应性等问题还有待于进一步研究[35]。RNA PolⅢ所参与的胞质DNA的识别只存在于人的细胞中,在小鼠的细胞中并不存在这种识别机制,RNA PolⅢ发挥作用具有时间和组织特异性,从RNA PolⅢ发挥作用机制的角度考虑,这种现象是由种属特异性引起的,还是由使用的DNA与所用细胞的匹配性所引起的,有待验证[36]。
从DAI识别dsDNA、由RNA PolⅢ转化的poly(dA:dU)以及RIG-I识别含5'-ppp的dsRNA等提示,机体还存在新的DNA识别受体感知和识别胞质中的dsDNA。AV、HSV和EB病毒(EBV)的感染,能诱导RNA PolⅢ-RIG-I介导的信号途径。poly(dA∶dT)或 poly(dG∶dC)在鼠原代细胞中能以RIG-I非依赖的方式激活IFNs的产生,提示可能还存在其他dsDNA识别机制[37]。
RNA PolⅢ-RIG-I信号转导通路的生理意义主要体现在炎症性疾病和自身免疫性疾病方面。RNA PolⅢ-RIG-I信号通路依赖性的IFN-β可以抑制 DNA病毒的复制,这个发现有助于对感染性疾病的预防和治疗[35]。EBV诱导产生的IFN-β增强了SLE的敏感性,同时也证实RNA PolⅢ的抑制剂能有效地抑制IFN-β的产生[36],该信号通路在自身免疫性疾病中也发挥了重要的作用。
2.4 NALP3对病毒DNA的识别 NLRP3是NLRs家族中的重要成员,也是研究的比较深入的成员之一。NALP3由NOD结构域、LRR结构域和信号转导结构域组成。其中信号转导结构域即CARD(Caspase recruitment domain)结构/PYD结构域/BIR结构域,这些信号转导结构域能够识别PAMPs/DAMPs、介导 NF-κB信号通路和Caspase-1的活化。当NLRP3被激活后,其通过PYD结构域与ASC结合,然后ASC通过CARD结构域与Caspase-1结合而活化,活化的Caspase-1并不参与凋亡过程而是作为一种蛋白酶而发挥作用[37-38]。
最初研究发现,NALP3识别ATP、谷氨酸钠和肽聚糖等在内的各种微生物或者非微生物成分。后来又发现,NALP3也识别病毒的RNA和DNA,形成炎症小体,在炎症反应中发挥调节作用(表1、2)。NLRP3通过识别甲型流感病毒(IAV)、仙台病毒(SeV)和逆转录病毒(RV)的RNA,诱导了Caspase-1的激活,导致炎性细胞因子如IL-1β和IL-18的释放,在抗RNA病毒的先天性免疫反应中发挥重要作用[2,38]。最近发现,NALP3也识别AV、HSV和痘苗病毒安卡拉株(MVA)等病毒的DNA(图4)[2,38]。AV能激活巨噬细胞形成dsDNA依赖的炎症小体,dsDNA也可以激活NALP3非依赖的dsDNA和ASC依赖性的炎症小体的产生,这表明胞质内存在DNA的直接识别受体[39]。
2.5 Lrrfip1对DNA的识别 Lrrfip1属于钙结合微丝蛋白家族中的成员,是与果蝇胚胎发育和肌生成有关的肌动蛋白的组分。后来在哺乳动物发现,Lrrfip1位于胞内,作为核转录因子与内源性的富含GC的DNA结合,但具体的生物学功能不清楚。2010年,曹雪涛等研究表明,Lrrfip1是另外一个新的胞内PRRs,不仅是一个新胞质RNA识别受体,也是一个新胞质DNA识别受体(表1、2)[40]。机体免疫细胞内的Lrrfip1能识别入侵病原的DNA和RNA,进而通过一种非经典的信号转导通路激活免疫细胞产生Ⅰ-IFNs以迅速清除病原。他们发现,合成的poly(dA∶dT)和 poly(dG∶dC)dsDNA 不仅能诱导Ⅰ-IFNs 的分泌,病原的dsDNA(B型或Z型)也能诱导I-IFNs的分泌。产单核细胞李斯特氏杆菌的DNA和呼吸道合胞体病毒(RSV)的RNA激活Lrrfip1,随后结合并活化 β-Catenin,再通过结合产生Ⅰ-IFNs的关键转录因子IRF3,促进乙酰化转移酶P300在IFN启动子区聚集,形成一个IFNs基因表达增强复合体,从而促进IFNs特别是IFN-β的产生,而用产单核细胞李斯特氏杆菌的DNA刺激被siRNA敲降的Lrrfip1时,IFN-β的分泌减少。因此,该研究发现了一条不同于经典模式的、由胞内核酸识别分子Lrrfip1及其下游信号分子组成的免疫识别病原核酸及触发Ⅰ-IFNs产生的新型分子途径,为深入认识免疫系统如何抗御病原感染的机制和抗感染免疫药物的设计提供了新的靶点和思路。
3 其它的DNA识别受体
RIG-I主要识别 dsRNA。合成的 poly(dAT∶dAT)ds-DNA和嗜肺军团菌的dsDNA通过RIG-I信号转导通路诱导了IFN-β的分泌,在抗感染中发挥了重要作用(表1、2)[41]。
DNA-PKCs、Ku70、p53、ATM 和 ATR等损伤 DNA结合分子能识别损伤的DNA,因此它们也归类于胞质DNA识别受体(表1、2)[42]。它们均为PI3样激酶(PI3-like kinases)模式的DNA蛋白激酶家族成员,能被快速激活并对DNA损伤发生反应。DNA-PKCs是识别双链断裂DNA(Double strand breaks,DSBs)的感受器,机体能募集DNA-PKCs到损伤部位,参与DNA修复,但尚未有足够证据证明DNA-PKCs在识别损伤DNA,诱发机体反应中是必须的;ATM也可能是一个损伤DNA的感受器,虽然不能被dsDNA激活,但是ATM存在于核内,可能识别染色体,从这种意义讲,它也是损伤DNA的感受器;ATR不仅识别ssDNA和停滞的dsDNA复制叉,也识别DSBs;p53含两个DNA结构域:一个是含有p53核心域的序列特异性DNA结合域,负责识别p53目的基因启动子的共同DNA序列;另一个是p53C端的非特异性核酸结合域,结合ssDNA和损伤DNA[42]。
其它胞质DNA识别受体如高迁移率族蛋白(High-mobility group box,HMGB)、STING(MITA/ERIS/TMEM173)、AT 钩(AT hook)、PHD(Plant homeodomain)、Bright(Bright domain)、Myb/SANT和SAP等可以结合DNA;痘病毒致病因子E3L和斑马鱼ssRNA依赖的蛋白激酶样真核启动因子 2a激酶(PKZ)也可以结合 Z型 DNA;转录因子WT-1、TRA-1、Bicoid、STAT1、TLS/FUS 和 非 洲 蟾 蜍TFIIIA蛋白等可以结合DNA,这些DNA结合分子在DNA的复制、转录、修复和抗DNA病毒感染以及自身免疫反应等中发挥作用[10,43-44]。
4 展望
近年来发现了众多的DNA识别受体,但对于胞质DNA识别受体的生物学功能研究则处于起步阶段,众多棘手问题亟待解决,如胞质DNA识别受体识别病原DNA的信号转导机制是如何进行的等。AIM2能识别胞质中的dsDNA,通过炎症小体诱导IL-1β的分泌,但是否可以诱导Ⅰ-IFNs分泌还有待进一步研究。胞质中的DNA在RNA PolⅢ的作用下启动RIG-I介导的免疫应答,那它的生理意义如何,是否胞质中的DNA也可以在其它PRRs作用下启动除RIG-I以外的PRRs来介导机体的免疫反应,或胞质中的RNA能否在其它PRRs的作用下也启动由其它PRRs介导的免疫应答,嗜肺军团菌的dsDNA是如何激活人特定的细胞诱导Ⅰ-IFNs的分泌,已发现的或尚未发现的胞质DNA识别受体在机体的免疫系统、感染性疾病、自身免疫性疾病、癌症和疫苗的效应中等扮演了怎样的角色。对上述问题的解答将有助于揭示机体抗病毒感染免疫的分子机制、肿瘤与自身免疫性疾病的发病机理、病原的逃逸机制、病原与机体之间的相互作用以及疫苗的设计和应用。
[1]何小兵,房永祥,贾怀杰,等.Toll样受体7介导的抗病毒天然免疫反应研究进展[J].中国兽医科学,2010,40(06):645-649.
[2]景志忠,何小兵,房永祥,等.机体识别病毒的分子模式及其抗病毒效应机制[J].畜牧兽医学报,2011,42(3):311-322.
[3]Barbalat R,Ewald S E,Mouchess M L,et al.Nucleic acid recognition by theinnateimmuneSystem[J].Ann Rev Immunol,2011,29:185-214.
[4]Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[5]Yoneyama M,Fujita T.Recognition of viral nucleic acids in innate immunity[J].Rev Med Virol,2010,20(1):4-22.
[6]何小兵,房永祥,贾怀杰,等.Toll样受体介导的先天性抗病毒免疫反应研究进展[J].细胞与分子免疫学杂志,2011,27(06):709-712.
[7]Fukui R,Saitoh S,Matsumoto F,et al.Unc93B1 biases Toll-like receptor responses to nucleic acid in dendritic cells toward DNA-but against RNA-sensing[J].J Exp Med,2009,206(6):1339-1350.
[8]Chockalingam A,Brooks J C,Cameron J L,et al.TLR9 traffics through the Golgi complex to localize to endolysosomes and respond to CpG DNA[J].Immunol Cell Biol,2009,87(3):209-217.
[9]Hemmi H,Takeuchi O,Kawai T,et al.A Toll-like receptor recognizes bacterial DNA[J].Nature,2000,408(6813):740-745.
[10]Takaoka A,Taniguchi T.Cytosolic DNA recognition for triggering innate immune responses[J].Adv Drug Deliv Rev,2008,60(7):847-857.
[11]Macedo G C,Magnani D M,Carvalho N B,et al.Central role of My D88-dependent dendritic cell maturation and proinflammatory cytokine production to control brucella abortus infection1[J].J Immunol,2008,180(2):1080-1087.
[12]Bhan U,Trujillo G,Lyn-Kew K,et al.Toll-like receptor 9 regulates the lung macrophage phenotype and host immunity in murine pneumonia caused by legionella pneumophila[J].Infect Immun,2008,76(7):2895-2904.
[13]Lund J,Sato A,Akira S,et al.Toll-like receptor 9-mediated recognition of Herpes simplex virus-2 by plasmacytoid dendritic cells[J].J Exp Med,2003,198(3):513-520.
[14]Hochrein H,Schlatter B,O'Keeffe M,et al.Herpes simplex virus type-1 induces IFN-alpha production via Toll-like receptor 9-dependent and-independent pathways[J].PNAS USA,2004,101(31):11416-11421.
[15]Ashkar A A,Bauer S,Mitchell W J,et al.Local delivery of CpG oligodeoxynucleotides induces rapid changes in the genital mucosa and inhibits replication,but not entry,of herpes Simplex virus type 2[J].J Virol,2003,77(16):8948-8949.
[16]Verthelyi D,Ishii K J,Gursel M,et al.Human peripheral blood cells differentially recognize and respond to two distinct CPG motifs[J].J Immunol,2001,166(4):2372-2377.
[17]Hartmann G,Battiany J,Poeck H,et al.Rational design of new CpG oligonucleotides that combine B cell activation with high IFN-alpha induction in plasmacytoid dendritic cells[J].Eur J Immunol,2003,33(6):1633-1641.
[18]Honda K,Ohba Y,Yanai H,et al.Spatiotemporal regulation of MyD88-IRF-7 signalling for robust type-I interferon induction[J].Nature,2005,434(7036):1035-1040.
[19]Haas T,Metzger J,Schmitz F,et al.The DNA sugar backbone 2'deoxyribose determines toll-like receptor 9 activation[J].Immunity,2008,28(3):315-323.
[20]Barrat F J,Meeker T,Gregorio J,et al.Nucleic acids of mammalian origin can act as endogenous ligands for Toll-like receptors and may promote systemic lupus erythematosus[J].J Exp Med,2005,202(8):1131-1139.
[21]Ramirez Z G,Specht O C,Wang J P,et al.Toll LikeReceptor-9 Dependent Immune Activation by Unmethylated CpG Motifs in Aspergillus fumigatus DNA[J].Infect Immunol,2008,76(5):2123-2129.
[22]Bafica A,Santiago H C,Goldszmid R,et al.Cutting edge:TLR9 and TLR2 signaling together account for MyD88-dependent control of parasitemia in Trypanosoma cruzi infection[J].J Immunol,2006,177(6):3515-3519.
[23]Shimosato T,Kitazawa H,Katoh S,et al.Augmentation of T(H)-1 type response by immunoactive AT oligonucleotide from lactic acid bacteria via Toll-like receptor9 signaling[J].Biochem Biophys Res Commun,2005,326(4):782-787.
[24]Parroche P,Lauw F N,Goutagny N,et al.Malaria hemozoin is immunologically inert but radically enhances innate responses by presenting malaria DNA to Toll-like receptor 9[J].PNAS USA,2007,104(7):1919-1924.
[25]Coban C,Igari Y,Yagi M,et al.Immunogenicity of whole parasite vaccines against plasmodium falciparum involves malarial hemozoin and host TLR9[J].Cell Host Microbe,2010,7(1):50-61.
[26]Verthelyi D,Gursel M,Kenney R T,et al.CpG oligodeoxynucleotides protect normal and SIV-infected macaques from Leishmania infection[J].J Immunol,2003,170(9):4717-4723.
[27]Park B,Brinkmann M M,Spooner E,et al.Proteolytic cleavage in an endolysosomal compartment is required for activation of Toll-like receptor 9[J].Nat Immunol,2008,9(12):1407-1414.
[28]Takaoka A,Wang Zhi-chao,Choi M K,et al.DA I(DLM-1/ZBP1)is a cytosolic DNA sensor and an activator of innate im-mune response[J].Nature,2007,448(7152):501-505.
[29]Kaiser W J,Upton J W,Mocarski E S.Receptor-interacting protein homotypic interaction motif-dependent control of NF-kappa B activation via the DNA-dependent activator of IFN regulatory factors[J].J Immunol,2008,181(9):6427-6434.
[30]Gu Wei,Pan F,Singer R H.Blocking β-catenin binding to the ZBP1 promoter represses ZBP1 expression,leading to increased proliferation and migration of metastatic breast-cancer cells[J].J Cell Sci,2009,122(Pt11):1895-1905.
[31]Bürckstümmer T,Baumann C,Blüml S,et al.An orthogonal proteomicgenomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome[J].Nat Immunol,2009,10(3):266-272.
[32]Rathinam V A,Fitzgerald K A.Inflammasomes and Anti-Vira Immunity[J].J Clin Immunol,2010,30(5):632-637.
[33]Brough D,Rothwell N J.Caspase-1-dependent processing of prointerleukin-1beta is cytosolic and precedes cell death[J].J Cell Sci,2007,120(Pt 5):772-781.
[34]Unterholzner L,Keating S E,Baran M,et al.IFI16 is an innate immune sensor for intracellular DNA[J].Nat Immunol,2010,11(11):997-1004.
[35]Chiu Y H,Macmillan J B,Chen Zhi-jian.RNA polymeraseⅢdetects cytosolic DNA and induces typeⅠinterferons through the RIG-I pathway[J].Cell,2009,138(3):576-591.
[36]Ronnblom L,Pascual V.The innate immune system in SLE:typeⅠinterferons and dendritic cells[J].Lupus,2008,17(5):394-399.
[37]Takeuchi O,Akira S.Pattern recognition receptors and inflammation[J].Cell,2010,140(6):805-820.
[38]Shayakhmetov D M.Virus Infection Recognition and Early Innate Responses to Non-Enveloped Viral Vectors[J].Viruses,2010,2(1):244-261.
[39]Muruve D A,Pétrilli V,Zaiss A K,et al.The inflammasome recognizes cytosolic microbial and host DNA and triggers an innate immune response[J].Nature,2008,452(7183):103-107.
[40]Yang Peng-yuan,An Hua-zhang,Liu Xing-guang,et al.The cytosolic nucleic acid sensor LRRFIP1 mediates the production of type I interferon via a β-catenin-dependent Pathway[J].Nat Immunol,2010,11(6):487-494.
[41]Cheng Guo-feng,Zhong Jin,Josan C,et al.Double stranded DNA and double stranded RNA induce a common antiviral signaling pathway in human cells[J].PNAS USA,2007,104(21):9035-9040.
[42]Falck J,Coates J,Jackson S P.Conserved modes of recruitment of ATM,ATR and DNA-PKCs to sites of DNA damage[J].Nature,2005,434(7033):605-611.
[43]Yanai H,Ban T,Wang Zhi-chao,et al.HMGB proteins function as universal sentinels for nucleic-acid-mediated innate immune responses[J].Nature,2009,462(7269):99-103.
[44]Notenboom V,Hibbert R G,van Rossum-Fikkert S E,et al.Functional characterization of Rad18 domains for Rad 6,ubiquitin,DNA binding and PCNA modification[J].Nucleic Acids Res,2007,35(17):5819-5830.
- 中国预防兽医学报的其它文章
- 5株H9N2亚型禽流感病毒血凝素蛋白分子特征分析和豚鼠间传播能力的评估

