HCMV感染对人原代星形胶质细胞IL-6和IL-8表达的影响
王二朴,于向民,李 玲,钱冬萌,王 斌
(青岛大学医学院,山东青岛266071)
人巨细胞病毒(HCMV)是造成人类宫内感染导致胎儿中枢神经系统先天性异常的常见病原体。迄今为止,HCMV引起神经系统损伤的机制尚未十分明确。细胞因子是由特定细胞合成、分泌的一类生物活性物质,具有多种生物学作用,如介导和调节免疫应答和炎症反应,参与炎症的病理损害等[1]。IL-6是一种多功能的细胞因子,不仅在机体免疫应答、急性反应和造血调控中起重要作用,而且其表达异常会产生多种临床疾病[2];IL-8具有炎症细胞趋化功能并能促其释放一系列活性产物,导致机体局部的炎症反应,从而达到杀菌和致异常细胞凋亡的目的[3]。目前,体外实验证实[4~7],HCMV 感染本身并不能诱导神经元的凋亡,其凋亡主要存在于染毒星形胶质细胞周围的未染毒神经元,提示HCMV感染对神经元的损伤并不是由HCMV感染直接造成的,而是通过感染其周围的星形胶质细胞、影响其旁分泌功能、改变神经元微环境实现的。2010年~2012年,我们以人原代星形胶质细胞为研究对象,观察HCMV能否感染人原代星形胶质细胞以及感染后对细胞IL-6和IL-8表达的影响,以探讨HCMV导致神经系统损伤的致病机制。
1 材料与方法
1.1 主要试剂 HCMV AD169毒株。人原代星形胶质细胞,人胚肺成纤维细胞。胎牛血清,Trizol试剂,DMEM/F12培养液,胶质纤维酸性蛋白抗体(Anti-GFAP),鼠抗HCMV即刻早期(IE)蛋白单克隆抗体,异硫氰酸荧光素(FITC)标记兔抗鼠IgG,Thermo Scientific反转录试剂盒,FermentasTMGreeen Dream Taq PCR Master Mix(2×),RIPA裂解液(强),苯甲基磺酰氟(PMSF),兔抗人IL-6多克隆抗体,兔抗人IL-8多克隆抗体,HRP标记羊抗兔IgG,超敏化学发光试剂盒。取自愿行米非司酮流产孕妇的新鲜胚胎(孕8~10周),其家属知情同意,由青岛市海慈医院提供。
1.2 HCMV病毒增殖和滴度测定 HCMV在人胚肺成纤维细胞中增殖,待细胞病变至80%以上时收取细胞及培养上清液,-86℃反复冻融3次,使病毒颗粒释放,1 000 r/min离心10 min,收集上清液作为病毒储存液,分装至EP管并保存于-86℃冰箱。通过空斑定量法,确定病毒的感染滴度为5 pfU/cell[8]。
1.3 人原代星形胶质细胞的分离、纯化及鉴定75%乙醇消毒人胚胎,仔细剔除血管及软脑膜,取大脑皮质放入DMEM/F12培养液中,用吸管吹打并收集含单细胞的上清液,离心(800 r/min、5 min),弃上清液取细胞沉淀,加入DMEM/F12(含10% 胎牛血清)制成细胞悬液,接种于培养瓶中,于37℃、5%CO2的培养箱中培养。每3~5 d换液1次,约8~10 d后细胞铺满瓶底。传代前于37℃ 、250 r/min摇床振荡过夜后弃掉培养液,以去除神经元、小胶质细胞和少突胶质细胞,用差速贴壁法去除成纤维细胞。连续纯化3代。第4代经细胞爬片转移到圆盖玻片上培养2~3 d,用免疫荧光法鉴定星形胶质细胞纯度。
1.4 细胞培养及分组 对纯化的人原代星形胶质细胞进行分组。对照组:正常培养的细胞。感染组:细胞贴壁至培养瓶底部约80%时,加HCMV悬液(5 pfU/cell),置培养箱中孵育2 h后吸去病毒悬液,加DMEM/F12维持液(含2%胎牛血清),置37℃、5%CO2孵箱继续培养,于培养 6、12、24、48、96 h 时用Trizol法收集细胞。因蛋白质表达水平多延迟mRNA表达水平24 h,故用RIPA裂解液(含100 mM的PMSF)裂解收集感染36、48、72、96 h时的细胞总蛋白。
1.5 HCMV感染原代星形胶质细胞模型的鉴定根据 IE mRNA序列设计引物,上游引物:5'-ATGAACCACCCTCCTCTTCC-3',下游引物:5'-GATATTGCGCACCTTCTCGT-3',扩增长度为290 bp。分别提取两组细胞中总 RNA,以随机引物逆转录成cDNA,PCR扩增,检测IE mRNA。病毒感染3 d后采用免疫荧光方法检测细胞中IE蛋白。
1.6 两组IL-6及IL-8 mRNA的检测 用Triol一步法提取培养各时间点细胞的总RNA,以Oligo(dt)为引物,将RNA逆转录为cDNA,特异性引物(表1)PCR扩增,并经1.5%凝胶电泳检测基因表达,对产物的电泳条带进行光密度分析,以目的片段与内参灰度比值为其相对表达量。
1.7 两组IL-6及IL-8蛋白的检测 采用Westernblot法。用Quantity One图像分析软件得到蛋白条带的灰度面积。将目的蛋白条带与管家基因内参β-actin蛋白条带的灰度比值作为目标蛋白的相对表达量。

表1 IL-6及IL-8 mRNA引物序列及扩增片段长度
1.8 统计学方法 采用SPSS13.0统计软件。所得数据以¯x±s表示,行单因素方差分析。各组之间的多重比较采用LSD-t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 原代星形胶质细胞纯度 分离、纯化第4代后的原代星形胶质细胞,免疫荧光染色后在倒置显微镜下细胞有较强的绿色荧光。计数200个细胞,原代星形胶质细胞纯度达到95%以上。
2.2 两组细胞形态变化及IE mRNA、蛋白表达对照组:细胞饱满,具有多个突起,无细胞病变效应(CPE)。感染组:HCMV感染3 d出现CPE,细胞逐渐变圆,伸出的细胞突起回缩,细胞体积增大并且相互融合,5 d后更加明显,部分细胞甚至从瓶底脱落,悬浮生长一段时间后死亡。感染组在290 bp处可见特异性条带,大小与IE mRNA的理论大小一致(见图1),病毒感染3 d后,感染组细胞核内大量表达IE蛋白。对照组均无IE mRNA、蛋白的表达。HCMV能够感染人原代星形胶质细胞。

图1 两组细胞中IE mRNA表达结果
2.3 两组IL-6及IL-8 mRNA表达变化 感染组感染后6、12、24 h IL-6 mRNA表达较对照组显著增加(P 均 <0.05),至48、96 h,表达量大幅下降;对照组IL-8无表达,感染组感染后6、12、24 h IL-8表达量增加(P均 <0.05),48、96 h显著下调。两组细胞中IL-6及IL-8 mRNA相对表达量见表2。
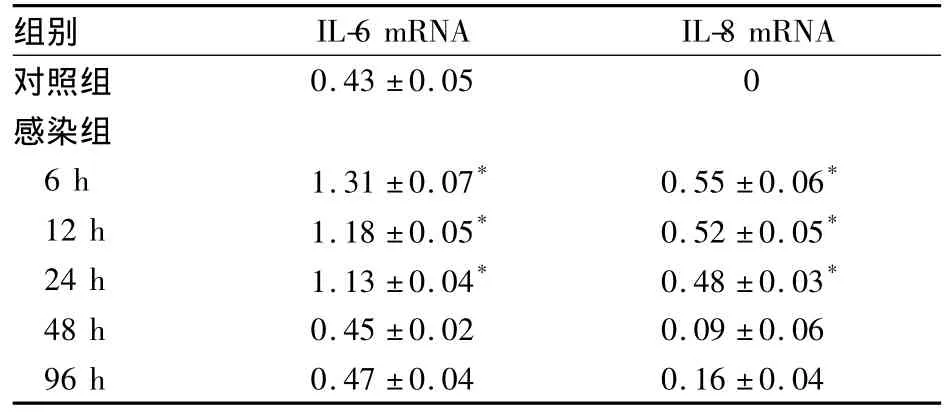
表2 两组IL-6及IL-8 mRNA相对表达量比较(¯x±s)
2.4 两组IL-6及IL-8蛋白的表达变化 见表3。对照组IL-6表达很低;感染组36、48 h表达量明显上调(P 均 <0.05),72、96 h时,其表达量与对照组相近(P均>0.05)。对照组IL-8蛋白无表达;感染组在感染36、48 h时IL-8蛋白表达量较高(P均<0.05),72、96 h 时 IL-8 蛋白表达下降,与对照组相近(P 均 >0.05)。

表3 两组IL-6及IL-8蛋白相对表达量比较(¯x±s)
3 讨论
机体受到细菌或病毒感染时,会激活细胞自身一系列信号通路从而诱导产生一系列对炎症反应有促进作用的细胞因子,并通过炎症反应来降低病毒的复制与传播。这些促细胞炎性因子的表达对于宿主细胞来说是一种有效地抗病毒机制。因此,不难理解HCMV感染初期,随着病毒的吸附、注入等过程的进行,星形胶质细胞会分泌包括IL-6和IL-8在内的大量细胞因子来应对病毒的侵染,IL-6和IL-8表达水平的增加是病毒直接作用于宿主细胞的结果。病毒感染后期IL-6和IL-8表达下降却无确切的解释。
HCMV的基因组是双链DNA,全长>240 kb,含有至少208个开放阅读框。病毒感染细胞后,HCMV的基因表达呈现出一定的时序性,分为最早期、早期和晚期。最早期基因被宿主的因子激活并最早表达,产生3种重要的调控蛋白 IE55、IE72、IE86蛋白。IE蛋白是病毒感染细胞后最先合成的蛋白,检测到IE蛋白意味着HCMV可在细胞内建立感染。
IE72和IE86蛋白是病毒复制和其他基因表达所必须的蛋白。IE86蛋白全长579个氨基酸,是一种糖蛋白,能在体外形成二聚体,其氨基酸功能域位于456 ~539[9]。有学者[10~12]发现,在体外培养的人睾丸上皮细胞中表达HCMV IE86蛋白能够降低由病毒诱导的β干扰素以及趋化因子等细胞因子的产生。因此我们认为,HCMV感染原代星形胶质细胞后期,由于其自身最早期基因的表达,产生的IE86蛋白抑制了星形胶质细胞中IL-6和IL-8的表达。
HCMV致中枢神经系统损伤的致病机制尚未阐明。已知在中枢神经系统中,神经胶质细胞尤其是小胶质细胞和星形胶质细胞是细胞因子分泌的主要来源。细胞因子在免疫及神经内分泌网络的连接和调节中起到十分重要的作用。星形胶质细胞是包括HCMV在内的多种嗜神经病毒的主要靶细胞,因此研究HCMV是否激活并引起星形胶质细胞分泌细胞因子改变,将有助于了解HCMV感染的胶质细胞在神经元损伤中所产生的作用。
本研究结果证实人原代星形胶质细胞是HCMV的完全容许细胞(即HCMV能够在人原代星形胶质细胞建立感染),且从mRNA、蛋白水平首次证实HCMV感染能够诱导人原代星形胶质细胞IL-6和IL-8表达异常。对照组中,IL-6表达量很低,IL-8不表达;感染组中,感染初期IL-6和IL-8表达均增加,后期均下调至与对照组相近水平。但是,体外实验研究多限于单一细胞因子对HCMV感染的作用,体内细胞因子的表达水平受到的调控因素要复杂的多,HCMV感染对体内星形胶质细胞IL-6和IL-8表达的调控作用及其机制以及HCMV致神经系统损伤的机制等尚需进一步深入研究。
[1]熊书君.细胞因子与HCMV致病性关系初探[J].国外医学:病毒学分册,2004,11(6):176-179.
[2]任蕴芳.白细胞介素6研究进展[J].解放军医学情报,1992,6(4):195-197.
[3]庞林华,胡友梅.白细胞介素8的研究进展[J].生理科学进展,2004,2(1):54-59.
[4]Lokensgard JR,Cheeran MC,Gekker G,et al.Human cytomegalovirus replication and modulation of apoptosis in astrocytes[J].Hum Virol,1999,2(2)91-101.
[5]Tsutsui Y,Kashiwai A,Kawamura N,et al.Prolonged infection of mouse brain neurons with murine cytomegalovirus after pre-and perinatal infection[J].Arch Virol,1995,140(10):1725-1736.
[6]Shinmura Y,Aiba-Masago S,Kosugi I,et al.Differential expression of the immediate-early and early antigens in neuronal and glial cells of developing mouse brains infected with murine cytomegalovirus[J].Am J Pathol,1997,151(5):1331-1340.
[7]Kosugi I,Shinmura Y,Li RY,et al.Murine cytomegalovirus induces apoptosis in non-infected cells of the developing mouse brain and blocks apoptosis in primary neuronal culture[J].Acta Neuropathol,1998,96(3):239-247.
[8]王海涛,李玲,王斌,等.HCMV感染对神经胶质细胞NGF表达的影响[J].山东医药,2009,49(2):10-11.
[9]徐进平,叶林柏.HCMV IE86蛋白与转录激活因子的相互作用[J].中国科学,2002,32(3):232-239.
[10]Taylor RT,Bresnahan WA.Human cytomegalovirus immediate-early 2 gene expression blocks virus-induced beta interferon production[J].J Virol,2005,79(6):3873-3877.
[11] Taylor RT,Bresnahan WA.Human cytomegalovirus immediateearly 2 protein IE86 blocks virus-induced chemokine expression[J].J Virol,2006,80(2):920-928.
[12]Taylor RT,Bresnahan WA.Human cytomegalovirus IE86 attenuates virus-and tumor necrosis factor alpha-induced NFκB-dependent gene expression[J].J Virol,2006,80(21):10763-10771.

