脑微血管内皮细胞与体外培养神经干细胞共培养后Th1/Th2相关细胞因子的表达
罗文芳 唐 涛 林 源 罗杰坤 钟鹏程 刘清娥
(中南大学湘雅医院中西医结合研究所,湖南 长沙 410008)
Th细胞是决定移植免疫排斥的关键成分,Th1细胞产生IFN-γ 和 IL-2 介导细胞免疫;Th2 细胞则产生 IL-4、IL-10 等,介导体液免疫。针对同种异体抗原的移植免疫应答主要是由Th1细胞介导。研究发现,在移植器官功能发生障碍之前,常检测到 IFN-γ、IL-2 基因表达增高〔1〕。侧脑室的脑室下带(Svz)和海马的颗粒下带(SGz)集中于血管周围,而且和内皮细胞间仅隔一层基板,这种解剖上的毗邻关系暗示了NScs和内皮细胞间存在密切的联系。本实验模拟内皮细胞与神经干细胞的体内环境建立共培养模型,观察Th1/Th2细胞相关细胞因子的变化,探讨同种异体内皮细胞与神经干细胞的免疫反应关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 新生3 d的Sprague-Dawley乳鼠6只,新生7~10 d Sprague-Dawley乳鼠20只,雌雄不拘,由中南大学湘雅医学院实验动物学部提供。
1.1.2 主要试剂及药物 M199干粉培养基、D-Hank′s液干粉(Hyclone),谷氨酰胺(上海伯奥),肝素钠、明胶、台盼蓝、胰蛋白酶、Ⅱ型胶原酶(Sigma),胎牛血清(杭州四季青),DNaseⅠ(Roche),多聚赖氨酸(武汉博士德),bFGF、EGF(Pepro Tech EC),抗Ⅷ因子相关抗原多克隆抗体(美国PharMingen),Trizo1试剂盒、DNA Marker、逆转录(RT)试剂盒、Pre Mix Taq(宝生物大连),β-actin引物(上海生工),一抗(Abcam),辣根过氧化物酶标记的羊抗兔IgG、辣根酶标记链霉亲和素、浓缩DAB试剂盒(北京中山),其他常用试剂为国产分析纯产品。
1.1.3 主要仪器 OLYMPUS IXTO倒置显微镜(日本OLYMPUS),QWJ300TVBB型CO2培养箱(美国产),Sanyo超低温冰箱(日本三洋),ELX800酶标仪(美国产),超净工作台(苏州净化),E260 电子天平(梅特勒),Beckman J2-21 型低温离心机(美国产),Beckman DU-640紫外分光光度计(美国产),Nikon倒置荧光相差显微镜(日本尼康),PCR仪(美国ABI),DDY多导电泳仪(北京六一),UPW-5超纯水仪(美国产),DHW-60恒温水浴箱、DHP-81恒温箱(上海医用仪器厂),50ml培养瓶、培养板、滤器等耗材(Costar、Millipore等公司)。
1.2 方法
1.2.1 血管内皮细胞培养液的配制 用超纯水溶解M199干粉培养基,配制成体积比为1∶1的 M199无血清培养基(每1000 ml培基中另加2.2 g碳酸氢钠、1 g葡萄糖、0.9 g谷氨酰胺),0.22 μm滤膜过滤除菌,4℃保存备用。使用前加 EGF、bFGF 各 20 ng/ml,青 霉 素、链 霉 素 各 100 U/ml,ECGS 500 μg/ml,20%胎牛血清配成内皮细胞完全培养液。
1.2.2 大鼠脑皮质微血管内皮细胞的分离、培养、传代及鉴定
新生7~10 d SD乳鼠20只,75%酒精浸泡消毒5 min,断颈处死,无菌条件下取脑,立即放入盛有4℃ D-Hank′s液的平皿中;仔细剔除大血管、软脑膜、脑干、小脑及大脑髓质,将大脑皮质剪成1 mm3的小块,加入20 ml含0.005%的 DNaseⅠ的D-Hank′s液,玻璃匀浆器上下匀浆20次;匀浆液用孔径150 μm的不锈钢滤网过滤,收集滤液,再用孔径75 μm的不锈钢滤网,弃滤液;用 D-Hank′s液冲洗滤网,收集滤网上的微血管段,1000 r/min×15 min离心,收集沉淀的微血管段。上述操作均在冰上进行。
将微血管段移入含0.005%DNaseⅠ的0.1%Ⅱ型胶原酶溶液中,37℃振荡消化30 min;加入20%胎牛血清终止消化,1000 r/min× 15 min离心,弃上清后,加 D-Hank′s液清洗,1000 r/min×15 min离心,弃上清,洗涤2次,沉淀物加入内皮细胞完全培养液,制成细胞悬液,接种于预先包被好明胶的玻璃培养瓶中,置37℃、5%CO2培养箱中培养2 h后,将细胞悬液转入一次性培养瓶中继续培养,每2~3 d换液,观察细胞生长情况。
原代培养7~10 d后,细胞呈单层密集生长,近亚融合时进行传代繁殖。倒掉培养液后,以D-Hank′s液清洗2遍。0.25%胰蛋白酶37℃消化细胞约5 min,予20%胎牛血清终止消化。800 r/min×10 min离心,吸出消化液,D-Hank′s液清洗,离心,洗涤两次,收集内皮细胞,制成细胞悬液,接种于培养瓶中,以后每2~3 d换液一次至细胞铺满瓶底。
将细胞以2×105/ml细胞接种于预先放有洗净、多聚赖氨酸溶液包被并消毒的小盖玻片的24孔培养板中,培养基为内皮细胞完全培养液,培养2 d后,用Ⅷ因子相关抗原进行免疫细胞化学鉴定。
1.2.3 大鼠脑皮质微血管内皮细胞的鉴定 Ⅷ因子相关抗原的免疫细胞化学检测:将洗净、多聚赖氨酸溶液包被、消毒后的小盖玻片置于24孔板中,按传代培养的方法,以密度为2×105/ml接种细胞3 d后,可见盖玻片上长有一层细胞,0.01 mol/L PBS洗涤5 min×3次,每孔加入4%多聚甲醛室温固定30 min;按SABC试剂盒说明书进行操作,阴性对照用0.01 mol/L PBS代替一抗进行。
1.2.4 测定细胞生长曲线 收集生长良好的细胞,经胰酶消化,台盼蓝计数,以2×105/ml细胞密度接种于一次性24孔培养板中置37℃、5%CO2培养箱中培养,每日消化3孔,以血细胞计数板计数,取3孔细胞数均值绘制细胞生长曲线。
1.2.5 海马 NSCs的分离、培养、传代及鉴定〔2,3〕取新生(3 d)SD大鼠,断颈处死,以75%酒精浸泡5 min,无菌条件下取出大脑放入含无菌0.01 mol/L PBS培养皿中,剥除脑膜,分离出海马,将其剪成0.5 mm×0.5 mm大小的组织块,移入10 ml玻璃培养瓶内,加入0.05%胰酶-EDTA消化15~30 min,20%胎牛血清终止消化,过200目细胞筛,收集细胞悬液于试管中,离心1000 r/min× 10 min,D-Hank′s液洗涤 3 遍,加入NSCs选择培养液,吸管反复吹打制成单细胞悬液,调整细胞密度,按1×105个/ml接种于培养瓶,常规37℃ 5%CO2孵箱中培养。每3 d半量换液,待原代克隆形成后(约7~10 d),以0.25%胰酶消化细胞克隆制成单细胞悬液进行传代。
选取部分培养的细胞克隆种植明胶包被的24孔培养板上,加入含血清培养基DMEM/F12。2 d后以Nestin抗原进行免疫组织化学染色鉴定NSCs。
1.2.6 NSCs+MVEC共培养 脑微血管内皮细胞以1×105/cm2的密度,种于包被2.5%明胶的OSTAR 24孔TRANSWELL外槽,以脑微血管内皮细胞培养液培养72~96 h后,细胞汇片;D-Hank′s液洗细胞2次,在膜孔径8.0 μm的内槽种入传代4 d的神经干细胞球,分为共培养组(NSCs+MVECs)、空白对照组(NSCs),培养48 h后,用荧光免疫细胞化学和RT-PCR技术检测神经干细胞中 INF-γ,IL-2,IL-4,IL-10 的表达。
1.2.7 免疫细胞荧光化学检测 INF-γ,IL-2,IL-4,IL-10 蛋白表达 将洗净、多聚赖氨酸溶液包被、消毒后的小盖玻片置于24孔板中,按传代培养的方法,以密度为2×105/cm2接种细胞3 d,盖玻片上长有一层细胞后。分空白对照组、共培养组加以处理;每组设6个复孔,按上述条件干预各组细胞后,吸出培养液,按SABC试剂盒说明书进行操作。
以上操作除滴加封闭液后勿洗外,其他各步骤间均需用0.01 mol/L PBS洗涤5 min×3次。阴性对照用0.01 mol/L PBS代替一抗进行。
所有在同一条件下完成免疫组化染色的两组细胞,按每组6孔、每孔于400倍光镜下中随机选取一个高倍视野拍照。
1.2.8 RT-PCR 检测 INF-γ,IL-2,IL-4,IL-10 mRNA 收集各组细胞,按下述流程提取细胞总RNA。①取1 ml内含106个细胞的培养液于1.5 ml EP管中;②4℃,12000 r/min离心30 s,弃上清;③加入1 ml Trizol,重悬细胞,室温孵育5 min;④加入0.2 ml氯仿,振摇15 s,室温孵育10 min;⑤4℃,12000 r/min离心15 min,收集上层无色水相于1.5 ml EP管中,去沉淀;加入等体积的异丙醇,混匀,室温孵育 5~10 min;⑥4℃,12000 r/min离心10 min,弃上清;加入1 ml 75%乙醇并混匀;⑦4℃,12000 r/min离心10 min,弃上清;空气中干燥10 min;⑧加入20 μl含1‰DEPC蒸馏水溶解 RNA,取2 μl RNA作凝胶电泳鉴定,确定RNA有无降解;再取1.5 μl 100倍稀释,分光光度计测定A260和A280值,以测定RNA的含量及纯度。余液于-70℃冰箱保存。
逆转录:取总 RNA 0.5 μg,Oligo(dT)18(50 μg/ml)引物1 μl,RNasin 1 μl,加 DEPC 水至 11 μl,70℃变性 5 min,在冰浴下加 5 × 逆转录缓冲液 4 μl,10 mmol dNTP 2 μl,RNasin 1 μl,加 DEPC 水至 19 μl;37℃,5 min;加 M-MLV 1 μl(200 U/μl),总体积 20 μl;42℃,60 min 后;再 70℃,10 min。
PCR特异性引物用primer premier5.0软件设计,由上海生物工程公司合成,各引物序列见表1。
扩增反应体系:取 Pre Mix Taq 12.5 μl,cDNA 2.0 μl,10 μmol/L目的引物 1.0 μl,β-actin 引物 1.0 μl加 DEPC 水至总体积25 μl,4000 r/min短暂离心后,于PCR仪中扩增。反应条件:预变性 94℃,5 min;变性94℃,30 s;退火温度见表1,40 s;延伸72℃,45 s;35个循环,末次循环后72℃延伸7 min。取PCR 产物5 μl,加上样缓冲液1 μl,2.0%琼脂糖凝胶电泳,图像分析仪摄片。采用Band Leader软件分析数据,获得各电泳条带的吸光度值(X),用β-actin的吸光度值(A)作为内参照,计算基因的相对表达量(X/A)。
1.3 统计学方法 应用SPSS13.0软件,各组数据以±s表示,两样本均数比较用t检验。

表1 基因扩增引物序列、退火温度及产物大小
2 结果
2.1 大鼠脑微血管内皮细胞分离培养及鉴定 倒置显微镜下观察分离出的微血管段呈单枝或分枝状,长约200~800 μm,直径约20~30 μm;经胶原酶消化后,微血管管壁模糊不清;3 d换液清除组织碎片和红细胞后,可见散在贴壁的梭形内皮细胞,排列不规则,核淡,胞膜明显。5 d时细胞呈细长弯曲状,7~9 d传代后经兔抗Ⅷ因子相关抗原抗体免疫细胞化学染色,胞质可见明显的棕黄色着色,阴性对照无着色。符合Ⅷ因子相关抗原的分布特点,证实培养的细胞为血管内皮细胞。见图1。
2.2 大鼠脑微血管内皮细胞生长曲线 细胞计数后,以细胞数及培养时间绘制细胞生长曲线。可见细胞在前2 d生长缓慢,第3天起迅速增长,6 d后生长减慢。由此选择传代后3~5 d进行共培养实验。见图2。
2.3 海马成体神经干细胞的分离培养与鉴定 海马分离的细胞接种到无血清培养基上,2 d后大部分细胞死亡,10%细胞贴壁,其后形成2~4个细胞团,10 d后长出大小不一的细胞团,即神经球(neurosphere)(图3),这些细胞球呈悬浮状,形态规则,细胞免疫荧光化学发光法检测均为Nestin抗原阳性(图4),可证明为神经干细胞。将上述细胞克隆经胰酶消化吹打制成单细胞悬液进行传代培养,2~4 d后单个细胞又可重新形成克隆球(图5),并表达Nestin抗原。每次传代后,均有少量细胞贴壁分化,而且随传代的次数增多,贴壁的细胞也有增多的趋势,在7~8代左右还不影响细胞的传代,而后分化加剧,大部分贴壁分化。
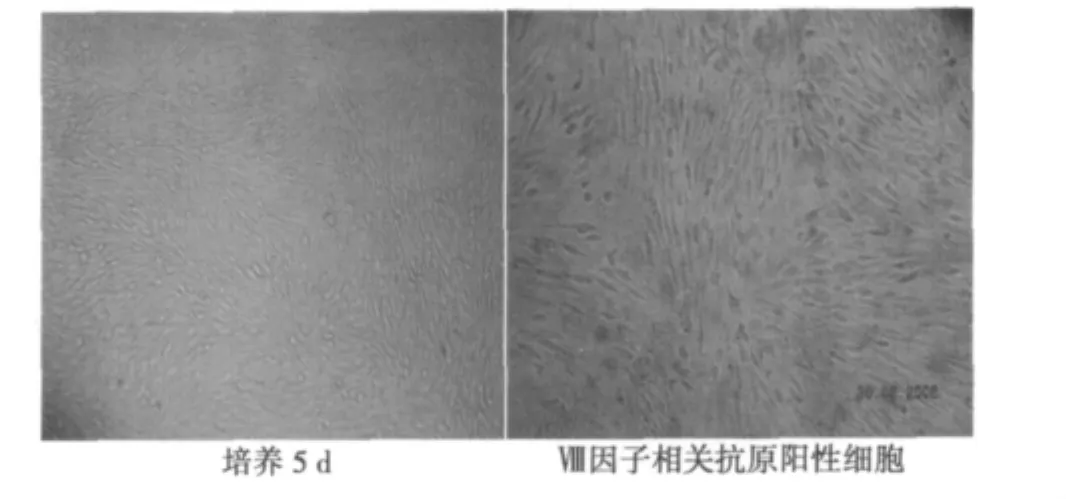
图1 倒置显微镜观察脑微血管内皮细胞(×150)
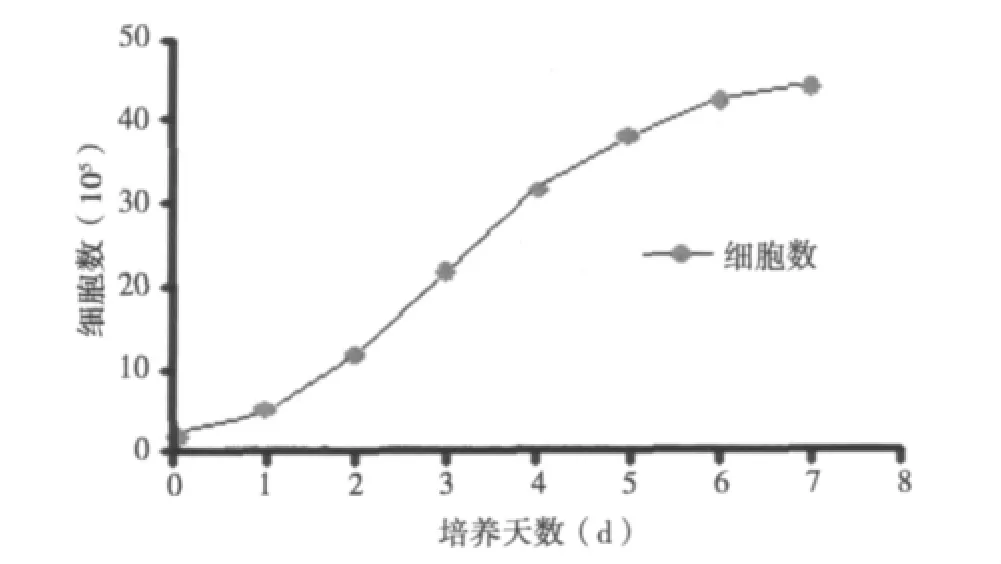
图2 大鼠脑微血管内皮细胞生长曲线

图3 培养10 d后的神经球(×200) 图4 神经干细胞Nestin荧光染色(×300)图5 继续传代培养中的神经球(×100)
2.4 免疫荧光细胞化学观察 脑微血管内皮细胞与神经干细胞共培养48 h后,经免疫荧光细胞化学方法检测,神经干细胞球 IFN-γ(图 6A、图 6B),IL-2(图 6C、图 6D),IL-4(图 6E、图6F),IL-10(图 6G、图 6H)均成阳性。见图 6。

图6 神经干细胞球免疫荧光表达(×200)
2.5 RT-PCR检测 RT-PCR检测共培养神经干细胞中细胞因子mRNA表达,共培养神经干细胞中IL-2、INF-γ mRNA的表达上调,IL-4、IL-10 mRNA 的表达下调,与空白对照组比较差异显著(P<0.01)。见图7。

图7 共培养神经干细胞中细胞因子mRNA表达
3 讨论
机体在正常状态时Th1和Th2细胞功能处于动态平衡,当机体因识别自体或异体抗原而发生免疫应答时,一旦反应向着Th1/Th2二者其中某一方向分化,则相应亚群通过自分泌方式增强其作用(正反馈),同时以旁分泌方式抑制向对方的分化。在移植免疫应答中,一般认为Th1参与同种移植的急性排斥反应,Th1细胞因子和排斥反应相关;而Th2细胞在同种移植中易于诱导移植耐受。
免疫应答中的一个重要过程是抗原提呈,即抗原提呈细胞(APC)通过捕捉和处理抗原,并以MHC分子限制形式提呈免疫活性细胞,导致后者激活产生免疫效应。移植排斥反应的关键是供、受体MHC不相容,MHC主要分为MHC-Ⅰ和MHC-Ⅱ类分子,Mason等〔4〕认为MHC-Ⅱ类抗原在诱导同种移植免疫排斥反应中起关键作用。无论是异种还是同种异体脑内移植均可存在免疫排斥反应,可能主要与MHCⅡ类分子有关,是由MHCⅡ类抗原不同而诱发的〔5〕。
神经干细胞是一种来源于神经组织或可向神经元和神经胶质细胞分化的前体细胞,很少表达MHC抗原,故一直认为神经干细胞具有极低或无免疫原性,是一种比较“纯净”的细胞群,同时缺乏APC细胞(如内皮细胞或小胶质细胞),虽然早期的NSCs无MHC表达,但随着体外传代次数增加,细胞表面开始表达MHCⅡ类分子〔6〕。侧脑室的脑室下带(Svz)和海马的颗粒下带(SGz),集中于血管周围,而且和内皮细胞间仅隔一层基板,这种解剖上的毗邻关系暗示了NScs和内皮细胞间存在密切的联系,在异基因神经干细胞移植治疗时血管内皮细胞可作APC,据此推测异基因神经干细胞移植治疗脑出血可能会发生免疫排斥反应,神经干细胞不易存活,移植手术失败。
本实验采用Transwell建立神经干细胞与脑微血管内皮细胞共培养模型,用荧光免疫化学和RT-PCR测定NSCs中与Th1相关的 IFN-γ、IL-2,与 Th2 相关的 IL-4、IL-10 的表达,结果显示两种细胞共培养后,神经干细胞呈 INF-γ,IL-2,IL-4,IL-10 阳性;并且与空白对照组比较,共培养组 IL-2,INF-γmRNA的表达上调,IL-4,IL-10mRNA 的表达下调。
IL-2、IFN-γ 和 IL-4、IL-10 分别是 Th1 与 Th2 细胞所分泌的代表性的细胞因子,在Th1/Th2分化偏移过程中发挥着独特作用。Th0向Th1/Th2分化的关键事件,是IL-12受体β链第二个亚单(IL-12Rβ2)的表达,以及由 IL-12Rβ2受体启动的信号传导。IL-12Rβ2 的表达受 IFN-γ 和 IL-4 的正负调节。IFN-γ 与IL-4、IL-10能分别促进 Th1和 Th2的分化并抑制对方的表达〔7〕。因此,若能增强 IL-4、IL-10 的表达,或抑制 IFN-γ 的作用,就可以上调Th1、下调Th2表达,而有助于移植耐受的形成。
CD4+Th细胞不同亚群在移植免疫中通过其分泌的细胞因子各自发挥着独特作用:Th1细胞分泌的IFN-γ、IL-2等参与介导移植排斥反应〔8〕;Th2 细胞分泌的 IL-4、IL-10 等则抑制CD4+Th细胞向Th1细胞分化,易于诱导移植耐受〔9〕。因此,定向调控Th细胞分化,成为诱导移植免疫耐受的策略之一。
NSCs具有无限增殖和多分化潜能。NSCs移植治疗脑出血,促进缺失的神经功能恢复具有巨大临床应用前景。因此,定向调控Th细胞亚群分化,即阻断Th1细胞及其所分泌的细胞因子的效应,或增强Th2细胞及其所分泌的细胞因子的效应已成为诱导移植免疫耐受的策略之一。
1 Svenvika M,Ekerfelt C.Increased IFN-γ response to transplantation antigens measured by cytokine MLC:indications for a bi-phasic response pattern〔J〕.Transplant Immunol,2003;11:101-5.
2 刘柏炎,黎杏群,张花先,等.海马神经干细胞的分离、培养与鉴定〔J〕. 中国现代医学杂志,2002;12(19):21-3.
3 罗文芳,黎杏群.神经干细胞移植治疗脑出血大鼠的时间窗研究〔J〕. 中国老年学杂志,2008;28(7):625-8.
4 Mason DW,Charlton HM,Jones AJ,et al.The fate of allogeneic and xenogeneic neuronal tissue transp lanted into the third ventricle of rodents〔J〕.Neuroscience,1986;19:685-94.
5 Barker RA,Ratcli EL,MaclaughlinM,et al.A role for complement in the rejection of porcine ventral mesencephalic xenografts in a rat model of Parkinson′s disease〔J〕.Neuroscience,2000;20:3415-24.
6 尹 岚,高赛里,李 莹.胚胎大鼠神经干细胞表面移植抗原的表达及调控研究〔J〕.中国神经科学杂志,2003;19:177.
7 周光炎.免疫学原理〔M〕.上海:上海科学技术文献出版社,2000:155,198,300-4.
8 Obataa F,Yoshidab K,Ohkuboc M,et al.Contribution of CD4+and CD8+T cells and interferon-gamma to the progress of chronic rejection of kidney allografts:the Th1 response mediates both acute and chronic rejection〔J〕.Transplant Immunol,2005;14:21-4.
9 He XY,Verma N,Chen J,et al.IL-5 prolongs allograft survival by downregulating IL-2 and IFN-gamma cytokines〔J〕.Transplant Proc,2001;33:703.

