用于酶热传感器的酶标甲胺磷农药的低温贮存研究
Nguyen Van-luc 徐 斐 于劲松 华泽钊
(上海理工大学低温与食品冷冻研究所 上海 200093)
作为广谱高效的有机磷杀虫剂,甲胺磷(Methamidophos,MTD)曾广泛用于世界各地。由于其对哺乳动物的高毒性以及其长期残留性,近年来国家对于甲胺磷的使用有严格的限制,甚至禁止使用于蔬菜及水果种植中。但是由于违禁使用甲胺磷而导致的安全事件仍时有发生,因此很有必要建立适用于现场检测的快速、便捷的检测方法[1]。
目前,农药残留快速检测主要基于酶抑制或免疫分析原理,结合光度法,以吸光度值作为指标,通过测定固定于载体上的残余酶活性或标记在抗体上的酶活性来间接衡量农药的残留量[2]。然而,这类光学检测易受电化学物质和光学物质(如样品颜色)的干扰,造成检测结果的误差[3]。量热方法可以克服光学方法的不足,且有通用性强的优点。但是,酶抑制法中酶与底物的反应放热量很小,测量困难;而免疫分析法中的氧化还原酶类的放热量虽然较大,但是制备单克隆抗体的成本较高[4]。因此,参考以上两种方法,基于酯酶-农药抑制剂之间的结合和免疫学中的抗体-抗原结合都是特异性结合这一原理,将酯酶看作抗体,将农药看作抗原,利用葡萄糖氧化酶(Glucose oxidase,GOx)等氧化还原酶来标记农药,制得酶标农药,并使酶标农药与待测农药竞争性地与酯酶发生抑制结合反应(见图1所示),通过检测氧化还原酶类反应体系获得较大的反应热,从而采用量热方法来快速检测农药残留。
具有一定活力稳定性的酶标农药是下一步进行农药残留检测的必要基础,但众多研究表明,具有生物活性的酶,其活性在贮存过程中降低是不可避免的。这种活性降低速率与包括温度在内的外界条件控制有关,而运用适当的保护剂和低温条件可以有效地延长不同生物活性材料的活性保存期[5-12]。采用加速实验中获得的较优保护剂配方对酶标甲胺磷的低温贮存进行了研究,考察了60℃、30℃、4℃和-18℃下保护剂对酶标农药酶活力的保护效果,并通过化学动力学(Arrhenius方程)的方法对酶标农药在-18℃的贮存期进行预测,并进行-18℃贮存条件下的实际贮存实验。

图1 量热式农药残留生物传感器的检测原理Fig.1 Detection principle of thermal pesticide residue biosensor
1 材料与方法
1.1 材料与仪器
甲胺磷 (Methamidophos,MTD) 99.0%,分析纯,购买于上海市农药研究所;2, 4, 6-三硝基苯磺酸 (TNBSA)、丁二酸酐(99%)、葡萄糖氧化酶(EC1.1.3.4, GOx)、辣根过氧化物酶 (HRP)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐 (EDC)、N-羟基丁二酰亚胺(NHS),分析纯,购买于Sigma-Aldric公司;NaCl、K2SO4、CaCl2(AR),购买于上海国药试剂有限公司; 甘油、木糖醇、半乳糖(纯度≥99%):购买于上海楷洋生物技术有限公司。
UV1700紫外分光光度计,日本岛津公司;SHZ-88台式水浴恒温振荡器,江苏太仓市实验设备厂;S22-2定时恒温磁力搅拌器,上海司乐仪器厂;SH-DpH计,上海华光仪器仪表厂;AB204-N分析天平,梅特勒-托利多; THD-4006低温恒温循环器(-40℃~100℃),宁波天恒仪器厂。
1.2 方法
1.2.1 酶标甲胺磷农药的制备
酶标物用TNBSA比色法测定酶标偶联结合比[14-15],使用的酶标物的甲胺磷与葡萄糖氧化酶偶联摩尔比测得为5:1。
1.2.2 酶标活力测定方法及酶标活力保留率的计算
采用分光光度法测定酶标农药上的GOx活力[16]。
在酶活力测定时,先分别加入0.21mM的3,3-二甲氧基联苯胺盐2.4mL,10%的(w/v)D-葡萄糖0.5mL,辣根过氧化物酶溶液(6U/mL) 0.1mL,最后加0.1mL酶标农药,空白用0.1mL蒸馏水代替酶标农药。将上述试剂混匀后,置于35℃水浴中, 在波长500nm处测定吸光度值,每隔30s记录一次吸光度(Abs), 共记录5min。酶标农药中酶活力按公式(2)计算:
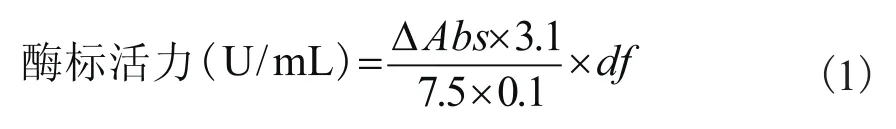
以时间为横坐标,吸光度A为纵坐标作图,其中:ΔAbs为斜率,3.1为反应总体积;df为稀释倍数;7.5为衰减系数;0.1为酶添加量,U为酶活力单位:在特定条件下,1min内转化1微摩尔底物,或者底物中1微摩尔有关基团所需的酶量,称为一个国际单位(IU,又称U)。
将配好保护剂的溶液溶解酶标液到一定的浓度,置于60℃下保温1h,立即取出冷却到4℃,测定保温前后的酶标酶活力。按下式计算,以未添加保护剂的酶标活力保留率为对照。
(3) 当同步的上一层时钟设备是双套的情况下,如果相互之间偏差超过50 ms,那么必须停止其中一台时钟设备提供时钟源,以免影响下一层设备时钟同步。

1.2.3 酶标农药的加速贮存实验
通过高温加速实验,首先筛选出较优的保护剂,然后进行正交实验,筛选出最佳的复合保护剂配方;获得最佳的复合保护剂配方之后,向酶标农药中加入最佳的复合保护剂,以未加最佳的复合保护剂的酶标农药作对照,分别在不同温度(60℃、30℃和4℃)条件下进行加速贮存实验。隔一段时间进行一次酶标活力测定,从而得到酶标农药在加速实验条件下的酶活力变化曲线,之后采用化学动力学(Arrhenius方程)的方法对酶标农药在低温条件下的贮存情况进行理论估计。
1.2.4 酶标农药的低温贮存实验
为了验证加速实验对低温条件下的理论计算结果,进行酶标在-18℃贮存条件下加保护剂和未加保护剂时的实际贮存实验。
1.2.5 数据分析
采用Minitab v.16 软件进行数据的统计分析。
2 结果与分析
2.1 保护剂筛选的加速实验
用pH=7.4的PBS溶液配制一定浓度的氯化钠、硫酸钾、氯化钙、木糖醇、半乳糖醇、甘油保护剂,按上述方法分别测定保存后酶标的酶活保留率,结果如表1。

表1 不同保护剂对酶标农药酶活稳定性的影响Tab.1 Effect of different protective agents on the stability of enzyme activity of pesticides
从表1中可见,氯化钠、硫酸钾、氯化钙三者相比,只有氯化钙对酶标的稳定性提高没有明显作用,而氯化钠、硫酸钾对酶标的酶活稳定性保留都有较好的效果,酶标酶活力保留率分别为91.08%和82.65%。氯化钠对酶标稳定性的提高主要依赖于电荷中和,硫酸钾对酶标稳定性的提高主要加强疏水相互作用与使全酶二聚体结构更紧凑[7]。三种多元醇, 除了半乳糖醇以外,木糖醇与甘油对酶标的酶活稳定性保留较好的效果。酶标农药中加入4.0mol/L的木糖醇,60℃下1h处理后的酶活保留率为83.69%,比未加保护剂的高出22.59%。在1.0mol/L甘油的浓度中,60℃条件下保存1h后的酶活保留率为86.04%,比未加保护剂的高出24.94%。由表1可见,氯化钠、木糖醇、甘油对酶标农药酶活保存的效果最佳。根据以上单因素实验结果可知,氯化钠、木糖醇、甘油是较好的保护剂,在此基础上通过正交实验来优化复合保护剂浓度,以发挥各保护剂之间的协同作用,进一步提高酶标的稳定性。实验选用L9(33),选取的因素、水平和结果见表2。
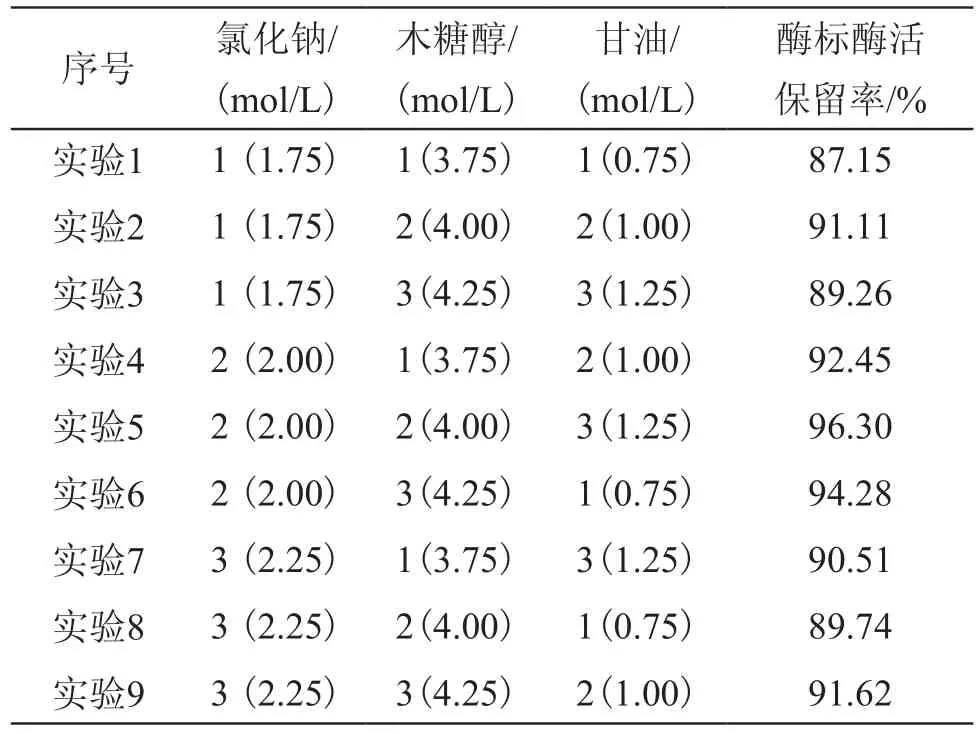
表2 复合保护剂的正交实验设计及实验结果Tab.2 Orthogonal experimental design and results of composite protective agents
通过Minitab v.16 对结果进行方差分析表明,氯化钠对酶标稳定性的影响最大,其次为甘油,木糖醇对酶标酶活保留率的影响较小,复合保护剂的最佳配方为A2B2C3:用2.0mol/L氯化钠、4.0mol/L木糖醇、1.25mol/L甘油组成的复合保护剂经60℃保存1h后酶标酶活保留率达96.30%,比未加保护剂的高出35.20%。
2.2 酶标农药低温贮存期的理论预测
基于最佳的复合保护剂配方,首先考察了酶标农药(加保护剂和未加保护剂)在不同温度条件下(60℃、30℃和4℃)酶活力随温度的变化情况,结果如图2所示。
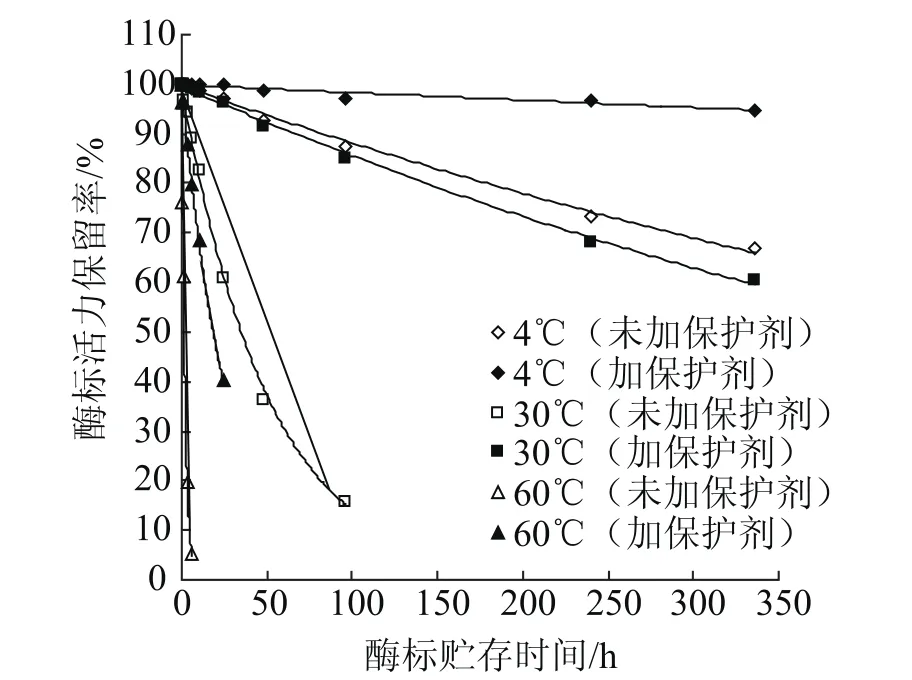
图2 酶标农药在不同温度贮存时酶活力的变化Fig.2 Enzyme activity changes of enzyme-labeled pesticides at different temperatures
酶标农药的酶活稳定性,除了自身的特点以外,主要与保存状态有关。酶的活性降低可认为是一种特殊形式的蛋白质变性反应。该变性作用常遵循一级反应动力学过程,所以酶活性与贮存时间关系可用以下关系式描述[17]:

式中,Er为残留酶活性,Eo为初始酶活性,t为贮存时间(h),k为该温度下酶活降低的速率常数。可见,残留酶活变化的快慢由k决定。相同时间内,酶活残存率的对数与k呈负线性关系。k本身是一个受多种因素影响的常数。其他条件不变情况下,k值与贮存温度T应符合Arrhenius关系,即:

式中,R是通用气体常数,E是活化能(Activation energy),A则称为Arrhenius因子,对于给定的反应,A是个常数。从贮存角度说,贮存介质条件是影响E和A的主要因素。许多酶反应速率、心搏速率、呼吸速率、变质反应速率等都符合Arrhenius关系[18]。
根据一般推荐的活化能E的数值,可以算出反应速率k随温度降低而衰减的情况。按此也可以得到生物活性残留受温度影响的关系。比如,若一生物体在4℃环境下能存活2h,那么按理论,它在-40℃能存活数日,在-80℃可以存活数月,而在-196℃(液氮温度)可望保存几个世纪[19]。
依据化学动力学的原理,基于图2中各个曲线的相关方程,得到各个温度条件下的酶活损失速率(表3)。从表3可见,温度较高时,酶标农药的酶活损失速率是比较快的,随着温度的降低,其酶活的损失速率迅速降低。低温贮存是有效保持酶标农药中的酶活力的重要手段。
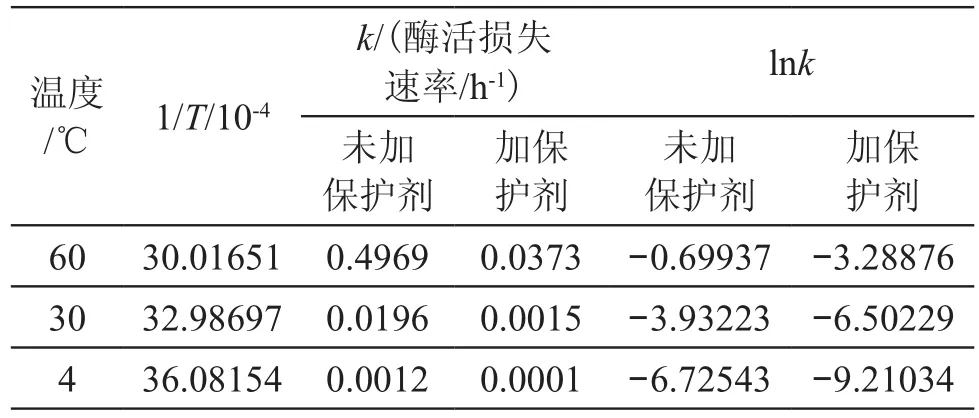
表3 各温度下的酶活损失速率Tab.3 Enzyme activity loss rate at differernt temperature
根据Arrhenius方程,lnk和1/T应呈简单的直线关系。按表3作图得到图3,经过分析发现:lnk和1/T之间的线性关系较好,且加或未加保护剂两条曲线的斜率较一致,说明加或未加保护剂对酶活损失的温度敏感性没有明显的影响。Arrhenius方程是进行单因子加速实验时最常用的动力学模型[20]。一般加速实验要选择在尽量高的温度下实施,以便在短时间内外推得到低温下的速率数据。外推结果的准确性与Arrhenius方程的适用温度范围密切相关。如果在加速高温与外推低温之间,食品发生相变、玻璃化转变等,其品质衰败的机理可能改变,高温实验得到的动力学参数在低温下不再适用,则外推结果的潜在误差很大。因此,在进行加速实验研究时,合理选择加速温度就非常重要。研究的贮藏温度范围较宽,跨越相变点,利用Arrhenius方程进行外推时,应该非常慎重,应借助实际贮存实验对外推的理论计算准确性进行验证。根据图3,在进行低温贮存实验之前,对酶标农药在低温条件下的贮存情况进行了外推的理论计算。根据Arrenius方程(图3), 理论计算得到:-18℃时酶活的损失速率常数k分别为4.99E-05(未加保护剂)和4.34E-06(加保护剂);贮存2周后,酶标农药酶活保留率分别为98.34%(未加保护剂)和99.85%(加保护剂);6个月后,酶活保留率分别为80.59%(未加保护剂)和98.14%(加保护剂);12个月后,酶标保留率为64.95%(未加保护剂)和96.31%(加保护剂)。

图3 Arrenius方程图Fig.3 Arrenius equation graph
2.3 酶标农药低温贮存的实验验证
为了验证上面的理论计算结果,进行了酶标在-18℃贮存条件下的实际贮存实验,其酶活力的变化如表4所示。根据-18℃条件下酶标的酶活力变化情况,得到其酶活损失速率常数k为:6.00E-05(未加保护剂)和6.00E-06(加保护剂),酶活损失速率常数是理论计算的1.2024倍(未加保护剂)和1.3824(加保护剂)倍(表5)。与外推的理论计算相比,在-18℃贮存条件下实际保存2周后酶活的保留率为97.98%(未加保护剂),99.79%(加保护剂);贮存6个月后,酶标农药酶活保留率为77.13%(未加保护剂),97.44%(加保护剂)。实际测试时酶活的保留率与理论计算相比,贮存2周后未加保护剂时其相对标准偏差为2.59%,加保护剂时0.04%;贮存6个月后未加保护剂时其相对标准偏差为3.10%,加保护剂时0.51%。这一结果将为下一步的农残检测酶热传感器的开发提供必要的基础。
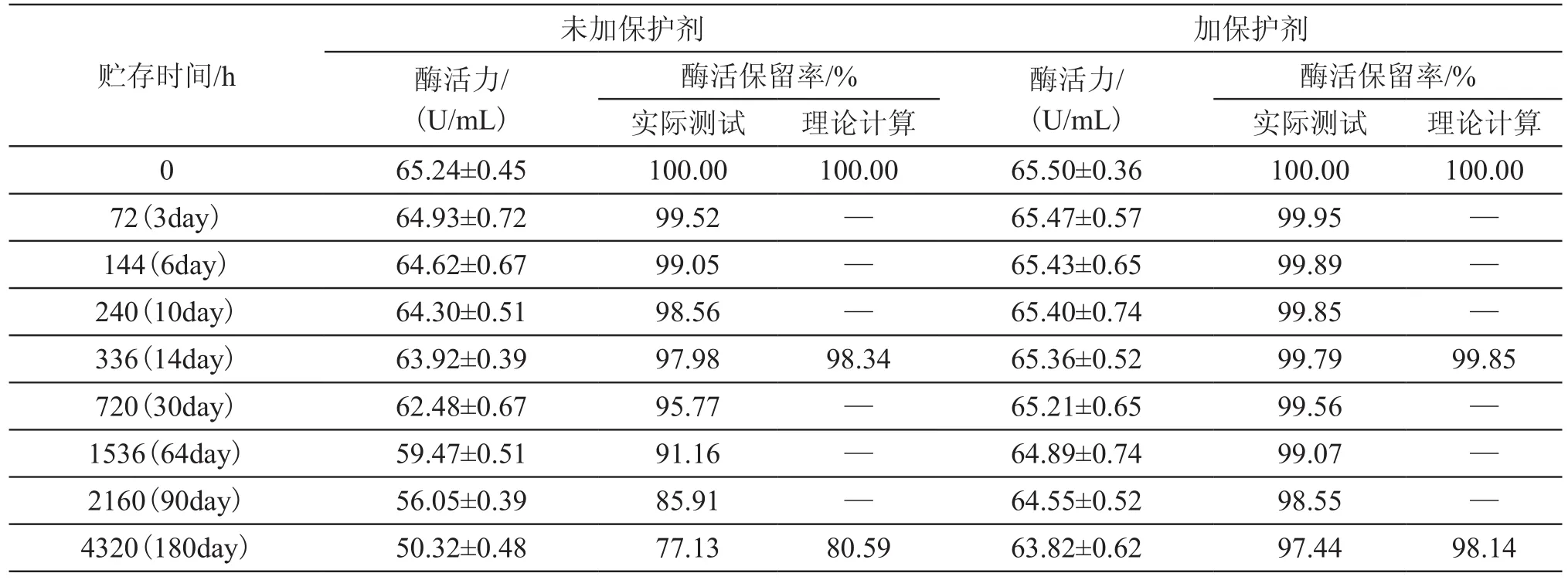
表4 酶标农药在-18℃贮存时的酶活力变化Tab.4 Enzyme activity changes of enzyme-labeled pesticides at -18℃

表5 实际验证与理论计算的k值对比Tab.5 k-value contrast between the actual veri fi cation and the theoretical
3 结论
为了提高葡萄糖氧化酶酶标甲胺磷农药的稳定性,采用加速实验获得了较优保护剂配方(2.0 mol/L氯化钠、4.0mol/L木糖醇、1.25mol/L甘油),对酶热传感器中酶标甲胺磷农药低温贮存过程中的酶活变化进行了研究,结论如下:酶标农药低温贮存期的理论预测显示:酶标农药的贮存温度与其酶活损失速率常数之间符合Arrhenius关系,利用Arrhenius方程可以预测酶标农药在低温条件下贮存时的贮存期;实际测试时,酶活损失速率常数是理论计算的1.2024倍(未加保护剂)和1.3824倍(加保护剂);低温验证试验发现在-18℃贮存条件下实际保存2周后酶活的保留率为97.98%(未加保护剂),99.79%(加保护剂);贮存6个月后,酶标农药酶活保留率为77.13%(未加保护剂),97.44%(加保护剂)。与理论预测相比,在-18℃贮存条件下实际贮存2周后二者酶活保留率的相对标准偏差为2.59%(未加保护剂)和0.04%(加保护剂);贮存6个月为3.10%(未加保护剂)和0.51%(加保护剂)。这一结论将为酶标甲胺磷农药在农药残留检测生物传感器开发中的应用打下必要的基础。
本文受上海市科委重点项目(10391901500)和上海市科技兴农重点攻关项目(2006第7- 4号)资助。(The project was supported by the Shanghai Science and Technology Commi ssion(No.10391901500)and Shanghai Agriculture Commission(2006 No.7-4).)
[1]Du Xiaofen, Dong Quan.Synthesis and identification of methamidophos artificial antigen[J]. Sience and Technology of Food Industry, 2010, 31(1):201-202.
[2]胡桐记, 高才, 周国燕, 等.低温保护剂溶液固化性质的的DSC研究[J]. 制冷学报, 2005,26(3):38-41.(Hu Tongji,Gao Cai, Zhou Guoyan, et al.Solidification Properties of Polyalcohols Aqueous Solution Studied by DSC[J].Journal of Refrigeration,2005,26(3):38-41.)
[3]郑艺华.流动注射量热式酶生物传感器关键技术研究[D].上海:上海理工大学博士论文,2004.(Zheng Yihua.Key technologies research of flow injection calorimetric biosensor[D]. Shanghai:University of Shanghai for Science and Technology doctoral dissertation,2004.)
[4]何晖, 刘宝林, 华泽钊, 等.甘油预处理对红细胞冷冻干燥保存作用的实验研究[J].制冷学报, 2006,27(4):54-58.(He Hui, Liu Baolin, Hua Zezhao, et al.Experimental Study on Effect of Pretreatment with Glycerol upon Freeze-Drying Preservation Quality of Red Blood Cells[J]. Journal of Refrigeration,2006, 27(4):5 4-58.)
[5]SANDIP B, BANKARA. Glucose oxidase-An overview[J]. Biotechnology Advances, 2009, 27(4): 489-501.
[6]EUN-HYUNG YOO, SOO-YOUN LEE.Glucose Biosensors: An Overview of Use in Clinical Practice [J].Sensors,2010,10: 4558-4576.
[7]GOUDA M D, SINGH S A, RAO A G, et al. Thermal inactivation of glucose oxidase: Mechanism and stabilization using additives[J]. Journal of Biol Chem,2003, 278(27):24-33.
[8]YE W N, COMBES D, MONSAN P. Influence of additives on the thermostability of glucose oxidase [J].Journal of Enzyme and Microbial Technology, 1988, 10(8): 498-502.
[9]WILSON R, TURNER A P F. Glucose oxidase: An ideal enzyme[J]. Biosensors and Bioelectronics,1992, 7(3):165-185.
[10]李丽霞, 俞耀庭, 鲁格. 酶稳定剂和还原剂对固定化葡萄糖氧化酶稳定性的影响[J].生物工程学报,1987,3(3):207-211.(Li Lixia,Yu Yaoting,Lu Ge. Effects of stabilizers and reducing agents on the stability of immobilized glucose oxidase[J]. Chinese Journal of Biotechnology, 1987, 3(3):207-211.)
[11]晏绍庆, 刘宝林, 华泽钊, 等. 冻结速率对草莓多酚氧化酶和过氧化物酶活性影响的初步实验研究[J].制冷学报,1999, 33(4):36-42.(Yan Shaoqing, Liu Baolin,Hua Zezhao, et al. The Elementary Experimental Study of the Effect of Freeze Rateon Strawberry s Polyphenol Oxidase and Peroxidase Activities[J]. Journal of Refrigeration,1999, 33(4):36-42.)
[12]李保国, 焦岩, 华泽钊. 食品冻结过程若干影响因素的实验研究[J]. 制冷学报, 2004,18(1):10-13.( Li Baoguo, Jiao Yan, Hua Zezhao. Experimental Analysis on Influence Factors of Food Freezing[J]. Journal of Refrigeration, 2004, 18(1): 10-13.)
[13]DZANTIEV B B. Determination of the herbicide chlorsulfuron by amperometric sensor based on separation-free bienzyme immunoassay[J]. Sensors and Actuators B:Chemical, 2004, 98(2-3):254-261.
[14]HABEEB A F S A. Determination of free amino groups in proteins by trinitrobenzenesulfonic acid[J]. Anal.Biochem., 1966, 14(3): 328-336.
[15]SASHIDHAR R B, CAPOOR A K, RAMANA D.Quantitation of ε-amino group using amino acids as reference standards by trinitrobenzene sulfonic acid, a simple spectrophotometric method for the estimation of hapten to carrier protein ratio[J]. Journal of Immunological Methods, 1993, 167:121-127.
[16]BERGMEYER H U, GAWEHN K, GRASSL M.Methods of enzymatic analysis: Vol 1 [M]. Second Edition. New York: Academic Press Inc., 1974:457- 458.
[17]殷绍辉, 肖安民. 简明食品化学[M].上海:科学技术出版社,1990.(Yin Shaohui, Xiao Anmin. Concise Food Chemistry[M]. Shanghai:Science and Technology Press,1990.)
[18]LITAL ALFONTA, EUGENII KATZ, ITAMAR WILLNER. Sensing of acetylcholine by a tricomponentenzyme layered electrode using faradaic impedance spectroscopy, cyclic voltammetry, and microgravimetric quartz crystal microbalance transduction methods[J].Anal. Chem., 2000,72(5):927-935.
[19]华泽钊, 任禾盛.低温生物医学技术[M].上海:科学出版社, 1994.(Hua Zezhao, Ren Hesheng. Low-temperature bio-medical technology[M].Shanghai:Science and Technology Press,1994.)
[20]David Kilcast, Persis Subramaniam. The stability and shelf-life of food[J]. Woodhead Publishing Limited, 2000,62-68.

