微量Ga对高压阳极铝箔腐蚀发孔性能的影响
朱兵,陈明安,张新明,林林,卢敬华,陈文,牟春
(1.中南大学 材料科学与工程学院,湖南 长沙,410083;2.西南铝业(集团)有限责任公司,重庆,401326)
制备高比电容阳极铝箔是实现高压铝电解电容器小型化、高性能化的最直接的途径。通过直流电化学腐蚀技术在铝箔表面形成大量的、均匀分布的隧道孔,可以显著提高铝箔的表面积,从而提高其比电容[1-2]。高纯铝箔的电化学腐蚀过程可分为点蚀萌生(发孔)和点蚀发展(扩孔)2个基本阶段。大量研究认为:扩孔时,隧道孔的形成是以初始蚀坑为源,在侵蚀性阴离子的作用下,沿铝箔(100)晶面法向生长所致[3-4]。因而,初始蚀坑的数量和分布,即腐蚀发孔性能对铝箔比电容的提高起着至关重要的作用。从铝箔自身性质出发,国内外诸多研究者对晶粒取向[2,5]、晶粒尺寸或晶界密度[6-7]、表面状态[8]以及微量元素含量及其分布[9-14]等对铝箔腐蚀性能的影响进行了研究。对高压阳极铝箔而言,微量元素的影响尤为重要。许多研究[9-10]证实,在铝箔中添加10-6数量级的Pb能有效提高初始蚀坑密度,促进蚀坑均匀分布,显著提高铝箔比电容。但Pb对人体的危害很大,许多国家已经禁止含Pb电子电器设备的使用,为此人们一直在寻求能取代Pb的元素。Song等[11]认为环境友好型的Sn能取代Pb使铝箔获得高的比容,Sn含量少于20×10-6时,含Sn箔比容接近于含Pb箔。实际上,人们已将相关的研究工作扩展到In[9],Bi[14]和Tl[15]等诸多元素。目前,人们的研究多集中在ⅢA~ⅤA簇的低熔点、低固溶度的金属元素对铝箔腐蚀性能的影响[9-11,14-15],而尚未涉及该区间的低熔点、高固溶度的金属元素Ga。与Sn,In等相同,Ga的标准电极电位比Al的高[16],有研究表明:Ga能提高纯铝在含氯离子溶液中的活性[17],故Ga很可能会促进铝箔在直流电化学腐蚀时蚀坑的形成,但目前缺乏相关的研究验证。更为重要的是,Ga常伴生在铝土矿中,特别是经偏析法提纯的高纯铝中存在微量的Ga[18];由此可见,研究Ga对高压铝箔腐蚀性能的影响具有重要意义。本文作者利用光学显微镜(OM)和扫描电镜(SEM)观察铝箔发孔后的腐蚀形貌,结合动电位极化曲线测试铝箔点蚀电位,研究了微量Ga对高压阳极铝箔在HCl-H2SO4溶液中直流电化学腐蚀发孔性能的影响。
1 实验
以4N高纯铝和高纯镓为原料在中频感应炉中先熔炼出Al-0.5%Ga(质量分数,下同)中间合金,再熔铸2个含Ga铝锭,Ga的名义含量分别为20×10-6,80×10-6(分别标记为G20,G80);同时熔铸1个不含Ga的高纯铝锭(G0);铸锭尺寸均为:120 mm×60 mm×20 mm(长×宽×高),各铸锭真实成分(质量分数)如表1所示。铸锭经均匀化、热轧、退火后,冷轧至0.110 mm,最后在空气炉中退火保温1 h,退火温度813 K。此外,从市场上选取国产箔(GC)和进口箔(JK),作为参照(见表1)。利用图像扫描法测定各铝箔的立方织构体积分数[19],并采用截点法测定其平均晶粒粒径。

表1 铝箔的化学成分Table1 Chemical composition of aluminum foils 10-6
将铝箔样品剪成长×宽为30 mm×20 mm,在电解槽中进行直流电化学腐蚀发孔。铝箔样品经丙酮和去离子水清洗后,装入样品夹中,使样品表面2 cm2区域暴露在电解质中。采用WYF-30V120A直流稳压电源,铝箔作阳极,高纯石墨为阴极,1 mol/L HCl+3.5 mol/L H2SO4混合溶液为腐蚀介质;控制发孔电流密度为0.2 A/cm2,电解质溶液温度为343 K,发孔时间为120 s。腐蚀发孔结束后,用去离子水充分清洗铝箔样品,并烘干。利用金相显微镜(OM)观察和拍摄铝箔样品腐蚀发孔后表面形貌,并计算各样品腐蚀区面积比[1];采用Quanta-200环境扫描电子显微镜(SEM)观察铝箔腐蚀发孔后的微观形貌。
选取自制退火态铝箔样品进行电解抛光或电解抛光+碱蚀处理。电解抛光工艺参数:高氯酸酒精溶液(体积比1:9),电压18 V,抛光时间120 s,溶液温度278 K;碱蚀工艺参数:1 mol/L NaOH溶液,溶液温度318 K,碱蚀时间1 min或5 min。
采用CHI660C电化学工作站对退火前硬态箔、退火箔、退火+电解抛光箔、退火+电解抛光+碱蚀箔进行动电位极化曲线测试。测试使用三电极系统:铝箔样品为工作电极,工作面面积1 cm2,非工作面用松香固封;Pt电极作辅助电极;饱和甘汞电极作参比电极,并通过鲁金毛细管与电解质溶液相连,所有测量的电位都相对于该参比电极(SCE)。测试所用溶液均为分析纯试剂和去离子水配制。测试采用1 mol/L HCl溶液,溶液温度298 K,动电位极化曲线测试的扫描速度为2 mV/s。
2 实验结果
2.1 立方织构体积分数和平均晶粒尺寸
表2所示为各铝箔的立方织构体积分数和平均晶粒尺寸。由表2可知:自制铝箔样品(G0,G20和G80)均获得了较高的立方织构体积分数,且其平均晶粒尺寸约200 μm,这基本符合高压阳极铝箔对立方织构体积分数和晶粒尺寸的要求。比较样品G0,G20和G80可认为,微量Ga不会阻碍强再结晶立方织构的形成;在一定程度上,Ga可能有利于再结晶立方织构的发展。
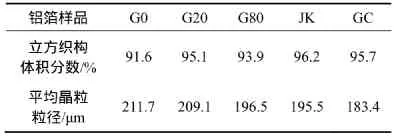
表2 各铝箔的立方织构体积分数和平均晶粒尺寸Table2 Cube texture volume fraction and average grain size of aluminum foils
2.2 腐蚀发孔形貌观察
图1所示为各铝箔样品经腐蚀发孔后的光学显微(OM)照片。可见:暗色区域为腐蚀区,亮色区域为未腐蚀区。表3所示为相应的腐蚀区面积比;图2所示为各铝箔腐蚀区的扫描电镜(SEM)照片。从图1及表3可知,G0箔腐蚀区面积比低,仅为55.7%,腐蚀区集中分布在轧制条纹附近;G20和G80箔的腐蚀区面积比均在95%以上,虽然其整体的腐蚀均匀性不是很好,存在部分未腐蚀区。从图2可见:G0箔腐蚀区内蚀坑数量相对较少,部分集中分布形成蚀坑群,还存在些许未发孔岛状区;G80箔腐蚀区内形貌起伏较大,局部区域存在集中分布的大孔径蚀坑(图2(c)方框处);但是,在G20箔腐蚀区内,蚀坑数量众多、分布均匀,孔径大小适中。由此可见,G20箔经直流电化学发孔腐蚀后,获得了良好的扩面效果。
2.3 动电位极化曲线分析
图3所示为自制铝箔G0,G20,G80在退火前后、退火+电解抛光以及退火+电解抛光+碱蚀处理不同时间后的极化曲线,其中J表示电流密度,E表示电位。其极化曲线的拟合结果如表4所示,其中Ecorr表示自腐蚀电位,Epit为点蚀电位。由表4可知:退火态G20和G80箔的点蚀电位相对其硬态箔发生负移,负移量分别约60和50 mV;而G0箔退火前后的点蚀电位差不多,均在-0.78 V左右。退火态G0,G20和G80箔经电解抛光后,点蚀电位都正移至-0.76~-0.77 V,且其钝化区间长度都达到各自的最大值,依次约为302,300,267 mV。电解抛光态铝箔经碱蚀处理后,点蚀电位再次负移;碱蚀1 min时,3种箔点蚀电位的负移量分别为27,32和28 mV;随碱蚀时间延长至5 min,G20和G80箔的点蚀电位继续负移,但G0箔的点蚀电位变化很小。总之,经电解抛光后,3种箔的点蚀电位达到各自的最高值;在其他处理状态时,G0箔的点蚀电位相差较小,而G20和G80箔的点蚀电位以退火态最负、碱蚀5 min的次之、碱蚀1 min的有所正移、而其硬态的和碱蚀1 min的较接近。

图1 铝箔腐蚀发孔后的光学显微照片Fig.1 Optical micrographic photographs of aluminum foils after pit etching

表3 铝箔的腐蚀区面积比Table3 Ratio of corrosion area of aluminum foils after pit etching %

图2 铝箔腐蚀发孔后腐蚀区SEM形貌Fig.2 SEM images of aluminum foils after pit etching
2.4 商用箔的腐蚀发孔形貌及其动电位极化曲线
图4所示为商用箔经腐蚀发孔后的微观腐蚀形貌。在298 K,1 mol/L HCl溶液中的极化曲线见图5。表5所示为相应腐蚀区面积比和电化学参数的拟合结果。可见:国产GC箔的点蚀电位约为-0.776 V;其腐蚀区面积比极低,仅为24.9%。相对GC箔,进口箔(JK箔)的点蚀电位更负,负移量约67 mV,点蚀倾向更强;其腐蚀区面积比达到99.3%,几乎全部区域都发生腐蚀,而且腐蚀区内蚀孔数量众多、分布均匀、孔径适中,扩面效果显著。
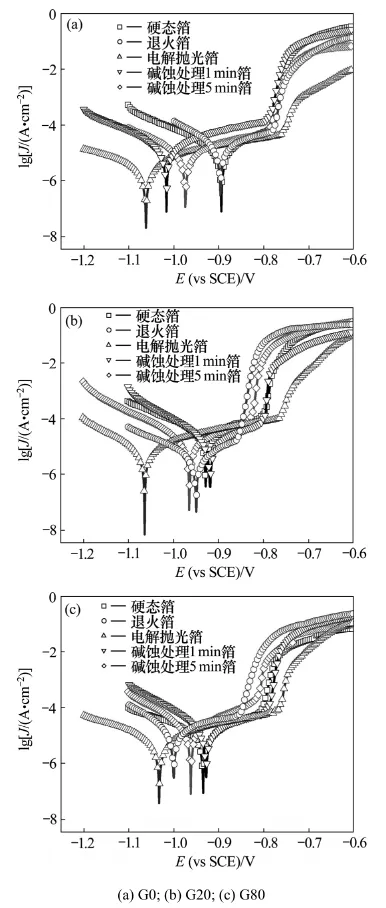
图3 自制铝箔在298 K,1 mol/L HCl溶液中的极化曲线Fig.3 Polarization curves of G0, G20 and G80 foils in 1 mol/L HCl solution at 298 K after various treatments
综观自制箔和商用箔可发现:G0和GC箔的点蚀电位最高,约-0.776 V,而腐蚀区面积比都很低;自制含Ga箔,特别是G20箔获得了和JK箔相当的腐蚀区面积比,腐蚀区内蚀孔数量、分布状态也和JK箔较接近。实际上,含Ga箔的点蚀电位比JK箔的更负,其对侵蚀性氯离子的敏感性更强,点蚀倾向更高;另外,有研究[20]认为铝箔在含氯离子溶液中的点蚀趋势还与Epit-Ecorr有关,该值越小,越易发生点蚀;据此可认为,G20会比JK箔更易发生点蚀,从而可能具备更好的腐蚀发孔性能。

表4 G0,G20和G80铝箔极化曲线的电化学参数拟合结果Table4 Fitting results of polarization curves for G0, G20 and G80 foils after various treatments

图4 商用箔腐蚀发孔后的微观形貌Fig.4 Corrosion morphologies of JK and GC foils after pit etching

表5 商用箔极化曲线拟合结果及其腐蚀区面积比Table5 Fitting results of polarization curves and ratio of corrosion area for JK and GC foils

图5 JK和GL箔在298 K,1 mol/L HCl溶液中的极化曲线Fig.5 Polarization curves of JK and GC foils in 1 mol/L HCl solution at 298 K
3 讨论
研究结果表明,不同成分铝箔或同一成分铝箔在不同处理状态时,其点蚀电位间存在或大或小的差异(表4)。实际上,从材料自身属性考虑,影响点蚀电位的因素主要包括表层成分、表面状态、缺陷密度等;退火、电解抛光或碱蚀能改变其中一个或多个因素,从而使铝箔点蚀电位发生变化。
退火态铝箔经电解抛光后,箔表层数微米被溶解,获得光洁表面,此时,3种铝箔的晶界等缺陷密度水平、表面状态均相近。而Ashitaka等[21]的研究发现Al-0.13%Ga合金经电解抛光后,Ga并未在合金表面富集;故可认为,3种电解抛光态铝箔表面Ga含量接近基体Ga含量,差别较小。而且,纯铝经电解抛光后,表面会形成钝化膜,掩盖了Ga含量的差异对铝箔点蚀电位的影响。因而,3种自制铝箔经电解抛光后,点蚀电位均位于-0.76~-0.77 V之间(图3),这与Nisancioglu等[22]所测得的纯Al在含氯离子溶液中的点蚀电位接近。相对于电解抛光态铝箔,硬态箔的点蚀电位低,这是因为硬态箔表面具有高密度的位错露头、晶界以及轧痕等缺陷,电化学腐蚀时,晶界等晶体缺陷会优先作为腐蚀起点,因而硬态箔可在更负的电位下发生点蚀;而硬态箔间点蚀电位的差别可能和Ga含量或其他因素有关。相对于硬态箔,退火态铝箔的位错、晶界等缺陷密度水平显著降低,但其点蚀电位反而比硬态箔的更负(图3(b),(c))或差不多(图3(a)),这和退火时微量元素在箔表面的富集有关。此外,退火态含Ga箔的点蚀电位比G0箔的更负则主要与Ga在表面富集有关。
电解抛光态铝箔经碱蚀处理后,点蚀电位负移,负移量与碱蚀时间、样品成分密切相关。碱蚀1 min时,3种铝箔各自点蚀电位的负移量均约为30 mV;随碱蚀时间延长至5 min,不含Ga的G0箔,其点蚀电位与该箔碱蚀1 min时的点蚀电位差不多,而G20和G80箔的点蚀电位继续负移,相对各自电解抛光态,负移量达到50~60 mV。实际上,大量研究发现[21,23-24],当氧化物的标准生成吉布斯自由能比Al2O3高的元素存在于高纯铝中,在碱蚀处理时,该元素会在合金表面富集。Cu和Ga都属于这类元素[21,23];然而,与Ga不同的是,Cu在电解抛光时就在合金表面发生富集[25];因而,含Ga箔经碱蚀处理后,Ga在铝箔表面发生富集,而Cu的分布状态保持与电解抛光态的差不多。利用RBS和SIMS等表面分析技术检测Al-Ga低合金经碱蚀处理后Ga的分布状况发现,Ga在合金表面发生显著富集[21,26-27];如Al-0.5%Mg-85×10-6Ga合金碱蚀5 min后,Ga在合金表面的富集浓度达到4.6%(摩尔分数)[27]。显然,Ga在铝箔表面的富集程度会随碱蚀时间的延长而提高。碱蚀1 min时,铝箔表面溶解掉的金属层很薄,Ga的富集程度低,其对铝箔点蚀电位的影响较小;故碱蚀1 min后,含Ga箔和不含Ga箔的点蚀电位差不多,此时3种铝箔点蚀电位的负移(相对各自电解抛光态)与表面钝化膜的破坏有关。对于G20和G80箔,碱蚀5 min后,箔表面近微米厚的金属层被溶解,其内所含Ga富集在几纳米厚的表面层中,由此可粗略推测Ga的表面浓度提高近百倍,其原子数分数接近10-2数量级。富集在箔表面的Ga能显著提高铝箔在含氯离子溶液中的电化学活性,使其点蚀电位负移[17,28]。由此可知,碱蚀5 min后,相对G0箔,含Ga箔点蚀电位的负移能很好反映出Ga在箔表面的富集。
理论分析表明,与碱蚀处理类似,含Ga箔在空气炉中进行退火时,Ga亦会在箔表面发生富集。这是因为Ga原子半径比Al原子半径大,其存在于铝箔基体中时,造成铝晶格畸变,使体系能量升高;而当Ga原子位于箔表面时,能极大地降低纯铝的表面能。因而,在适当的热激活条件下,Ga原子在畸变能和表面能的驱动下会向铝箔表面富集。但目前关于微量Ga在热处理时向铝箔表面富集的实验验证还很少。有研究认为:微量Ga在退火时极可能会在高纯铝表面富集[29]。本文结果也间接地印证了这点:3种退火态铝箔的立方织构体积分数、平均晶粒尺寸以及表面状态等影响点蚀电位的因素均很接近;除Ga外,3种铝箔基体中其他元素含量接近,经退火后这些元素在表面的富集程度也差不多;但实验结果却表明,退火态含Ga箔的点蚀电位比G0箔的点蚀电位负移约80 mV,类比碱蚀5 min后各铝箔点蚀电位的差异,可认为此时Ga亦在含Ga箔的表面发生了富集。这也很好解释了退火前后,含Ga箔点蚀电位负移大,而G0箔点蚀电位负移小的现象。故与Pb和Sn等类似,退火亦能使微量Ga在铝箔表面富集,这对铝箔在非重铬酸盐腐蚀体系中的腐蚀发孔有着积极的意义。值得注意的是,本文所测点蚀电位属于铝箔的宏观性能,它的负移虽能反映出Ga在铝箔表面发生富集,但并不能反映出Ga在箔表面的微观分布状态以及Ga的具体富集程度;因而,微量Ga在箔表面区域的富集及其分布状态有待进一步定量研究。
富集在箔表面区域的Ga,主要通过2种途径影响铝箔的点蚀行为:(1)Ga/Ga3+的标准电极电位比Al/Al3+的高,电化学腐蚀时,Ga与Al形成众多微观腐蚀原电池,Ga作为阴极而Al作为阳极,Ga的存在加快电子的转移,促进Al的溶解;(2)当电极电位超过零电荷电位时,固溶的Ga有利于氯离子的吸附,即提高氯离子在箔表面的吸附浓度[30],氯离子浓度的提高能加速表面钝化膜的破坏,增强铝箔的点蚀倾向。故在相同的腐蚀发孔电化学条件下,相对于G0箔,点蚀电位更负的G20和G80箔更易发生点蚀,点蚀形核率更高,表现为腐蚀区面积比显著提高(图1),蚀坑数量增多等(图2)。
铝箔点蚀电位和腐蚀区面积比间的关系如图6所示。由图6可知,点蚀电位和腐蚀区面积比间存在较好的对应关系:点蚀电位在-0.85 V左右的铝箔,腐蚀区面积比均在95%以上;而点蚀电位在-0.78 V左右的箔,腐蚀区面积比低。当然,除微量元素含量外,影响铝箔腐蚀发孔的因素还包括微量元素种类、组织结构、晶粒尺寸和表面状态等。含Ga 箔的腐蚀区面积比比JK箔的稍低,就与这些因素,特别是表面状态有关;而G0箔的腐蚀区面积比较GC箔的高,则主要和G0箔中更高的Cu含量有关。
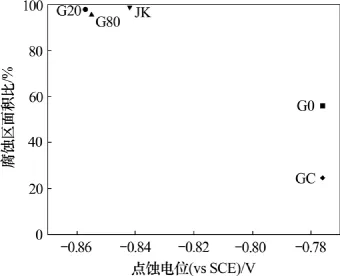
图6 退火态铝箔点蚀电位和腐蚀区面积比的关系Fig.6 Relationship between pitting potential and ratio of corrosion area for annealed foils
铝箔表面不可避免地存在位错露头、晶界、轧制条纹、划伤等缺陷;微量元素会优先在这些缺陷,特别是畸变能更高的轧制条纹和划伤处聚集。均匀细小的轧制条纹有利于微量元素在表面均匀分布,从而使铝箔获得均匀的腐蚀结构(图4(a),(c))。在制备过程中,自制含Ga箔变形均匀性不及商用箔,且表面存在退火油斑,经腐蚀发孔后存在部分未腐蚀区(图1(b),(c));但在腐蚀区内,特别是在G20箔内,蚀坑数量、尺寸及分布均匀性可以和JK箔的相近(图2(b),图4(c))。当基体中Ga含量增加时,Ga在箔表面的富集程度提高,但Ga会更多地在表面缺陷处富集,即Ga在箔表面的分布均匀性降低;这使得铝箔的腐蚀均匀性降低,局部区域形成粗大蚀坑(图2(c))。由此可见,在铝箔中添加20×10-6的Ga可显著改善其在HCl-H2SO4腐蚀体系中的腐蚀发孔性能,进而提高铝箔比电容。
4 结论
(1)退火态含Ga箔经电解抛光后,点蚀电位达到最大值,并和相同状态的不含Ga箔的接近,位于-0.76~-0.77 V之间。再经碱蚀处理后,点蚀电位负移;碱蚀1 min,点蚀电位的负移量约30 mV,这和表面钝化膜的破坏有关;碱蚀5 min,负移量达到50~60 mV,此时Ga在表面的富集起着重要作用。
(2)含Ga箔在空气炉中高温退火时,Ga会在箔表面发生富集,其点蚀电位相对于不含Ga箔的朝负电位方向偏移,其负移量约为80 mV。Ga在箔表面的富集能提高铝箔对氯离子的敏感性,使铝箔点蚀倾向增强。
(3)在铝箔中添加约20×10-6的Ga可显著改善其在HCl-H2SO4腐蚀体系中的腐蚀发孔性能,极大提高腐蚀区面积比,获得数量众多,孔径适中,分布均匀的初始蚀坑;当Ga含量增多至80×10-6时,腐蚀发孔区面积比稍有下降,腐蚀区内局部区域形成粗大蚀坑,腐蚀发孔性能有所降低。
[1]刘建才, 张新明, 陈明安, 等.最终退火工艺和腐蚀预处理对铝箔发孔性能的影响[J].中国有色金属学报, 2010, 20(11):2199-2205.LIU Jian-cai, ZHANG Xin-ming, CHEN Ming-an, et al.Influence of final-annealing and pretreatment before etching on pitting ability of aluminum foils[J].The Chinese Journal of Nonferrous Metals, 2010, 20(11): 2199-2205.
[2]李东, 毛卫民.晶面指数对高纯铝表面腐蚀发孔的影响[J].中国有色金属学报, 2008, 18(10): 1802-1806.LI Dong, MAO Wei-min.Influence of surface indices of high purity aluminum crystals on initiation process of pit etching[J].The Chinese Journal of Nonferrous Metals, 2008, 18(10):1802-1806.
[3]Ono S, Makino T, Alwitt R S.Crystallographic pit growth on aluminum (100)[J].Journal of the Electrochemical Society, 2005,152(2): B39-B44.
[4]Jeong J, Chol C, Lee D N.A model for the <100>crystallographic tunnel etching of aluminum[J].Journal of Materials Science, 1996, 31(21): 5811-5815.
[5]Treacy G M, Breslin C B.Electrochemical studies on single-crystal aluminum surfaces[J].Electrochimica Acta, 1998,43(12/13): 1715-1720.
[6]MENG Guo-zhe, WEI Li-yan, ZHANG Tao, et al.Effect of microcrystallization on pitting corrosion of pure aluminum[J].Corrosion Science, 2009, 51(9): 2151-2157.
[7]毛卫民, 陈垒, 萨丽曼, 等.晶界对低压电解电容器铝箔腐蚀结构的影响[J].中国有色金属学报, 2004, 14(1): 1-5.MAO Wei-min, CHEN Lei, SA Li-man, et al.Influence of grain boundaries on corrosion structure of low voltage aluminum foil[J].The Chinese Journal of Nonferrous Metals, 2004, 14(4):1-5.
[8]蒋恒, 毛卫民, 杨平, 等.低压阳极铝箔表面状态对铝箔点蚀行为的影响[J].材料工程, 2005(2): 22-25.JIANG Heng, MAO Wei-min, YANG Ping, et al.Influence of surface state on the pitting corrosion behaviors of low voltage aluminum foil[J].Journal of Materials Engineering, 2005(2):22-25.
[9]Lin W, Tu G C, Lin C F, et al.The effect of lead impurity on the DC-etching behavior of aluminum foil for electrolytic capacitor usage[J].Corrosion Science, 1996, 38(6): 889-907.
[10]Chen H C, Ou B L.Effects of trace lead on etching of aluminum electrolytic capacitor foil[J].Journal of Materials Science:Materials in Electronics, 2004, 15(12): 819-823.
[11]SONG Jing-bo, MAO Wei-min, YANG Hong, et al.Effect of trace Sn on corrosion behaviors of high voltage anode aluminum foil[J].Transactions of Nonferrous Metals Society of China,2008, 18(4): 879-883.
[12]毛卫民, 杨宏, 余永宁, 等.微量Mg对高压电子铝箔腐蚀结构的影响[J].中国有色金属学报, 2003, 13(5): 1057-1060.MAO Wei-min, YANG Hong, YU Yong-ning, et al.Influence of trace Mg on corrosion structure of high voltage aluminum foil[J].The Chinese Journal of Nonferrous Metals, 2003, 13(5):1057-1060.
[13]MAO Wei-min, JIANG Heng, YANG Ping, et al.Distribution of microelements and their influence on the corrosion behavior of aluminum foil[J].Journal of Materials Science and Technology,2005, 21(1): 43-46.
[14]Ashitaka Z, Thompson G E, Skeldon P.Behavior of bismuth during simulated processing of model aluminum capacitor foils[J].Journal of Materials Science, 2001, 36(9): 2237-2243.
[15]Mance A, Cerović D, Mihajlović A.The effect of small additions of indium and thallium on the corrosion behavior of aluminum in sea water[J].Journal of Applied Electrochemistry,1984, 14(4): 459-466.
[16]曹楚南.腐蚀电化学原理[M].2版.北京: 化学工业出版社,2004: 326-327.CAO Chu-nan.Second Edition: Principles of electrochemistry of corrosion[M].2nd ed.Beijing: Chemical Industry Press, 2004:326-327.
[17]Flamini D O, Saidman S B, Bessone J B.Aluminum activation produced by gallium[J].Corrosion Science, 2006, 48(6):1413-1425.
[18]杨宏, 毛卫民.铝电解电容器铝箔的研究现状和技术发展[J].材料导报, 2005, 19(9): 1-4.YANG Hong, MAO Wei-min.Present research status and technology development of aluminum foil for electrolytic capacitor[J].Materials Review, 2005, 19(9): 1-4.
[19]张新明, 肖亚庆, 刘胜胆, 等.电解电容器用高纯铝箔立方织构比例的测定方法: 中国, 200410023071[P].2005-10-12.ZHANG Xin-ming, XIAO Ya-qing, LIU Sheng-dan, et al.Determination of the cube texture fraction of high purity aluminum foils for electrolytic capacitor usage: China,200410023071[P].2005-10-12.
[20]BAN Chao-lei, HE Ye-dong.Controlling limiting length of tunnels on Al foil electro-etched in HCl-H2SO4solution[J].Transactions of Nonferrous Metals Society of China, 2009, 19(3):601-605.
[21]Ashitaka Z, Skeldon P, Thompson G E, et al.Enrichment behavior of gallium in heat and surface treatments of Al-Ga foils[J].Corrosion Science, 2002, 44(12): 2725-2735.
[22]Nisancioglu K, Holtan H.Measurement of the critical pitting potential of aluminum[J].Corrosion Science, 1978, 18(9):835-849.
[23]Ashitaka Z, Thompson G E, Skeldon P, et al.The behavior of copper and lead during heat treatment and surface treatment of aluminum capacitor foils[J].Journal of the Electrochemical Society, 1999, 146(4): 1380-1385.
[24]Caicedo-Martinez C E, Koroleva E, Skeldon P, et al.Behavior of impurity and minor alloying elements during surface treatments of aluminum[J].Journal of the Electrochemical Society, 2002,149(4): B139-B145.
[25]Zhou X, Thompson G E, Habazaki H, et al.Copper enrichment in Al-Cu alloys due to electropolishing and anodic oxidation[J].Thin Solid Films, 1997, 293(1/2): 327-332.
[26]Margadant N, Skeldon P, Textor M, et al.Gallium enrichment and film detachment during anodizing of an Al-Ga alloy[J].Corrosion Science, 2000, 42(3): 405-419.
[27]Markus A, Marcus T.Applications of surface-analytical techniques to aluminum surfaces in commercial semifabricated and finished products[J].Surface and Interface Analysis, 1992,19(1): 595-600.
[28]Flamini D O, Saidman S B, Bessone J B.Electrodeposition of gallium and zinc onto aluminum.Influence of the electrodeposited metals on the activation process[J].Thin Solid Films, 2007, 515(20/21): 7880-7885.
[29]ZHANG Xin-ming, LIU Jian-cai, TANG Jian-guo, et al.Element segregation on the surfaces of pure aluminum foils[J].Applied Surface Science, 2010, 256(23): 7300-7304.
[30]Shayeb H A E, Abd Wahab F M, Abedin S Z.Effect of gallium ions on the electrochemical behavior of Al, Al-Sn, Al-Zn and Al-Zn-Sn alloys in chloride solutions[J].Corrosion Science,2001, 43(4): 643-654.

