VEGF-C、MT1-MMP在乳腺癌淋巴管生成过程中的共表达机制
姚广裕,何 萍,杨名添,刘民锋,叶长生
(1南方医科大学南方医院,广州 510515;2广州医学院第一附属医院;3中山大学附属肿瘤医院)
淋巴道转移是恶性肿瘤最常见的转移途径之一,但转移的机制尚不完全清楚。近年来,肿瘤新生淋巴管的发现使人们对肿瘤淋巴道转移的机制有了新的认识,即肿瘤的新生淋巴管在肿瘤的淋巴道转移中可能起主导作用[1]。目前研究认为,肿瘤细胞分泌的血管内皮生长因子C(VEGF-C)可促进肿瘤内新的淋巴管形成[2];膜型基质金属蛋白酶-1(MT1-MMP)也参与淋巴管生成过程[3]。而VEGFC和MT1-MMP的表达均与表皮生长因子受体2(ErbB2)基因有关[4,5]。近年来,我们观察了乳腺肿瘤细胞淋巴道转移过程中促进VEGF-C和MT1-MMP分泌的共同机制,旨在认识肿瘤淋巴管生成和淋巴道转移的机制。
1 材料与方法
1.1 材料 MT1-MMP、VEGF-C抗体(NeoMarkers公司);ErbB2抗体(Oncogene公司);Western blot二抗试剂盒(Santa Cruz公司);ECL发光剂(Amersham Biosciences公司);曲妥珠单抗(罗氏公司惠赠)。人乳腺癌细胞株MCF-7为南方医科大学肿瘤研究所保存。
1.2 实验方法
1.2.1 细胞培养、分组及干预 乳腺癌细胞株MCF-7用含10%胎牛血清DMEM培养液培养。实验中将乳腺癌细胞株MCF-7分为4组:空白对照组不干预、转染组转入ErbB2基因(将ErbB2基因克隆至真核表达质粒pcDNA3.1,经测序鉴定后,用LipofectamineTM脂质体转染入乳腺癌细胞MCF-7,转染2 d后,改用含G418的培养基筛选出分别能够稳定表达ErbB2的MCF-7克隆)、空白质粒组加入空白质粒、加药组转染ErbB2后加入曲妥珠单抗,浓度为10 μg/L。
1.2.2 VEGF-C、MT1-MMP蛋白表达检测 细胞长至70%汇合度时,4℃ PBS液洗2次,用含SDS细胞裂解液1 mL裂解,将蛋白在沸水中煮5 min,每孔50 μg上样于聚丙烯酰胺凝胶,浓缩胶浓度为5%,分离胶浓度为10%。电泳条件:浓缩胶,恒压50 V,40 min;分离胶,恒压80 V,2.5 h。蛋白转移到硝酸纤维素膜,抗体1∶500稀释,4℃孵育过夜;1∶1 500稀释HRT标记的二抗,室温孵育2 h。以ECL为发光剂,暗室中X曝光时间为30 s,自动冲片机冲洗。
1.2.3 VEGF-C、MT1-MMP mRNA 表达检测 按Trizol试剂盒说明抽提培养细胞总RNA后测吸光度值(A260/A280比值),计算RNA纯度;后吸取相同计量的RNA(5 μg)按照MBI公司逆转录试剂盒具体操作按说明合成cDNA。合成的cDNA经PCR扩增,MT1-MMP:5'-CAGAGAAGGCACACAAACGA-3',5'-CACTGGTGAGACAGGCTTGA-3',172 bp;VEGFC:5'-ACCTGCCCCACCAATTACA-3',5'-GCCTCTTGTAAAGACTGGTT-3',763 bp;GAPDH:5'-CGGAGTCAACGGATTTCGTAT-3';5'-AGCCTTCTCCATGGTGGTGAAGAC-3',320 bp。PCR反应条件:94℃预变性5 min;94 ℃、50 s,57 ℃、1 min,72 ℃、1 min 进行30个循环;72℃延伸10 min。产物于2%琼脂糖凝胶电泳后染色、摄片。
2 结果
2.1 VEGF-C、MT1-MMP蛋白表达 对照组和空白质粒组仅检测到少量的VEGF-C和MT1-MMP蛋白的表达;转染组可检测到VEGF-C和MT1-MMP蛋白表达明显增强,加药组在加入药物后,VEGF-C和MT1-MMP蛋白表达受到明显抑制(见图1)。
2.2 VEGF-C、MT1-MMP mRNA表达 对照组和空白质粒组仅检测到微弱的VEGF-C和MT1-MMP mRNA表达,而转染组可检测到VEGF-C和 MT1-MMP mRNA表达明显增强,加药组在加入药物后,VEGF-C和MT1-MMP mRNA表达明显受到抑制(见图2、图3)。
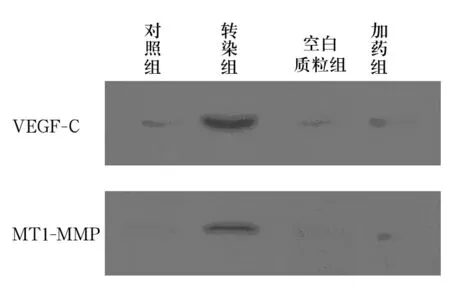
图1 各组VEGF-C、MT1-MMP蛋白表达
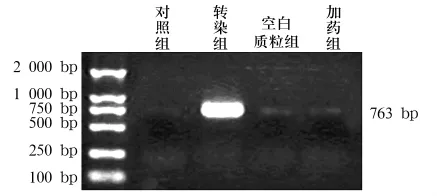
图2 各组VEGF-C mRNA表达
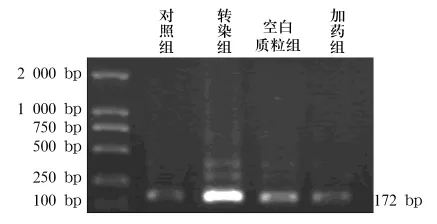
图3 各组MT1-MMP mRNA表达
3 讨论
淋巴道转移是乳腺癌的常见转移途径,是决定乳腺癌分期和选择治疗方案最关键的因素之一。基础和临床研究表明,肿瘤新生淋巴管是促进乳腺癌癌细胞的淋巴道转移的主要因素[6,7];无论乳腺癌、肺癌、甲状腺癌还是胃癌、食管癌、大肠癌组织内新生淋巴管标记物的表达均与淋巴结转移相关[6~8]。目前研究表明,肿瘤促使淋巴管新生是肿瘤细胞分泌的生长因子调控的,VEGF-C是其中的主要因子之一,其与淋巴上皮细胞表面的受体VEGFR3结合后,通过酪氨酸激酶信号系统发挥作用,促进淋巴管上皮的增生、迁移和新的淋巴管形成[9]。
新生淋巴内皮增生形成管状结构后,须伸穿入周围基质,方才能形成新的淋巴管网[10],这一过程一定伴随着肿瘤基质的降解和重建,最终使新生淋巴管成为肿瘤内间质的组成部分。基质降解和重建首先是一个基质组分的酶解过程,参与这一过程的主要酶类是基质金属蛋白酶家族(MMPs)。MMPs是一族Zn2+依赖性内肽酶,MT1-MMP属于膜型的MMPs。MT1-MMP通过跨膜结构域固定于细胞膜表面发挥作用,不仅可直接降解诸如胶原、纤维结合蛋白等基质组分,且可激活MMP-2降解多种基质成分。本实验证实,MT1-MMP降解基质主要是通过后一种机制[11]。Nisato 等[3]研究发现,在体外淋巴上皮三维培养过程中,可以检测到MT1-MMP mRNA的表达增加。Nakamura等不仅在体外淋巴上皮培养过程中检测到MT1-MMP mRNA,且用MMPs抑制剂MMI270抑制MT1-MMP的活性能够抑制淋巴上皮细胞的迁移能力。由此可见,MT1-MMP在淋巴管生成过程中发挥着重要作用。
目前,关于VEGF-C和MT1-MMP共表达机制的相关报道鲜见,VEGF-C或MT1-MMP与ErbB2关系报道亦较少。其中VEGF-C与ErbB2关系的研究报道结论比较一致。早期的研究多采用免疫组化的方法研究手术标本中VEGF-C与ErbB2的关系,都认为乳腺癌中VEGF-C的表达与ErbB2蛋白表达呈正相关[4,12],且大胆的推测 ErbB2 基因可能调控VEGF-C 的表达[13]。Su 等[14]的研究从分子层面提示ErbB2信号系统的激活可增加VEGF-C的表达。但是,关于MT1-MMP与ErbB2关系的研究报道的结果很不一致,同样采用免疫组化的方法,Mylona等[15]报道 MT1-MMP蛋白与ErbB2蛋白表达不相关,而 Ishigaki等[16]却认为二者有正相关关系。Jang等[17]的研究也提示证实ErbB2信号系统的激活可以增加MT1-MMP的表达。
本研究空白对照组、空白质粒组仅检测到少量的VEGF-C和MT1-MMP蛋白、mRNA的表达;转染组可以检测到VEGF-C和MT1-MMP蛋白、mRNA表达明显增强;加药组在加入药物后,VEGF-C和MT1-MMP蛋白表达受到明显抑制。提示VEGF-C和MT1-MMP在肿瘤的浸润和转移过程中的表达存在某种共同的调控机制,揭示二者在肿瘤进展中的相互作用关系。由此我们推测,在恶性肿瘤淋巴道转移过程中,某些信号系统如ErbB2信号系统的激活可以同时促进VEGF-C和MT1-MMP在肿瘤细胞的表达,此时VEGF-C可以促进淋巴管上皮的增生、迁移,而MT1-MMP则通过降解肿瘤周围的间质,为新的淋巴管延伸清除基质屏障,从而共同促进新生淋巴管形成,促使肿瘤细胞转移。
综上所述,VEGF-C和MT1-MMP在乳腺癌中存在共同表达的机制,二者均受ErbB2基因的调控,MT1-MMP可能参与了乳腺癌的淋巴管生成。
[1]Nagahashi M,Ramachandran S,Rashid OM,et al.Lymphangiogenesis:a new player in cancer progression[J].World J Gastroenterol,2010,16(32):4003-4012.
[2]Fang C,Miguel MA,Avis I,et al.Non-peptide small molecule regulators of lymphangiogenesis[J].Lymphat Res Biol,2009,7(4):189-196.
[3]Nisato RE,Harrison JA,Buser R,et al.Generation and characterization of telomerase-transfected human lymphatic endothelial cells with an extended life span[J].Am J Pathol,2004,165(1):11-24.
[4]Yavuz S,Paydas S,Disel U,et al.VEGF-C expression in breast cancer:clinical importance[J].Adv Ther,2005,22(4):368-380.
[5]Jang JY,Jeon YK,Kim CW.Degradation of HER2/neu by ANT2 shRNA suppresses migration and invasiveness of breast cancer cells[J].BMC Cancer,2010,(10):391.
[6]Tsutsui S,Matsuyama A,Yamamoto M,et al.The Akt expression correlates with the VEGF-A and-C expression as well as the microvessel and lymphatic vessel density in breast cancer[J].Oncol Rep,2010,23(3):621-630.
[7]Wu M,Han L,Shi Y,et al.Development and characterization of a novel method for the analysis of gene expression patterns in lymphatic endothelial cells derived from primary breast tissues[J].J Cancer Res Clin Oncol,2010,136(6):863-872.
[8]Nakamura Y,Yasuoka H,Tsujimoto M,et al.Lymph vessel density correlates with nodal status,VEGF-C expression,and prognosis in breast cancer[J].Breast Cancer Res Treat,2005,91(2):125-132.
[9]Ran S,Volk L,Hall K,et al.Lymphangiogenesis and lymphatic metastasis in breast cancer[J].Pathophysiology,2010,17(4):229-251.
[10]Goldman J,Le TX,Skobe M,et al.Overexpression of VEGF-C causes transient lymphatic hyperplasia but not increased lymphangiogenesis in regenerating skin[J].Circ Res,2005,96(11):1193-1199.
[11]姚广裕,曾木圣,林鹏,等.膜型基质金属蛋白酶-1对乳腺癌细胞浸润能力的影响[J].中华肿瘤杂志,2006,(9):650-653.
[12]Hoar FJ,Chaudhri S,Wadley MS,et al.Co-expression of vascular endothelial growth factor C(VEGF-C)and c-ErbB2 in human breast carcinoma[J].Eur J Cancer,2003,39(12):1698-1703.
[13]Schoppmann SF,Tamandl D,Roberts L,et al.HER2/neu expression correlates with vascular endothelial growth factor-C and lymphangiogenesis in lymph node-positive breast cancer[J].Ann Oncol,2010,21(5):955-960.
[14]Su JL,Shih JY,Yen ML,et al.Cyclooxygenase-2 induces EP1-and HER-2/Neu-dependent vascular endothelial growth factor-C upregulation:a novel mechanism of lymphangiogenesis in lung adenocarcinoma[J].Cancer Res,2004,64(2):554-564.
[15]Mylona E,Nomikos A,Magkou C,et al.The clinicopathological and prognostic significance of membrane type 1 matrix metalloproteinase(MT1-MMP)and MMP-9 according to their localization in invasive breast carcinoma[J].Histopathology,2007,50(3):338-347.
[16]Ishigaki S,Toi M,Ueno T,et al.Significance of membrane type 1 matrix metalloproteinase expression in breast cancer[J].Jpn J Cancer Res,1999,90(5):516-522.
[17]Jang JY,Jeon YK,Kim CW.Degradation of HER2/neu by ANT2 shRNA suppresses migration and invasiveness of breast cancer cells[J].BMC Cancer,2010,(10):391.

