慢性脑缺血大鼠海马CA1区锥体细胞树突形态及树突棘密度的变化*
贾 贺,张博爱,刘 宇,张小敏,姬亚杰,李 星,刘荣丽
(郑州大学第一附属医院神经内科,河南 郑州 450052)
海马是大脑边缘系统重要组成部分,与学习和记忆有着密切的关系,尤其CA1区细胞承载着信息的加工、强化和传递功能。海马血管构筑的独特性,使海马成为脑内对缺血最敏感的区域[1]。脑缺血可导致海马CA1区锥体细胞的一系列损伤性改变,在行为学上表现为长期的学习和记忆能力障碍。树突是神经元信息传递的入口,树突棘是兴奋性突触传递的原始位点[2],因此海马锥体细胞树突的形态及树突棘结构和功能的可塑性被认为是学习记忆的细胞基础。本实验对大鼠行双侧颈总动脉永久性结扎(two-vessel occlusion,2VO),经快速灌注Golgi染色,研究慢性脑缺血大鼠海马CA1区锥体细胞树突的分支、长度及树突棘密度,以期为慢性脑缺血疾病的临床研究和治疗提供实验依据。
材料和方法
1 动物和主要仪器
健康SD雌性大鼠,6月龄,体重320~350 g,由郑州大学医学院实验中心提供,随机分为模型组和假手术组,每组45只,每组选取2周、4周8周3个时点,每个时点15只大鼠。KD-400型振动切片机。Morris水迷宫仪。
2 方法
2.1 慢性脑缺血模型建立 参照Ni等[3]的方法制备脑缺血大鼠模型。大鼠术前12 h禁食,4 h禁水。10%水合氯醛(3 mL/kg)腹腔注射麻醉,保证手术期间有自主呼吸。仰卧固定,颈前部去毛消毒后沿颈正中切开,小心分离出双侧颈总动脉,分别结扎双侧颈总动脉远心端和近心端,以确保阻断颈总动脉血流,缝合皮肤。术中大鼠肛温保持在36.5~37.5℃,手术后动物送至有通风和空调设备的动物房饲养。
假手术组动物除不结扎双侧颈总动脉外,余过程与模型组相同。
2.2 行为学评价及造模成功的判定标准 从术后2周、4周、8周开始,分别将各组动物于Morris水迷宫中连续定位航行训练4 d,每天训练3次,每次采取不同的入水点训练120 s。若动物在120 s之内找到平台,使其在上停留15 s;若120 s之内未找到平台,则将其诱导到平台上并停留15 s,方结束1次训练。如此训练4 d,分别记录每只动物的潜伏期,潜伏期越短,路程越近,说明大鼠学习记忆能力越好[4]。
取第4 d假手术组大鼠逃避潜伏期的均值为参考值,同时计算造模大鼠第4 d的平均逃避潜伏期与参考值之差占该鼠的平均逃避潜伏期时间的比值,该值>20%定为认知功能障碍大鼠,即为造模成功的大鼠[5]。
2.3 取材及制片 对两组大鼠分别于2周、4周、8周进行快速灌注Golgi染色[6](模型组选用造模成功的大鼠)。0.5%亚硝酸钠液快速灌注至流出液体无血色,10%甲醛溶液灌注固定,使之充分将前液置换,静置1~2 h。再用媒染液(5%水合氯醛,5%重铬酸钾,10%甲醛混合液)慢速灌注,至流出浓厚橘红色液,略侯1~2 h。开颅取出大脑半球,从前中1/3处向后取组织块约8 mm,浸泡于媒染液中,置暗处避光于37℃温箱内24 h。然后用1%硝酸银溶液浸泡镀银,置暗处37℃温箱内3 d,每天换新银液。用振动切片机经海马区冠状位连续切片(切片厚100 μm)。切片分别经2%重铬酸钾溶液、蒸馏水漂洗,依次脱水、透明、封片,光镜下观察。
2.4 图像处理及分析 采集图像,所有图像均采用ImageJ软件进行分析。在每只大鼠的切片中,选择海马CA1区背景清晰且被染出锥体神经元密度均匀的5张切片,每张切片测量4个形态完整的细胞,每组不同时点共选取80个细胞进行观察。
2.5 树突分支、长度及树突棘的密度测定
2.5.1 树突的分支及长度 采用Sholl插件对树突的分支及长度进行统计,200倍显微镜下以神经元胞体为圆心,做间距为10 μm的同心圆,统计树突与同心圆的交点数之和,用交点总数反映树突的分支和长度,见图1。
2.5.2 树突棘的密度 在1000倍油镜下观察树突棘,从胞体发出的树突第1次分支开始,计算30~60 μm长度范围内树突棘的个数,以每10 μm树突棘个数反映其密度。
3 统计学处理
采用SPSS 15.0统计软件处理,数据用均数±标准差()表示,多组间比较采用单因素方差分析,用LSD法进行两两比较,组间均数的两两比较采用两样本t检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠的行为学改变
模型组大鼠潜伏期明显延长,与假手术组比较有显著差异(P<0.05),表明模型组大鼠记忆功能受损,出现一定的认知功能障碍。并随着缺血时间延长,认知功能障碍显著加重,见表1。
表1 各组大鼠潜伏期比较Table 1.The latency of rats in each group(.n=15)
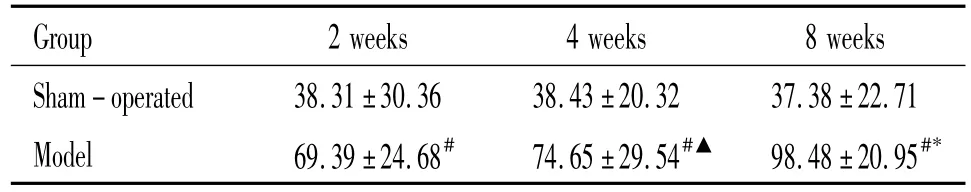
表1 各组大鼠潜伏期比较Table 1.The latency of rats in each group(.n=15)
#P<0.05 vs sham-operated;▲P<0.05 vs 2 weeks;*P<0.05 vs 4 weeks.
Group 2 weeks 4 weeks 8 weeks Sham -operated 38.31±30.36 38.43±20.32 37.38±22.71 Model 69.39±24.68# 74.65±29.54#▲ 98.48±20.95#*
2 树突分支及长度的变化
2周模型组树突的交点总数与相应假手术组相比无明显变化,组间比较无统计学意义(P>0.05);4周、8周模型组树突交点总数与相应假手术组相比均显著减少(P<0.01)。
模型组树突的交点总数随时间延长逐渐减少,4周组树突交点总数较2周组显著减少(P<0.05),8周组树突交点总数较4 周组显著减少(P <0.01),见图2、3。
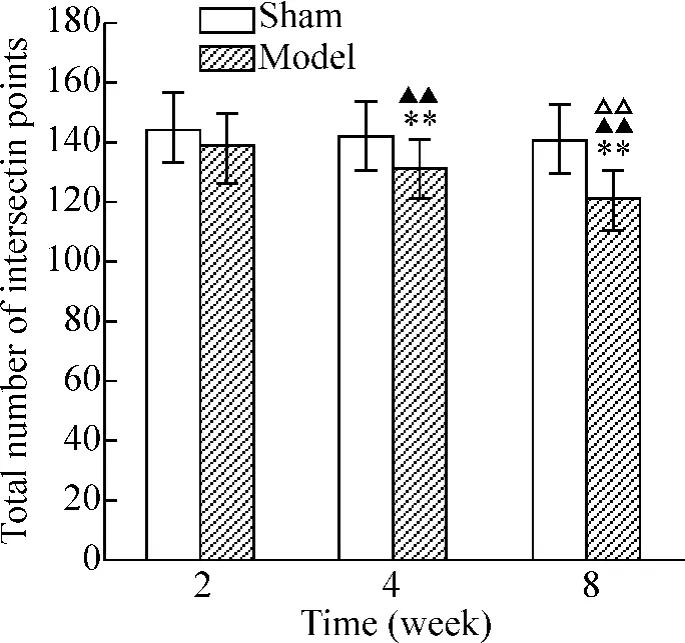
Figure 3.Total number of intersection points of dendrites in hippocampal CA1 pyramidal cells in each group..n=80.**P <0.01 vs sham;▲▲P <0.01 vs 2 weeks;△△P <0.01 vs 4 weeks.图3 各组大鼠海马CA1区锥体细胞树突交点总数
3 树突棘密度的变化
模型组树突棘密度与相应假手术组相比均显著减少(P<0.01);模型组树突棘密度随时间延长逐渐减少,4周组树突棘密度较2周组显著减少(P<0.05),8周组树突棘密度较4周组显著减少(P<0.01),见图4、5。

Figure 4.Spine density in hippocampal CA1 pyramidal cells in each group(Golgi staining,×1000).A:2-week sham-operated group;B:2-week model group;C:4-week model group;D:8-week model group.图4 海马CA1区锥体细胞树突棘

Figure 5.Spine density in hippocampal CA1 pyramidal cells in each group..n=80.**P<0.01 vs sham;▲▲P<0.01 vs 2 weeks;△△P <0.01 vs 4 weeks.图5 各组大鼠海马CA1区锥体细胞树突棘密度
讨 论
树突是神经元信息接收的重要区域,具有接收和整合突触传递的功能。树突表面有许多棘状突起,称树突棘,是形成突触的具体位点,树突的分支、伸展长度及树突棘均可扩大神经元接受刺激的表面积,在神经元信息传递和加工中起着至关重要的作用[7]。慢性脑缺血是神经系统一种常见的病理状态,慢性脑缺血后能量代谢障碍,不能满足组织需要,可导致认知功能损害。Tsuchiya等[8]研究大鼠2VO术后脑血流变化,发现术后1周海马血流量下降20%,皮质血流量下降30%~45%,与此同时,海马葡萄糖利用率亦明显下降15%,皮质葡萄糖利用率下降20% ~30%。术后8周到3个月海马血流量下降约60%,脑低血流逐渐转为慢性状态[9],并伴随一系列神经递质改变、脑白质损害、神经元缺失等病理改变[10]。Bennett等[11]通过研究慢性脑缺血神经损伤机制,发现2VO术后大鼠海马区内神经细胞逐渐凋亡,且其凋亡数量与认知功能障碍密切相关。由此可见,海马是脑内缺血的敏感易损区,慢性脑缺血可导致海马CA1区锥体细胞的固缩、凋亡以及树突损伤,从而构成了进展性认知功能障碍的病理生理学基础。
大鼠2VO术后脑低血流改变与人类老龄化慢性脑缺血很相似,已被广泛用来研究慢性脑缺血对认知功能障碍的影响。水迷宫已被证实是评价大鼠学习记忆能力的有效工具之一[4]。因此,本研究通过建立2VO模型,分别于脑缺血不同时点应用水迷宫测量逃避潜伏期来判断大鼠慢性脑缺血后认知功能障碍程度,发现随着缺血程度加重,大鼠认知功能障碍显著加重。
本实验通过对慢性脑缺血海马锥体细胞形态学及树突棘密度的研究发现2周模型组海马CA1区锥体细胞树突分支及长度减少较轻有关,可能与损伤时间较短,一部分血液代偿使树突损伤并不明显。NO是一种血管舒张剂,研究发现2VO术后海马区NO浓度可升高2周[9],Mracsko等[12]发现在2VO模型早期,海马和额叶皮层COX-2(cyclooxygenase-2)和eNOS(endothelial nitric oxide synthase)酶系水平增高,提示缺血引起血管兴奋性反应。这些反应均可促使各种因子参与改善早期脑缺血及血管重建,起到一定代偿作用。但随着缺血时间延长,缺血缺氧程度加重,失代偿后导致树突分支及长度明显减少。本实验模型组树突棘密度较假手术组均有显著减少,表明慢性脑缺血对海马CA1区的损伤确切。2VO术后脑血流量开始逐渐下降,引起脑内糖代谢及ATP酶活性显著下降,长期脑供血供氧不足,脑内能量衰竭导致海马CA1区锥体细胞树突不可逆损伤,从而引起形态学改变及树突棘脱落。微管相关蛋白(microtubule-associated protein 2,MAP-2)和网格蛋白参与细胞骨架的形成,与树突微管形成密切相关,可反映树突的分支、重塑,被认为是对脑缺血高度敏感的标记物。Kudo等[13]亦报道2VO术后6~8周MAP-2和网格蛋白表达均显著下降。故可推断慢性脑缺血后MAP-2和网格蛋白表达减少引起海马锥体细胞树突骨架蛋白及微管装配异常,从而导致其分支及长度的减少及树突棘的改变。树突棘是突触的具体位点。慢性缺血缺氧时NO等神经毒性物质释放,神经电活动受到抑制[9,14],均可造成树突棘大量脱落及结构学的病理改变,改变突触的功能,进而导致学习、记忆及认知的缺陷。
[1]姬西团,章 翔,费 舟,等.人与大鼠海马血管构筑的比较性研究[J].神经解剖学杂志,2004,20(2):179 -182.
[2]Tada T,Sheng M.Molecular mechanisms of dendritic spine morphogenesis[J].Curr Opin Neurobiol,2006,16(1):95-101.
[3]Ni JW,Matsumoto K,Li HB,et al.Neuronal damage and decrease of central acetylcholine level following permanent occlusion bilateral common carotid arteries in rats[J].Brain Res,1995,673(2):290 -296.
[4]D’Hooge R,De Deyn PP.Applications of the Morris water maze in the study of learning and memory[J].Brain Res Brain Res Rev,2001,36(1):60 -90.
[5]Yu J,Liu C,Zhang X,et al.Acupuncture improved cognitive impairment caused by multi-infarct dementia in rats[J].Physiol Behav,2005,86(4):434 -441.
[6]杜卓民,卫光辉,王 宜,等.实用组织学技术[M].第2版.北京:人民卫生出版社,1998.143 -144.
[7]Nimchinsky EA,Sabatini BL,Svoboda K.Structure and function of dendritic spines[J].Annu Rev Phisiol,2002,64:313-353.
[8]Tsuchiya M,Sako K,Yura S,et al.Cerebral blood flow and histopathological changes following permanent bilateral carotid artery ligaion in Wistar rats[J].Exp Brain Res,1992,89(1):87 -92.
[9]舒 怡,张 洪,章军建.慢性脑低灌注的实验研究进展[J].中华脑血管病杂志,2010,4(3):199 -206.
[10]刘汉兴,章军建.慢性脑缺血与认知功能障碍[J].国际医学:脑血管疾病分册,2004,12(4):278 -281.
[11]Bennett SA,Teimiswood M,Chen JH,et al.Chronic cerebral hypoperfusion elicits neuronal apoptosis and behavioral impairment[J].Neuroreport,1998,9(1):161 - 166.
[12]Mracsko E,Hugyecz M,Institoris A,et al.Changes in pro-oxidant and antioxidant enzyme levels during cerebral hypoperfusion in rats[J].Brain Res,2010,1321(1):13 -19.
[13]Kudo T,Tada K,Takeda M,et al.Learning impairment and microtubule-associated protein 2 decrease in gerbils under chronic cerebral hypoperfusion[J].Stroke,1990,2l(8):1205-1209.
[14]Aytac E,Seymen HO,Uzun H,et al.Effect of iloprost on visual evoked potentials and brain tissue oxidative stress after bilateral common carotid artery occlusion[J].Prostaglandins Leukot Essent Fatty Acids,2006,74(6):373 -378.

