Neuregulin-1 在糖尿病大鼠心肌组织中的表达变化*
龙启成, 桂 春△, 朱立光, 农勤玲, 邓 燕, 邓天赐
(广西医科大学1 第一附属医院心内科,2 第一附属医院超声诊断科,3 病理学教研室,广西 南宁530021)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病(diabetes mellitus,DM)的主要并发症之一,它是指排除冠心病、瓣膜性心脏病和高血压等因素,以左心室功能障碍为主的心肌病,其病理生理学改变包括代谢紊乱、心肌纤维化、心肌细胞及血管内皮细胞凋亡、微血管和心脏自主神经病变等。在DCM中,许多细胞因子都被激活,如血管紧张素II、转化生长因子、胰岛素样生长因子和炎症因子[1-3],而血管内皮生长因子和血管生成素-1 及相关受体的信号转导系统明显受损[4-5]。神经调节蛋白1(neuregulin-1,NRG-1)是表皮生长因子家族的成员,其受体为酪氨酸激酶家族的跨膜受体ErbB。NRG-1/ErbB 信号转导在心血管系统的发育和成年心脏功能的维护中起着至关重要的作用。有研究表明NRG-1 能促进心肌细胞的生存[6],降低氧化应激,诱导心肌细胞增殖和对心脏损伤进行修复[7]。NRG1/ErbB 系统是否参与DCM 的发展尚不明确。本研究以糖尿病大鼠为对象,探讨NRG-1 在糖尿病大鼠心肌中的表达变化。
材 料 和 方 法
1 动物
采用8 周龄雄性SD 大鼠,体重180 ~200 g,属于无特定病原体(SPF)级动物,由广西医科大学实验动物中心提供(合格证编号为SCXK 桂2009-0002)。
2 主要试剂及仪器
链脲佐菌素(streptozotocin,STZ)购自Sigma,多克隆羊抗NRG-1 抗体和羊抗兔IgG-HRP 抗体分别购自Abcam 和Bioworld Technology,逆转录试剂盒和Trizol 购自Fermentas,2 ×Taq PCR Master Mix 和磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体分别购自北京天根公司和上海康成生物公司。血糖仪和心脏实时三维超声诊断仪分别购自罗氏有限公司和飞利浦公司。
3 方法
3.1 动物分组与模型的建立 45 只SD 大鼠按电脑随机数法分为4 周、8 周和12 周糖尿病组(4th、8th和12th DM 组,各组n=10),4 周、8 周和12 周对照组(4th、8th 和12th C 组,各组n=5)。禁食12 h 后,各DM 组大鼠一次性腹腔内注射STZ 溶液55 mg/kg(柠檬酸盐缓冲液溶解,pH 4.3,浓度为10 g/L);各C 组大鼠注射等体积柠檬酸盐缓冲液。7 d 后取鼠尾静脉血测空腹血糖。参考文献[8],血糖大于16.7 mmol/L 并出现多饮、多食、多尿和消瘦者纳入DM模型。
3.2 心功能测定和取材 实验的第4、8 和12 周,腹腔注射戊巴比妥钠溶液麻醉后,采用超声诊断仪盲法检测大鼠左室舒张末内径(left ventricular end-diastolic dimension,LVEDD)、左室收缩末内径(left ventricular systolic dimension,LVESD)、左室射血分数(left ventricular ejection fraction,LVEF)和左室短轴缩短率(left ventricular fractional shortening,LVFS),取5 个心动周期的平均值。完成心功能检测后,处死大鼠,分离出左室心肌组织,于左室赤道面横切,取适量心肌组织分别放入液氮灌和4%甲醛溶液中保存备用。
3.3 心肌胶原纤维染色(Masson 染色)及免疫组化染色 4%甲醛溶液固定的心肌组织经过脱水、透明、浸蜡、包埋后,分别在心尖、中部和基底部以厚度4 μm 各连续切片2 张,其中不同部位的3 张行Masson 染色,光镜下每个标本选取5 个视野,应用Image-Pro Plus 6.0 图像分析系统测定心肌胶原容积分数(心肌胶原容积分数=视野中胶原面积/视野心肌总面积)。余下3 张用梯度酒精脱蜡和水化后,0.01 mmol/L PBS 洗2 次,滴加3%过氧化氢,室温孵育10 min,PBS 洗3 次,切片置修复液中微波炉加热10 s,PBS 洗2 次。滴加封闭液,置于湿盒中封闭60 min,分别加入1∶75 稀释的NRG-1 抗体,4 ℃过夜。用PBS 洗3 次后滴加SABC 试剂免疫组化染色,DAB显色,苏木素轻度复染,封片。光镜下以细胞质和细胞膜染成密集棕黄色为阳性,散在淡棕黄色为弱阳性,无棕黄色为阴性。
3.4 左室心肌组织NRG-1 mRNA 表达的测定
取出液氮保存的心肌组织,先用Trizol 提取标本的总RNA,测定总RNA 的浓度,再用逆转录试剂盒进行逆转录,最后进行PCR 反应。引物根据GenBank 提供的基因序列,使用Primer Design 软件进行设计,由上海生工公司合成,见表1。RT-PCR 反应条件为:95 ℃预变性5 min,95 ℃45 s,55 ℃30 s,72 ℃30 s,扩增30 个循环,最后72 ℃10 min。PCR 扩增产物经2%琼脂糖凝胶电泳,凝胶成像系统上进行扫描,以β-actin 为内参照,比较各组NRG-1 mRNA 表达的变化。
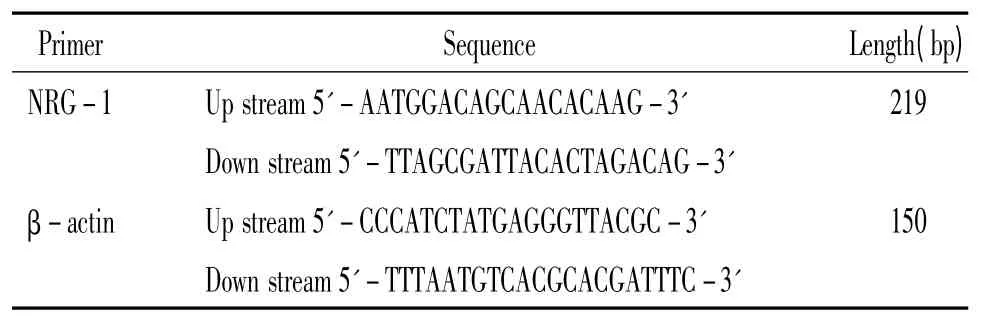
表1 RT-PCR 引物序列Table 1. The sequences of RT-PCR primers
3.5 左室心肌组织NRG-1 蛋白表达的测定
Western blotting 方法测定心肌组织NRG-1 蛋白的表达。取心肌组织约50 mg,加入RIPA 蛋白裂解液400 μL 和PMSF 4 μL 进行总蛋白的提取,BCA 蛋白浓度测定试剂盒测定样本蛋白的浓度。蛋白于12%SDS-聚丙酰胺凝胶电泳70 min,湿法电转2 h 转至聚偏氟乙烯(PDVF)膜后,剪出目的条带,以6%脱脂奶封闭1.5 h,再加NRG-1 Ⅰ抗(1∶350)进行抗体结合,4 ℃过夜,TBST 洗膜后加羊抗兔IgG-HRP(1∶10 000)室温下孵育1 h,TBST 洗膜后滴加ECL 检测试剂混合液在暗室中显影。以GAPDH(1∶10 000)为内参抗体。用Quantity One 成像系统进行蛋白条带的灰度值分析,以NRG-1 蛋白与GAPDH 蛋白条带的灰度积分比值来代表目标蛋白的相对表达量,分析结果。
4 统计学处理
采用SPSS 13.0 统计软件进行统计分析,数据以均数±标准差(±s)表示,两组间比较用t 检验,以P <0.05 为差异有统计学意义。
结 果
1 动物模型建立的情况
DM 组不达标大鼠4 只。饲养过程中死亡6 只均为糖尿病大鼠,可能死于感染或糖尿病高渗昏迷。最终4th、8th 和12th C 组均为5 只,4th 和8th DM 组各7 只,12th DM 组6 只。
2 大鼠心功能检测情况
4th DM 组大鼠心功能指标与同期对照组相比,差异无统计学意义(均P >0.05);8th DM 组LVESD显著高于同期对照组(P <0.05),而LVEDD、LVFS和LVEF 均较同期对照组稍低,但差异无统计学意义(均P >0.05);12th DM 组LVESD 显著高于同期对照组,LVEDD、LVFS 和LVEF 均显著低于同期对照组,见表2。
表2 各组大鼠的心功能检测指标的比较Table 2. The echocardiographic parameters of rats in each group(±s)

表2 各组大鼠的心功能检测指标的比较Table 2. The echocardiographic parameters of rats in each group(±s)
* P <0.05,**P <0.01 vs control (C)group at the same time point.
Group n LVEDD(mm) LVESD(mm) LVEF(%) LVFS(%)4.40 4th DM 7 5.54±0.29 2.57±0.35 82.70±4.29 52.80±3.89 8th C 5 6.18±0.38 3.02±0.27 84.30±2.46 51.40±4.23 8th DM 7 5.63±0.33 3.79±0.41* 82.50±3.24 48.30±6.50 12th C 5 6.99±0.32 3.01±0.32 83.60±2.97 53.30±8.37 12th DM 6 5.72±0.31* 3.79±0.39* 71.50±4.53** 40.10±3.91 4th C 5 5.81±0.37 2.61±0.24 83.90±3.13 51.20±**
3 大鼠左室心肌组织形态学观察结果
3.1 Masson 染色及心肌胶原容积分数 4th DM 组大鼠左室心肌组织经Masson 染色在光镜下未发现明显心肌间质或微血管壁纤维化;8th 和12th DM 组在光镜下可见心肌细胞空泡样改变,心肌间质和微血管壁纤维化明显,粗大胶原纤维相互连接成网状排列紊乱,分布不均,显天蓝色。计算心肌CVF(%)发现,4th DM 组心肌CVF 与同期对照组相比,差异无统计学意义(1.90 ± 0.21 vs 2.09 ± 0.29,P >0.05);8th 和12th DM 组心肌CVF 均明显高于同期对照组(10.23 ±2.69 vs 1.87 ±0.37,17.29 ±4.67 vs 1.99 ±0.41,均P <0.01),见图1。

Figure 1. Masson staining of left ventricular myocardial tissues (× 100)and myocardial tissue CVF of rats. A:4th control group;B:4th DM group;C:8th control group;D:8th DM group;E:12th control group;F:12th DM group. **P <0.01 vs control group at the same time point.图1 大鼠左室心肌Masson 染色图像及心肌胶原容积分数
3.2 NRG-1 蛋白在大鼠心肌组织中表达的部位
免疫组化染色后,可见大鼠左室心内膜、心肌内层及微血管内膜呈棕黄色即NRG-1 表达呈阳性,其它区域无棕黄色着色或呈稀疏浅棕色,即NRG-1 表达阴性或弱阳性,见图2。
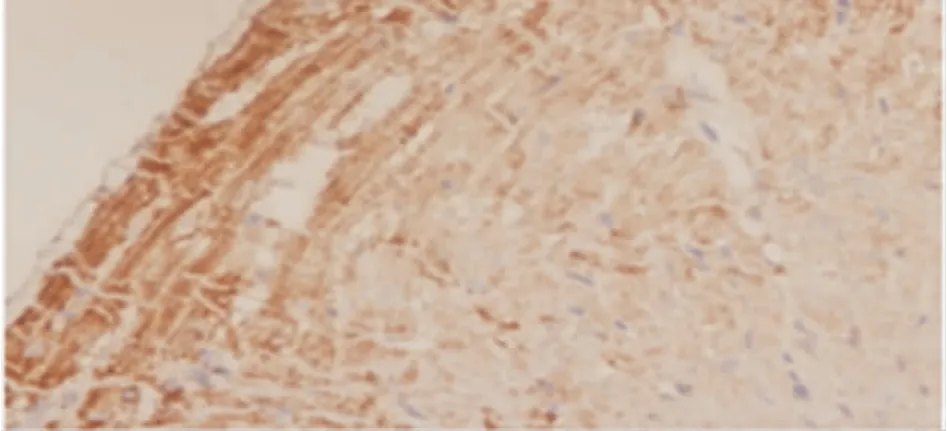
Figure 2. Expression of NRG-1 protein in rat myocardial tissues (immunohistochemical staining,×100)图2 NRG-1 蛋白在大鼠心肌组织中的表达
4 左室心肌组织NRG-1 mRNA 及蛋白的表达
RT-PCR 和Western blotting 结果显示,4th 和8th DM 组大鼠左室心肌组织NRG-1 mRNA 及蛋白的表达与同期对照组相比,差异无统计学意义(P >0.05),12th DM 组心肌组织NRG-1 mRNA 及蛋白的表达较同期对照组均显著下调(均P <0.01),见图3、4。
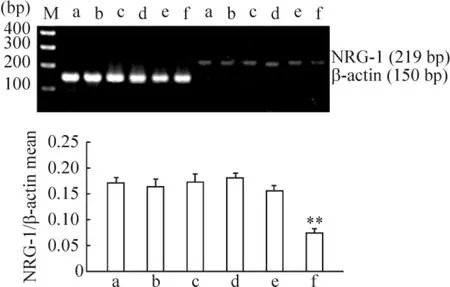
Figure 3. The expression of NRG-1 mRNA in myocardial tissues of rats at different time points. M:marker;a:4th C group;b:4th DM group;c:8th C group;d:8th DM group;e:12th C group;f:12th DM group. **P <0.01 vs 12th C group. C:control;DM:diabetes mellitus.图3 大鼠不同时期心肌NRG-1 mRNA 表达的比较
讨 论
本研究发现:(1)在糖尿病早期,大鼠心脏结构即发生改变,心肌肥大,并逐渐出现纤维化;(2)随着病程的发展,糖尿病大鼠出现心功能不全,并逐渐恶化;(3)在糖尿病的早期,大鼠心肌组织NRG-1 的表达无明显改变,而随着病程的发展,NRG-1 的表达出现显著下调。
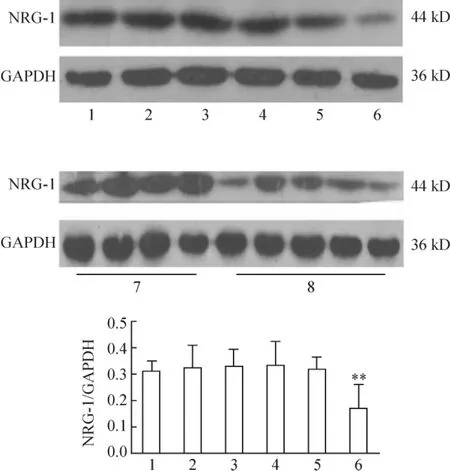
Figure 4. The expression of NRG-1 protein in myocardial tissues of rats (Western blotting). 1:4th C group;2:4th DM group;3:8th C group;4:8th DM group;5 and 7:12th C group;6 and 8:12th DM group. **P <0.01 vs 12th C group.图4 NRG-1 蛋白在大鼠心肌组织中表达水平的比较
DCM 主要表现为心肌肥大、纤维化,心肌顺应性下降,并逐渐出现心功能障碍。本研究在诱导糖尿病4 周后大鼠出现心肌肥大,随后心肌纤维化,并逐渐出现心功能不全,说明大鼠已并发DCM。据文献报道,STZ 诱导糖尿病大鼠心肌超微结构的改变发生在诱导糖尿病后4 ~6周[9],与本研究观察结果一致。许多因素可影响心脏的结构和功能,包括代谢紊乱、氧化应激、微血管和心脏自主神经病变等。有研究表明,高血糖引发氧化应激可提高晚期糖基化终产物及其受体的表达,激活核转录因子,改变心肌收缩力;同时,晚期糖基化终产物积聚还可改变心脏结构蛋白,导致心脏I 型和Ⅲ型胶原沉积诱发心肌间质纤维化[10],支持本研究结果。
本研究免疫组化染色结果提示,NRG-1 主要在微血管内皮细胞和内皮细胞较多的心内膜中表达,与NRG-1 主要由心内膜和心脏微血管内皮细胞合成和释放相吻合[6]。有研究显示左室组织NRG-1的表达在左室发生向心性肥厚的初期显著升高,而当左室出现偏心性肥厚和泵衰竭时显著下降[6]。本研究在诱导糖尿病4 或8 周后,大鼠心肌组织NRG-1 的表达并未发生明显改变,而在诱导糖尿病12周后,大鼠心肌组织NRG-1 的表达显著下调。NRG-1 的合成与表达受许多神经-体液因素影响。有研究表明,在DCM 中,心脏内皮素-1 的表达、氧化应激及活性氧产物增加[11],这些因素可提高内皮细胞NRG-1 的表达[7,12]。另一方面,DCM 可引起交感神经兴奋和肾素-血管紧张素系统的激活[1],去甲肾上腺素和血管紧张素II 分泌增多,二者均可抑制NRG-1 的表达[6]。同时,DCM 心脏微血管减少[11]而内皮细胞凋亡增加[13],造成NRG-1 的来源减少。因此,推测在糖尿病早期,促进NRG-1 表达的因素占优势,心肌组织NRG-1 的表达并未降低;而在糖尿病晚期,抑制NRG-1 表达的因素占优势,故心肌组织NRG-1 的表达显著下调。
许多生物学过程都由NRG1/ErbB 信号系统调节,包括细胞生长、生存、增殖、迁移和分化,细胞与间质的联系等[7]。NRG-1/ErbB 系统在成年心脏功能的维护中扮演着至关重要的角色。抑制ErbB2/NRG 信号系统可增强紫杉醇对成年大鼠心脏毒性作用,导致心肌纤维化和心功能不全[14],而外源性NRG-1 可改善缺血性、扩张型心肌病及病毒性心肌病模型的心功能,延长存活时间和减轻病理改变[15]。本研究在诱导糖尿病4 和8 周后,大鼠心肌组织NRG-1 的表达均未发生明显改变,其心功能也处于代偿期;而在诱导糖尿病12 周后,伴随着NRG-1表达的显著下调,大鼠心肌纤维化更明显,并出现心功能不全的表现,提示NRG-1 表达减少可能与心肌纤维化及心功能不全的发生发展存在着一定联系,具体机制有待进一步研究。
[1] Belmadani S,Bernal J,Wei CC,et al. A thrombospondin-1 antagonist of transforming growth factor-β activation blocks cardiomyopathy in rats with diabetes and elevated angiotensin II[J]. Am J Pathol,2007,171(3):777-789.
[2] Connelly KA,Kelly DJ,Zhang Y,et al. Functional,structural and molecular aspects of diastolic heart failure in the diabetic (mRen-2)27 rat[J]. Cardiovasc Res,2007,76(2):280-291.
[3] Drimal J,Knezl V,Navarova J,et al. Role of inflammatory cytokines and chemoattractants in the rat model of streptozotocin-induced diabetic heart failure[J]. Endocr Requl,2008,42(4):129-135.
[4] Han B,Baliga R,Huang H,et al. Decreased cardiac expression of vascular endothelial growth factor and redox imbalance in murine diabetic cardiomyopathy[J]. Am J Physiol Heart Circ Physiol,2009,297(2):H829-H835.
[5] Chen JX,Stinnett A. Disruption of Ang-1/Tie-2 signaling contributes to the impaired myocardial vascular maturation and angiogenesis in type II diabetic mice[J]. Arterioscler Thromb Vasc Biol,2008,28(9):1606-1613.
[6] Lemmens K,Segers VF,Demolder M,et al. Role of neuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk[J]. J Biol Chem,2006,281(28):19469-19477.
[7] Zhao YY,Sawyer DR,Baliga RR,et al. Neuregulins promote survival and growth of cardiac myocytes. Persistence of ErbB2 and ErbB4 expression in neonatal and adult ventricular myocytes[J]. J Biol Chem,1998,273(17):10261-10269.
[8] Matteucci E,Giampietro O. Proposal open for discussion:defining agreed diagnostic procedures in experimental diabetes research[J]. J Ethnopharmacol,2008,115(2):163-172.
[9] 卫 峰,宁 光.糖尿病与心血管疾病——基础和临床[M].第1 版.上海:上海科技教育出版社,2006.218-222.
[10] Ma H,Li SY,Xu P,et al. Advanced glycation endproduct(AGE)accumulation and AGE receptor (RAGE)up-regulation contribute to the onset of diabetic cardiomyopathy[J]. J Cell Mol Med,2009,13(8B):1751-1764.
[11] Widyantoro B,Emoto N,Nakayama K,et al. Endothelial cell- derived endothelin-1 promotes cardiac fibrosis in diabetic hearts through stimulation of endothelial-to-mesenchymal transition[J]. Circulation,2010,121(22):2407-2418.
[12] Kuramochi Y,Cote GM,Guo X,et al. Cardiac endothelial cells regulate reactive oxygen species-induced cardiomyocyte apoptosis through neuregulin-1β/erbB4 signaling[J]. J Biol Chem,2004,279(49):51141-51147.
[13] Ceriello A,Quagliaro LD,Amico M,et al. Acute hyperglycemia induces nitrotyrosine formation and apoptosis in perfused heart from rat diabetes[J]. Diabetes,2002,51(4):1076-1082.
[14] Pentassuglia L,Timolati F,Seifriz F,et al. Inhibition of ErbB2/neuregulin signaling augments paclitaxel-induced cardiotoxicity in adult ventricular myocytes[J]. Exp Cell Res,2007,313(8):1588-1601.
[15] Liu X,Gu X,Li Z,et al. Neuregulin-1/erbB-activation improves cardiac function and survival in models of ischemic,dilated,and viral cardiomyopathy[J]. J Am Coll Cardiol,2006,48(7):1438-1447.

