一氧化氮及一氧化氮合酶在急性吸入高浓度氧大鼠肺泡上皮细胞凋亡中的作用
周 海,潘晓军,杨建平,郭成浩△
(1苏州大学附属第一医院麻醉科,江苏 苏州 215006;2山东大学医学院病理与病理生理学研究所,山东 济南 250012;3徐州中心医院麻醉科,江苏 徐州 221009)
持续吸入高浓度氧通过体内出现的氧化应激产生大量活性氧(reactive oxygen species,ROS),进而导致肺损伤已有较多报道[1]。我们发现大鼠在吸入高氧4 h后即发生体内抗氧化能力改变,引起肺组织出现形态变化,一定程度上解释了临床全麻期间病人虽短期持续吸入高浓度氧,仍会出现拔管困难的现象[2]。氧自由基及其衍生物与细胞凋亡(apoptosis)密切相关[3],其中一氧化氮(nitric oxide,NO)尤为重要。本实验通过制备大鼠高氧肺损伤模型,观察高氧急性期时血浆NO水平、肺泡上皮细胞凋亡及NO合酶(NO synthase,NOS)活性及内皮型 NOS(endothelium NOS,eNOS)和诱导型 NOS(inducible NOS,iNOS)蛋白表达情况,探讨高氧急性期的各指标的关系以探讨肺损伤的机制。
材料和方法
1 动物模型的制备
1.1 动物的选择和分组 2月龄Wistar大鼠60只,体重150~200 g,由山东大学动物实验中心提供。随机分为5组:正常氧对照组、高氧4 h组、高氧8 h组、高氧12 h组、高氧16 h组,每组12只,雌雄各半。
1.2 动物模型的建立 采用聚乙烯箱和玻璃自制氧箱,尺寸为50 cm×30 cm×20 cm,为避免箱体内形成高压,箱体前后设有进气口和出气口,应用气体流量计测定调整进出口大小和氧气流速,使氧箱进出气流量相同。每2 h应用OX-100A型数字测氧仪检测1次箱内氧浓度,使氧浓度保持在85%以上。箱内放置钠石灰吸收CO2,保持CO2浓度不高于5%。对照组大鼠放置于敞开的未通入氧气的氧箱中。保持实验室温度在20~28℃,每天白昼时间12 h,各组大鼠都给予充足的食物和饮水,保持垫料清洁。由于实验用氧箱体积有限,每个箱中只能放置6只大鼠。
2 观察指标和检测方法
所有大鼠取标本前禁食6 h(不禁水)。将实验动物腹腔注射麻醉药物(氯胺酮0.1~0.15 mg/g、安定6~7.5 μg/g),动物麻醉后立即解剖经腹静脉抽取静脉血5 mL放置抗凝试管中冷藏,3000 r/min离心10 min抽取血浆检测。取大鼠左肺用4%中性甲醛液固定,右肺三叶称重,按1∶10加入0.15 mmol/L的冰氯化钾匀浆溶液,高速匀浆机制浆(FSH-2A,江苏金坛市医疗仪器厂),-4℃ 1500 r/min离心(GL-20高速冷冻离心机,湖南赛特湘仪离心机仪器有限公司)15 min后取上清液密闭保存在-20℃冰箱中待检。
2.1 病理学检查 24 h内进行石蜡包埋。常规制片,HE染色后镜下观察细胞病理学形态。按TACS原位凋亡测试试剂盒(TA4652,R&B)说明制片,作TUNEL染色,光学显微镜下计数阳性细胞数,连续计数5个高倍视野。
2.2 丙二醛(malondialdehyde,MDA)、NO 含量和NOS活性测定 MDA测定试剂盒、NO测定试剂盒、NOS测定试剂盒由南京建成生物工程研究所提供,操作方法按说明书。用AV640可见光分光光度仪(Olympus)化学比色检测肺匀浆液、血浆中的MDA、NO和NOS活性。
2.3 不同类型的NOS含量测定 部分肺组织加入事先配置好的蛋白裂解液(RIPA+PMSF,PMSF最终浓度为1 mmol/L),在冰上放置20~30 min后,以10000 r/min 4℃离心4 min,吸取上清(即所提取的总蛋白)检测其浓度。采用聚丙烯酸铵凝胶电泳(SDS-PAGE)技术测定iNOS、eNOS的蛋白含量(转膜仪,SDS-PAGE电泳仪为Bio-Rad产品)。常规制备凝胶并放入电泳槽中,检测样品量为30 μL(6 μL蛋白上样缓冲液+24 μL总蛋白),于100℃水浴锅内变性5 min后,取出放凉后加入样品孔。恒压90 V开始电泳,待指示剂到达浓缩胶与分离胶交界处,将电压提高至120 V。待指示剂到达胶底部时,停止电泳。将凝胶取出放置于转膜缓冲液中。对照蛋白marker,将含有目的条带和β-actin蛋白的凝胶切下,剪取与凝胶相同大小的PVDF膜,后者先用甲醇浸泡30 s,然后置于缓冲液中浸泡15 min。剪取4块与凝胶大小相同的滤纸,于转移缓冲液中浸泡15 min。按正极-滤纸-PVDF膜-凝胶-滤纸-负极的顺序依次放置于半干转膜仪上,电压20 V,转膜30 min。将PVDF膜放入5%脱脂奶粉TBS液中于37℃封闭2 h。1∶1000稀释抗β-actin单克隆抗体(武汉博士德公司)、1∶800稀释的抗eNOS抗体和抗iNOS抗体(兔抗鼠,武汉博士德)和PVDF膜4℃下孵育过夜。充分洗膜3次后,将1∶5000稀释的HRP标记的兔抗羊IgG 37℃孵育30 min。充分洗膜3次后,将PVDF膜取出放置在保鲜膜上。将2种显色底物1∶1等体积混合后覆盖在膜表面,用保鲜膜把膜包起来,放入暗匣中,在暗室中将X光片覆盖在膜的表面,夹好暗匣,曝光后显影、定影,观察结果。由图像分析系统(南京新飞达公司生产),扫描测定吸光度(A)定量。
3 统计学处理
结 果
1 各组大鼠血浆、肺组织匀浆生化指标
与对照组比较,无论是血浆还是肺组织匀浆中,高氧各组MDA浓度、NO浓度和NOS活性均显著升高(P <0.01),见表1。
2 Western印迹及吸光度分析结果
eNOS在对照组明显表达,高氧4 h组表达开始升高,8 h组后eNOS蛋白质表达升高明显。对照组iNOS蛋白微量表达,但表达量远低于eNOS,16 h组表达略增强,见图1。
3 各组大鼠肺组织病理学变化
图2显示,高氧4 h组肺毛细血管有轻度充血和中性粒细胞渗出;8 h组可见肺毛细血管扩张,充血明显,肺间质有大量炎性细胞渗出,肺泡腔有少量红细胞渗出;12 h组肺小血管扩张、充血,肺泡腔内出现红细胞及以中性粒细胞为主的炎症细胞,肺组织水肿明显,间质内细胞增多;16 h组可见肺大泡和肺不张,并存在肺组织结构紊乱,肺泡壁轻度增厚。
4 各组大鼠肺泡上皮细胞TUNEL染色切片
图3显示4 h组肺泡上皮细胞凋亡明显增加,达9.13%±3.20%,表现为浅绿色的核背景下有棕褐色小颗粒或块状物,正常细胞核被染成浅绿色;8 h组、12 h组凋亡细胞增加更加明显,达17.47% ±3.50%、19.22% ±4.50%。16 h组明显下降至11.03% ±2.80%,其中12 h组和16 h组核内出现棕黄色团快,呈现DNA碎片凝集现象。各高氧组与对照组(凋亡细胞占2.17% ±1.80%)比较差异显著(P <0.01)。
5 各组大鼠血浆及肺MDA、NO和NOS与肺泡上皮细胞凋亡的线性相关分析
随吸氧时间延长,各高氧组血浆及肺组织各指标与肺泡上皮细胞凋亡呈明显的正相关,见表2。
表1 急性吸氧对大鼠血浆及肺MDA浓度、NO浓度和NOS活性的影响Table 1.MDA concentration,NO concentration and NOS activity in plasma and lung tissues of the rats exposed to acute hyperoxia(.n=12)

表1 急性吸氧对大鼠血浆及肺MDA浓度、NO浓度和NOS活性的影响Table 1.MDA concentration,NO concentration and NOS activity in plasma and lung tissues of the rats exposed to acute hyperoxia(.n=12)
*P <0.05,**P <0.01 vs control.
MDA NO NOS Group Plasma(nmol/L) Lung(μmol/g protein) Plasma(μmol/L) Lung(mmol/g protein) Plasma(103U/L) Lung(103U/g protein)Control 4.43±1.77 1.87±0.51 16.01±2.43 5.17±1.43 16.01±2.48 0.94±0.13 Hyperxia 4 h 6.31±0.77** 3.24±0.43** 18.97±2.44** 12.00±2.51** 18.97±2.37** 1.77±0.34**Hyperxia 8 h 9.43±1.34** 3.91±0.50 ** 21.04±4.75** 13.50±2.74 ** 20.17±3.22** 1.98±0.31**Hyperxia 12 h 11.70±2.14** 4.81±0.50** 22.17±2.97** 14.90±3.52** 21.08±2.01** 2.24±0.45**Hyperxia 16 h 13.67±1.83** 5.81±0.70 ** 22.89±3.01** 15.60±3.46** 21.84±1.97** 2.32±0.67**
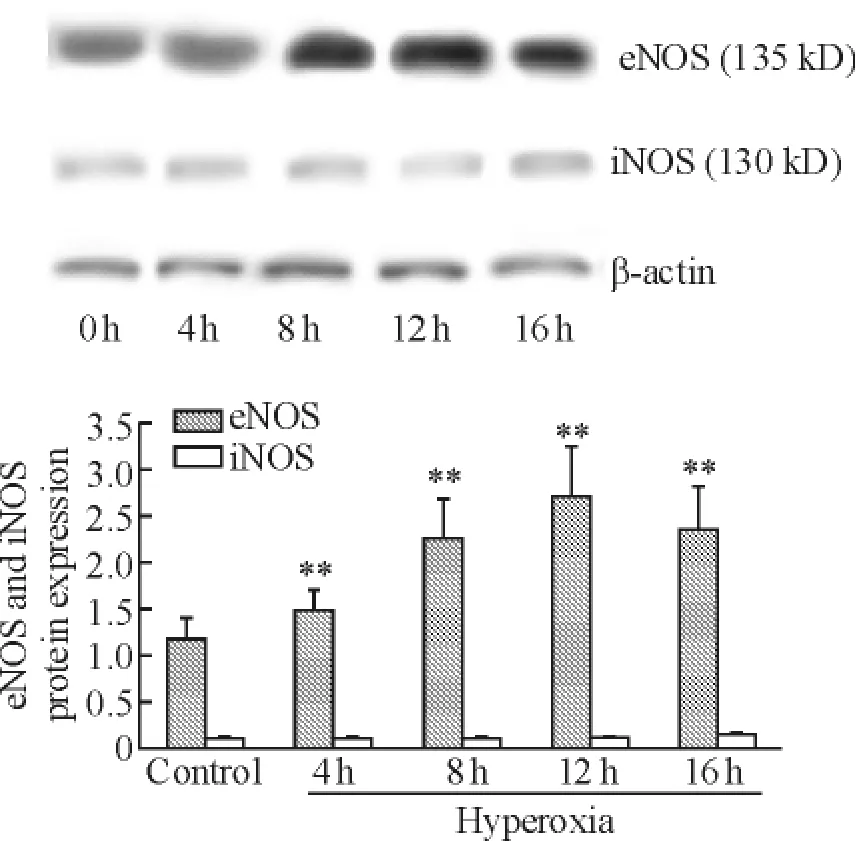
Figure 1.eNOS and iNOS expression in the lung of rats exposed to acute hyperoxia..n=6.**P<0.01 vs control.图1 急性吸氧大鼠肺组织eNOS和iNOS的表达
讨 论
吸氧是临床有效的治疗手段,但长期应用会导致副作用的产生,应注意老幼病人的长期应用适应症[1]。临床吸氧浓度大于50%即称为高浓度氧疗[4],特别临床全麻期间病人需要持续吸入85% ~100%高浓度氧,麻醉吸氧时间虽不长,但有时会碰到不明原因的拔管困难病例,这使得我们考虑急性高氧吸入是否造成肺损伤问题,我们在前期工作发现急性高氧吸入4 h即可引起实验大鼠的氧化水平异常并出现肺损伤[2]。

Figure 2.Pathological changes of lung tissues in rats exposed to acute hyperoxia(HE staining,×400).Control group:normal lung;hyperoxia 4 h group:mild pulmonary congestion;hyperoxia 8 h group:dilated pulmonary capillaries,obvious congestion,obvious neutrophilic exudate in the pulmonary interstitium and a few red cell exudate in the alveolar space;hyperoxia 12 h group:more red cell and neutrophilic exudate in the alveolar space;hyperoxia 16 h group:big bubble,atelectasis and mild alveolar wall thickening.图2 急性吸氧大鼠肺组织病理变化

Figure 3.Apoptosis of alveolar epithelial cells in rats exposed to acute hyperoxia(TUNEL,×400).图3 急性吸氧大鼠肺泡上皮细胞凋亡的情况
表2 各高氧组大鼠血浆及肺MDA、NO和NOS与肺泡上皮细胞凋亡的线性相关分析Table 2.Linear correlation coefficients between MDA concentration,NO concentration and NOS activity in plasma and lung tissues,and apoptosis of alveolar epithelial cells in rats exposed to acute hyperoxia(.n=12)

表2 各高氧组大鼠血浆及肺MDA、NO和NOS与肺泡上皮细胞凋亡的线性相关分析Table 2.Linear correlation coefficients between MDA concentration,NO concentration and NOS activity in plasma and lung tissues,and apoptosis of alveolar epithelial cells in rats exposed to acute hyperoxia(.n=12)
MDA NO NOS Plasma Lung Plasma Lung Plasma Lung Apoptosis 0.99 0.99 0.99 0.99 0.95 0.99
机体内活性氧-抗氧化系统平衡的破坏是高氧造成肺损伤的主要原因。NO既是一种生物信使分子和细胞毒性效应分子,又是重要的自由基。正常生理条件下,NO作为内皮舒张因子,参与组织和细胞的血液供应,但在氧化应急状态下,NO可与SOD有力地竞争O2-而形成强氧化剂ONOO-,即NO+,ONOO-可使细胞内许多重要的蛋白质或酶失活,破坏线粒体结构,使DNA链断裂,并可启动脂质过氧化[3,6-7],引起细胞坏死或凋亡。本实验发现,高氧吸入4 h后,大鼠血浆及肺组织MDA、NO和NOS水平就出现异常,同时形态学研究发现肺泡上皮细胞凋亡开始增加,且具有随吸氧时间延长肺组织形态变化加重的趋势,在16 h后开始恢复。提示吸入高浓度氧4 h体内NOS活性即已上调,NO生成增加,说明吸氧早期NO平衡已打破,NO及其衍生物在诱导肺泡上皮细胞凋亡和其它肺部形态改变中可能发挥了重要的介导作用。有报道高氧通过MAPKs通路导致肺泡上皮凋亡[8]。
NO可由位于血管内皮的eNOS、白细胞的iNOS和神经元的nNOS合成并分泌,有研究发现高氧条件下3 d后小鼠肺内iNOS和eNOS表达及其活性上调,NO生成增加[5],提示NO可能参与介导高氧性肺损伤。本实验Western blotting结果显示,正常肺组织主要表达eNOS,而iNOS较少表达;而高氧吸入4 h后,肺组织中主要是eNOS显著升高,而iNOS变化不大,仅在16 h有轻微升高,说明在急性高氧吸入时肺中的NO来源还是以eNOS合成的NO为主。
但细胞遭受应激损伤时,并不一定耗尽了胞内的SOD等抗氧化剂,而是微妙地调节胞内的信号转导途径[8-9],从而导致凋亡等细胞损伤出现。本实验形态研究表明,在急性高氧刺激下,随时间延续,肺组织表现为毛细血管扩张,通透性增加,伴有少量炎细胞渗出。细胞凋亡研究显示,4 h组肺泡上皮细胞凋亡明显增加;8 h组、12 h组凋亡细胞增加更加明显。而16 h组细胞凋亡明显下降,提示在急性高氧损伤过程中,在16 h时点细胞凋亡减少,可能是值得深入研究的问题。我们分析急性高氧不仅促进肺泡上皮细胞凋亡的增加,也促进肺毛细血管壁的通透性的增加,严重时可导致白细胞渗出,但并没有到使白细胞功能激活的程度,因为iNOS并没有很高的表达,肺部损伤病变处于容易恢复的状态。同时机体有强大的调整能力,在16 h时,可能已经开始恢复。
本实验采用的高浓度氧与全麻吸入氧浓度相同,吸氧4~8 h也与全麻时间接近。本实验结果提示急性高氧肺损伤模型中NO及其衍生物在诱导肺泡上皮细胞凋亡和其它肺部形态改变中可能发挥了重要作用,同时提示临床全麻期间吸入高浓度氧的安全性值得进一步研究。
[1]张亚维,陈贻骥,徐雅丽.维甲酸对高氧暴露新生大鼠肺组织角化细胞生长因子及其受体表达的影响[J].中国病理生理杂志,2011,27(1):27 -32.
[2]周 海,潘晓军,王建华,等.吸入不同时间高浓度氧对大鼠肺的损伤作用[J].中华麻醉学杂志,2006,26(5):473-475.
[3]Sugiura H,Ichinose M.Nitrative stress in inflammatory lung diseases[J].Nitric Oxide,2011,25(2):138 - 144.
[4]姚尚龙,刘俊杰.氧疗和高压氧治疗[M]∥庄心良,曾因明,陈伯銮.现代麻醉学.第3版.北京:人民卫生出版社,2004.2382 -2396.
[5]Chang L,Ma L,Zhang Y,et al.The rol of nitric oxide in hyperoxic lung injury in premature rats[J].J Tongji Med Univ,2001,21(1):78 -81.
[6]张向峰,梁 瑛,Foda HD.高氧所致小鼠急性肺损伤时一氧化氮合成酶的表达[J].中华急诊医学杂志,2004,13(6):365 -367.
[7]凌亦凌,黄善生.过氧亚硝基阴离子的细胞代谢及病理损伤作用[J].生理科学进展,1999,30(1):71-73.
[8]李文斌,常立文,容志惠,等.维甲酸通过MAPKs信号通路减轻早产大鼠AECⅡ高氧性损伤[J].中国病理生理杂志,2008,24(1):1-6.
[9]Patel RP,Moellering D,Murphy - Ullrich J,et al.Cell signaling by reactive nitrogen and oxygen species in atherosclerosis[J].Free Radic Biol Med,2000,28(12):1780 -1794.

