知母皂苷AⅢ药理活性及机制研究进展
尤 杰 孙兆林 季宇彬 陈明苍▲
1.中国科学院上海药物研究所,上海 201203;2.哈尔滨商业大学生命科学与环境科学研究中心,黑龙江 哈尔滨 150076
知母为百合科植物知母(Anemarrhena asphodeloides Bge.)的干燥根茎,味苦,性寒,归肺、胃、肾经,具有清热泻火、滋阴润燥、止渴除烦等功效,临床用于外感热病、高热烦渴、肺热燥咳、骨蒸潮热、内热消渴、肠燥便秘等症状[1]。知母皂苷作为知母的主要药理活性成分,在知母根茎中的含量约为6%[2]。近年来国内外专家对知母皂苷药理活性进行了深入的研究,尤其是对知母皂苷AⅢ的药效与药理作用有了许多全新的研究进展,现综述如下:
知母皂苷AⅢ (Timosaponin AⅢ),又称为西陵皂苷A(Xilingsaponin A),为典型的螺甾皂苷类成分,其母核为菝葜皂苷元[又称萨尔萨皂苷元(Sarsasapogenin)],是由菝葜皂苷元C22位的羟基脱氢后与两个果糖和一个葡萄糖缩合而形成的多糖苷[3],其结构如图1。研究证明,菝葜皂苷元C22位上的糖苷键是导致这类成分具有强大溶血作用的主要结构[4],因此知母皂苷AⅢ并不适合静脉注射给药,故口服给药的药理活性一直是国内外研究的热点。近几年对于知母皂苷AⅢ的药理活性的研究主要集中在以下几个方面:
1 心血管系统药理作用
1.1 抗血小板聚集
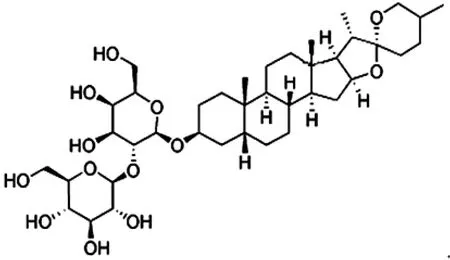
图1 知母皂苷AⅢ化学结构
早在20世纪80年代就有报道知母皂苷AⅢ的抗血小板聚集药理活性实验。Zhang等[4]通过对体外离心获得的人血小板成分给予知母皂苷AⅢ等6种知母皂苷类成分,测定活化部分凝血激酶时间(APPT)后发现,6种成分中仅知母皂苷AⅢ呈现出显著的抗血小板聚集作用。通过进一步研究发现,知母皂苷AⅢ的抗血小板作用主要通过抑制血中纤维蛋白酶的活性,同时也发现C-22位含有羟基,这是知母皂苷AⅢ具有抗血小板聚集活性的关键结构。王宁等[5]进一步说明了知母皂苷AⅢ抗血小板聚集的分子机制主要有以下几种:①知母皂苷AⅢ可激活偶联于G蛋白偶联受体Gq亚基上的血小板P2Y1受体,进而诱导血小板变形;②知母皂苷AⅢ能够抑制偶联于G蛋白的Gq和G12/G13亚基,阻止其传导活化信号,从而剂量依赖地抑制血小板聚集;③知母皂苷AⅢ可激活Gi信号通路,抑制腺苷酸环化酶,升高cAMP,从而抑制血小板凝聚;④知母皂苷AⅢ确实能通过抑制整合素αⅡbβ3的活化来抑制血小板与纤维蛋白原的结合,从而抑制聚集信号的进一步传递。知母皂苷AⅢ具有的抗血小板聚集作用提示了其可能具有的抗血栓形成的潜在药理活性,也说明此类有效成分今后有可能成为防治循环系统血栓甚至心脑梗死的全新药物。
1.2 血管扩张作用
Wang等[6]在对离体主动脉环实验中发现,知母皂苷AⅢ对预先给予去甲肾上腺素刺激挛缩的主动脉具有舒张作用。进一步研究发现,知母皂苷AⅢ可以刺激血管内皮细胞Ca2+内流,Ca2+的内流趋势不受血管内皮细胞内Ca2+浓度的影响,且知母皂苷AⅢ促进Ca2+内流的作用能被硝苯地平部分拮抗而不受Ca2+通道阻滞剂的影响。知母皂苷AⅢ刺激Ca2+内流后可刺激血管内皮细胞内血管舒张因子(NO)合酶,进而促进内皮细胞释放NO,NO又可反过来刺激Ca2+向内皮细胞内转移,这使得知母皂苷AⅢ的扩血管活性更强。由于血管内皮细胞上并没有Ca2+的电压门控通道,因此知母皂苷AⅢ刺激Ca2+内流的机制与激活Ca2+的电压门控通道无关,知母皂苷AⅢ刺激Ca2+内流的机制还有待进一步研究[7]。
2 改善记忆力和学习能力
Bomi等[8]发现知母皂苷AⅢ 40 mg/kg能显著降低谷氨酸诱导的老年痴呆模型小鼠在被动回避实验中的错误次数,并显著缩短错误潜伏期。其作用机制可能是升高了痴呆小鼠脑内去甲肾上腺素、多巴胺和五羟色胺浓度,进而提高了小鼠记忆力,同时知母皂苷AⅢ能减少痴呆小鼠背海马和齿状回内β-APP阳性神经元个数,因而改善小鼠老年痴呆症状。
3 抗肿瘤作用
国内外专家近期研究发现知母皂苷AⅢ具有很强的细胞毒性[9],近年来对于知母皂苷AⅢ细胞毒性机制的研究日益深入,欲将其开发成一种新的抗癌类药物,其主要研究结果如下:
3.1 诱导宫颈癌细胞(HeLa)凋亡
King等[10]发现知母皂苷AⅢ能够显著抑制HeLa细胞株生长,其作用机制可能是AⅢ进入线粒体后导致其功能异常,使得细胞内活性氧簇(ROS)大量生成,进而使HeLa细胞发生自溶和程序性死亡。同时还发现,知母皂苷AⅢ中的萨尔萨皂苷元结构母核能破坏细胞内线粒体膜稳定性,使AⅢ更易进入线粒体发挥作用。这些研究表明,知母皂苷AⅢ诱导HeLa细胞自溶过程会产生大量酸性巨型自体吞噬泡,这种吞噬泡与传统的诱导癌细胞自溶的活性成分所形成的中小型自吞噬泡大不相同,这暗示知母皂苷AⅢ可能具有比传统抗癌药更为强大的诱导细胞凋亡作用。
3.2 抗结肠癌作用
Kang等[11]在近期的研究中发现,知母皂苷AⅢ对体外培养的人结肠癌HCT-15细胞和种植入大鼠体内的同种癌细胞都有明显的抑制作用。其抗肿瘤作用机制在于其能有效地阻止细胞周期进行,其具体作用有以下几个方面:①知母皂苷AⅢ可有效减少细胞静止期(S期)和DNA有丝分裂前期(G2期)中原癌基因C及细胞周期调节蛋白(CDK4)的表达并能阻止肿瘤细胞抑制蛋白发生磷酸化;②在细胞有丝分裂准备期(G1期)及有丝分裂期(M期),知母皂苷AⅢ可明显下调细胞调节蛋白A和B1的表达水平。
3.3 抗乳腺癌作用
为了解释知母皂苷AⅢ诱导细胞凋亡的具体药理机制,Frank等[9]选用人乳腺癌细胞BT474以及相近的永生性乳房上皮细胞MCF10A作为研究对象,观察了知母皂苷AⅢ诱导细胞凋亡时半胱天冬酶(caspase)激活作用,并采用荧光分类技术测定多种caspase的活度后发现,AⅢ主要通过激活caspase-4和caspase-9,其对caspase-3和caspase-6作用不明显,说明知母皂苷AⅢ诱导细胞凋亡作用主要通过激活内质网小体应激而实现[12]。
近年来对于知母皂苷AⅢ抗肿瘤药理活性的研究正在不断深入,其抗肿瘤药理活性机制也不断被发现,从以上的研究不难看出知母皂苷AⅢ的抗肿瘤活性是多靶点的综合作用,这比起单一靶点抗癌的药物或许更有开发的潜力。
4 降血糖作用
有报道显示,知母总皂苷能降低KK-Ay小鼠血糖[13],但其主要成分和药理作用机制并没有太多报道。知母皂苷AⅢ作为知母总皂苷中的一个主要成分,其降血糖作用目前仍没有过多的研究报道。笔者查阅了近期国内外文献仅发现一篇关于知母皂苷AⅢ能显著改善人高血糖状态的专利文献,该文献报道了不同浓度知母皂苷AⅢ对于高血糖状态(450mg/dL)的改善作用。其研究发现知母皂苷AⅢ确有降低高血糖作用且其作用强度呈现浓度依赖性,其200 mg/kg剂量效果接近于罗格列酮,剂量300 mg/kg效果甚至优于罗格列酮[14]。但此专利并未涉及知母皂苷AⅢ降血糖具体机制。笔者猜测知母皂苷AⅢ降血糖作用可能与其中皂苷类似[15],主要是通过抑制α-葡萄糖苷酶活性。
5 其他药理作用
Youn等[16]发现知母皂苷AⅢ能够明显抑制感染人上皮细胞(HEp-2)呼吸道合胞病毒(RSV)活性,其半数抑制浓度(IC50)约为1.00μm,其研究虽未阐明知母皂苷AⅢ抗病毒的具体机制,但发现含螺甾烷骨架的化合物抗病毒活性比呋喃甾烷骨架的化合物更强,这提示了其抗病毒活性可能与其螺甾烷骨架有关。尚有报道称知母皂苷AⅢ具有很强的杀灭软体动物的药物活性[17],其具体的药理作用机制并没有过多的报道。也有文献报道知母皂苷AⅢ能够抗氧化,抗辐射,抑制超氧化物生成[18]。另外,有文献提及知母皂苷AⅢ能显著抑制兔肾Na+-K+-ATP酶活性,Na+-K+-ATP酶是机体基础代谢中产热的主要酶类,这提示知母皂苷AⅢ可能潜在具有降低内热的作用[19]。
6 展望
知母皂苷AⅢ在抗血小板凝聚、抗肿瘤领域的药理作用机制研究已日趋完善,但直至目前知母皂苷AⅢ仍未被开发成为适合静脉注射的药物,其原因是菝葜皂苷元C-22位上的糖苷键导致知母皂苷AⅢ具有强大的溶血作用。将来对知母皂苷AⅢ的结构修饰后使其溶血作用下降并且不影响其主要的药理活性将是此类成分的研究热点。关于知母皂苷AⅢ降血糖的药理作用机制直至目前也未有实验类文献报道,其降血糖作用的强弱和机制也是今后值得深入研究的重要方向。另外,在Hu等[20]最新的体外代谢实验研究发现,采用啤酒酵母对知母皂苷AⅢ进行体外生物转化后采用LC-ESI/MS检测法共检测出6个代谢成分,深入研究后发现除一个原型成分外其余5个成分中含有知母皂苷BⅡ和BⅢ以及BⅡ和BⅢ的15位羟基化产物。本课题组对知母皂苷AⅢ的体内代谢过程曾做过初步研究,结果发现知母皂苷AⅢ在大鼠体内存在多种代谢产物,其中1个代谢产物为脱去C-22位最外侧的葡萄糖,其结构可能与知母皂苷AI相似,但并未检测出类似BⅢ或BⅡ样代谢产物。因此笔者猜测知母皂苷AⅢ在体内代谢后可能同样具有知母皂苷AI的类似药理活性,知母皂苷AⅢ及代谢产物药理活性仍有待深入研究。
[1]徐爱娟,韩丽萍,蒋琳兰.知母的研究进展[J].中药材,2008,31(4):624-628.
[2]王迪,姜艳艳,石任兵.中药知母质量控制方法研究[J].北京中医药大学学报,2011,34(4):263-265.
[3]陈千良.“西陵知母”质量特征及其影响因素研究[D].北京:北京中医药大学,2006:45.
[4]Zhang JY,Meng ZY,Zhang MY,et al.Effect of six steroidal saponins isolated from anemarrhenae rhizoma on platelet aggregation and hemolysis in human blood[J].Clinica Chimica Acta,1999,289(5):79-88.
[5]王宁,吴学东,从玉文.知母皂苷AⅢ抑制血小板聚集的分子机制研究[D].大理:大理学院,2009:121.
[6]Wang GJ,Lin LC,Chen CF,et al.Effect of timosaponin A- Ⅲ ,from Anemarrhenae asphodeloides Bunge (Liliaceae),on calcium mobilization in vascular endothelial and smooth muscle cells and on vascular tension[J].Life Sciences,2002,71(12):1081-1090.
[7]Laver Derek R.Ca2+stores regulate ryanodine receptor Ca2+release channels via luminal and cytosolic Ca2+sites[J].Clinical and experimental pharmacology and physiology,2007,34(9):889-896.
[8]Bomi Lee,Kangsik Jung,Dong-Hyun Kim,et al.Timosaponin AⅢ, a saponin isolated from Anemarrhena asphodeloides,ameliorates learning and memory deficits in mice[J].Pharmacology Biochemistry and Behavior,2009,93(2):121-127.
[9]Frank King,Sylvia Fong,Chandi Griffin, et al.Timosaponin A Ⅲ is preferentially cytotoxic to tumor cells through inhibition of mTOR and induction of ER stress[J].Plos One,2009,4(9):326-334.
[10]King SL,Cheong YS,Nam LC,et al.Timosaponin A-Ⅲ induces autophagy preceding mitochondria-mediated apoptosis in HeLa cancer cells[J].Cancer research,2008,68(15):24-25.
[11]Kang YJ,Chung HJ,Nam JW,et al.Cytotoxic and antineoplastic activity of timosaponin A-Ⅲfor human colon cancer cells [J].Journal of Natural Products,2011,74(4):701-706.
[12]倪黎.内质网应激介导的心肌凋亡与心力衰竭的机制研究[D].上海:华中科技大学,2009:55.
[13]Toshihiro Miura,Hiroyuki Ichiki,Naoki wamoto,et al.Antidiabetic Activity of the rhizoma of anemarrhena asphodeloides and active components,mangiferin and its glucoside[J].Biol Pharm Bull,2001,24(9):1009-1011.
[14]Gu JG.A composition containing timosaponin A-Ⅲfor prevention and treatment of type 2 diabetes mellitus[P].KR:WO 2007/024108 A1.2007-01-03.
[15]Iehiki H,Takeda O,Sakakibara I,et al.Inhibitory effects of compounds from Anemarrhenae Rhizoma ona-glucosidase and aldose reductase and its contents by drying conditions[J].Journal of Natural Medicines,2007,61(2):146-153.
[16]Youn UJ,Jang JE,Nam JW, et al.Anti-respiratory syncytial virus(RSV) activity of timosaponin A-Ⅲ from the rhizomes of Anemarrhena asphodeloides[J].Journal of Medicinal Plants Research,2011,5(7):1062-1065.
[17]吉星,冯毅凡.知母中皂苷类成分研究进展[J].中草药,2010,41(4):12-15.
[18]Kan N,Zhang J,Meng Z,et al.Effect of timosaponin El and E2 on superoxide generation induced by various stimuli in human neutrophils and on plateJet aggregation in human blood[J].Clinica Chimica Acta,2000,295(1-2):129-140.
[19]朱起之,赵树进.知母皂苷对糖皮质激素副作用的影响[J].实用医学杂志,2001,17(7):583-584.
[20]Hu YM,Yu ZL,Fong WF.Stereoselective biotransformation of timosaponin A-Ⅲby saccharomyces cerevisiae[J].Journal of Microbiology and Biotechnology, 2011,21(6):582-589.

