葡萄糖浓度波动对INS-1细胞胰岛素分泌的影响
林 占 薛耀明 关美萍
1.广东省惠州市中心人民医院内分泌科,广东 惠州 516001;2.南方医科大学南方医院内分泌代谢科,广东 广州 510515
高糖分为持续性高糖及波动性高糖,研究发现波动性高糖同样可以导致严重的胰岛素分泌功能的损伤[1-2],其机制并未完全研究清楚。细胞ATP是近年来研究的热点,近年来发现胰岛素的分泌和胰岛β细胞内的ATP含量关系密切[3-4]。本实验拟用含不同葡萄糖浓度及是否含抗氧化剂N-乙酰半胱氨酸(NAC)的培养液干预INS-1细胞,通过比较持续性高糖及波动性高糖对ATP生成的影响及影响机制。
1 材料与方法
1.1 材料
RPMI 1640-培养基购自GIBAO,胎牛血清购自上海微科生化试剂有限公司,N-乙酰半胱氨酸及ATP检测试剂盒购自碧云天生物技术研究所。
1.2 方法
1.2.1 细胞培养 INS-1细胞贴壁生长于含有10%胎牛血清、0.6 mol/L谷氨酰胺、100 U/mL青霉素、100μg/mL链霉素、1 mmol/L丙酮酸钠、50 mol/L 2-巯基乙醇的普通RPMI 1640-培养基中,置于37℃、5%CO2、95%空气饱和湿度孵箱中培养。
1.2.2 实验分组 将INS-1细胞随机分为正常糖组(5.5 mmol/L葡萄糖培养液培养)、持续高糖组(16.7 mmol/L葡萄糖培养液培养)、波动组(用16.7 mmol/L葡萄糖培养液培养2 h,再换5.5 mmol/L培养3 h,每天重复3次,夜间9 h维持在5.5 mmol/L的培养液中)、NAC+正常糖组、NAC+持续高糖组、NAC+波动组,后3组的培养基中均预先负载终浓度为1.0 mmol/L NAC,余干预措施相同,均干预72 h。每组5个培养皿。各组每日均同时更换培养基以保持相同的处理条件,培养基事先恒温箱37℃水浴,以减少对细胞的损伤。
1.2.3 测定的指标及方法 分组干预结束后,用荧光素酶法检定细胞ATP含量,分别用2.8 mmol/L和16.7 mmol/L葡萄糖各刺激INS-1细胞1 h,收集上清后放免法测定其胰岛素分泌水平,分别作为基础和高糖刺激下胰岛素释放,计算高糖刺激胰岛素分泌/基础胰岛素分泌作为胰岛素分泌能力结果。结果均以胰岛细胞总蛋白校正。
1.3 统计学方法
数据用SPSS 13.0统计软件进行处理,计量资料数据以均数±标准差()表示,采用方差分析,各组内均数比较采用单因素方差分析 (One-way ANOVA),若方差不齐采用Welch近似方差分析;多重比较采用LSD法(Least-significant difference test),两两比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度葡萄糖及抗氧化剂对INS-1细胞胰岛素分泌水平的影响
六组基础胰岛素分泌(2.8 mmol/L葡萄糖刺激)差异无统计学意义(P>0.05),高糖刺激胰岛素分泌(16.7 mmol/L葡萄糖刺激)差异有统计学意义(P<0.05)。见表1。
表1 六组INS-1细胞的基础胰岛素分泌及高糖胰岛素分泌(,n=5)

表1 六组INS-1细胞的基础胰岛素分泌及高糖胰岛素分泌(,n=5)
组别基础胰岛素分泌(2.8 mmol/L葡萄糖刺激)(μU/μg protein)高糖刺激胰岛素分泌(16.7 mmol/L葡萄糖刺激)(μU/μg protein)正常糖组高糖组波动组NAC+正常糖组NAC+高糖组NAC+波动组F值P值6.21±0.73 5.89±1.18 5.85±1.04 6.12±0.84 5.93±0.84 6.03±0.89 0.115 0.988 22.91±2.18 16.55±2.13 12.73±2.48 22.41±3.05 19.71±2.01 19.50±2.51 13.365 0
2.2 不同浓度葡萄糖及抗氧化剂对INS-1细胞ATP含量及胰岛素分泌能力的影响
由表2可知,与正常糖组相比,持续性高糖组及波动组的胞内ATP含量及胰岛素分泌能力显著下降(P<0.01),且波动组下降更明显。使用抗氧化剂NAC干预持续性高糖组及波动组,两组的细胞ATP含量及胰岛素分泌能力均较未使用组显著增加(P<0.05)。
3 讨论
近年来,血糖波动的危害越来越受到关注,研究发现波动性高血糖不仅促进糖尿病慢性并发症的发生和发展[5-7],也可损伤β细胞的胰岛素分泌功能[1-2]。本研究发现,波动性高糖及持续性高糖均可损伤INS-1细胞的胰岛素分泌能力,且波动性高糖更严重。
已有研究发现,胰岛β细胞胰岛素分泌与ATP合成相偶联[3-4]。葡萄糖刺激胰岛素分泌的重要机制是葡萄糖增加ATP的合成,减少游离二磷酸腺苷,导致ATP敏感性K+通道关闭,细胞去极化,Ca2+通过钙电压门控通道内流,并产生一系列的级联放大效应使胰岛素分泌颗粒胞吐,胰岛素分泌到细胞外[4]。本研究结果发现,ATP含量在持续性高糖组及波动组均较正常糖组显著下降,且波动组下降更明显。本研究提示,波动性高糖及持续性高糖可能通过降低INS-1细胞的ATP生成降低其胰岛素分泌能力,且波动性高糖更严重。
表2 六组INS-1细胞ATP含量及胰岛素分泌能力的比较(,n=5)
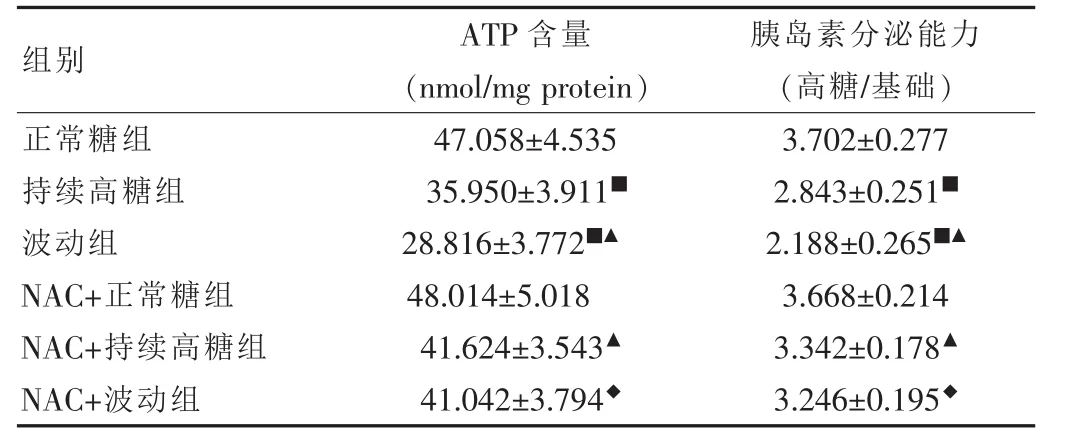
表2 六组INS-1细胞ATP含量及胰岛素分泌能力的比较(,n=5)
注:与正常糖照组比较,■P<0.01;与持续高糖组比较,▲P<0.05;与波动组比较,◆P<0.01
组别 ATP含量 胰岛素分泌能力(nmol/mg protein) (高糖/基础)正常糖组47.058±4.5353.702±0.277持续高糖组35.950±3.911■2.843±0.251■波动组28.816±3.772■▲2.188±0.265■▲NAC+正常糖组48.014±5.0183.668±0.214 NAC+持续高糖组41.624±3.543▲3.342±0.178▲NAC+波动组41.042±3.794◆3.246±0.195◆
高糖可引起胰岛β细胞功能紊乱,胰岛素分泌功能受损,其机制较复杂。近年来大量文献证实氧化应激在β细胞的损伤中发挥的重要作用[8]。胰岛β细胞系INS-1细胞株表达氧自由基清除酶少,对氧化应激损伤高度敏感,本实验采用该细胞株进行研究。已有多篇文献证实抗氧化剂NAC能够保护胰岛β细胞的分泌功能[9],本研究用NAC处理后发现,NAC+波动组及NAC+持续高糖组的细胞ATP含量及胰岛素分泌能力分别较波动组及持续高糖组显著增加,抗氧化剂可以显著改善细胞ATP及胰岛素分泌能力,提示波动性高糖及持续性高糖导致ATP合成减少可能与氧化应激有关。
综上所述,波动性高糖及持续性高糖可能通过氧化应激使ATP合成减少,且波动性高糖的程度更严重,最终导致INS-1细胞胰岛素分泌功能的损伤。这为以后改善ATP合成以减少β细胞高糖毒性提供更多的理论依据。但波动性高糖及持续性高糖使ATP合成减少的许多具体机制仍未证实,有待进一步的研究。
[1]Hou ZQ,Li HL,Gao L,et al.Involvement of chronic stresses in rat islet and INS-1 cell glucotoxicity induced by intermittent high glucose[J].Mol Cell Endocrinol,2008,291(1-2):71-78.
[2]Qiu P,Zhao TY,Li XJ, et al.Damage mechanism of intermittent exposure to high concentrations of glucose to beta cell lines(HIT-T15 cell)[J].Sichuan Da Xue Xue Bao:Yi Xue Ban,2008,39(1):69-71,93.
[3]Maechler P,Wang H,Wollheim CB.Continuous monitoring of ATP levels in living insulin secreting cells expressing cytosolic firefly luciferase[J].FEBS Lett,1998,422(3):328-332.
[4]Rutter GA.Visualising insulin secretion.The Minkowski Lecture 2004[J].Diabetologia,2004,47(11):1861-1872
[5]Azuma K,Kawamori R,Toyofuku Y,et al.Repetitive fluctuations in blood glucose enhance monocyte adhesion to the endothelium of rat thoracic aorta[J].Arterioscler Thromb Vasc Biol,2006,26(10):2275-2280.
[6]Yano M,Hasegawa G,Ishii M,et al.Short-term exposure of high glucose concentration induces generation of reactive oxygen species in endothelial cells:implication for the oxidative stress associated with postprandial hyperglycemia[J].Redox Rep,2004,9(2):111-116.
[7]Madsbad S,Brock B,Schmitz O,et al.Postprandial hyperglycemia.Postp-randial blood glucose fluctuations,cardiovascular disease and late diabetic complications[J].Ugeskr Laeger,2003,165(33):3149-3153.
[8]Robertson R,Zhou H,Zhang T,et al.Chronic oxidative stress as a mechanism for glucose toxicity of the beta cell in type 2 diabetes [J].Cell Biochem Biophys,2007,48(2-3):139-146.
[9]Tanaka Y,Gleason CE,Tran PO,et al.Prevention of glucose toxicity in HIT-T15 cells and Zucker diabetic fatty rats by antioxidants [J].Proc Natl Acad Sci USA,1999,96(19):10857-10862.

