那格列奈分散片的人体生物等效性研究
程 志,于 洋,胡玉钦,侯艳宁
(白求恩国际和平医院药剂科,河北 石家庄 050082)
那格列奈(nateglinide)是一种新型非磺酰脲类促胰岛素分泌的降糖新药,为 D-苯丙氨酸衍生物,通过与胰腺β细胞膜上的ATP敏感性钾通道(KATP)偶联受体相互作用,刺激胰岛素分泌,临床用于治疗2型糖尿病,具有起效快、作用时间短、耐受性好、心血管不良反应和低血糖发生率低等特点[1-3]。本试验中以合资公司生产的那格列奈片为参比制剂,研究了国产那格列奈分散片的人体生物等效性,旨在为药品注册和临床合理用药提供依据。
1 仪器与试药
Agilent 1100高效液相色谱系统,含在线脱气机、四元梯度泵、自动进样器、柱温箱(美国安捷伦公司);API 4000型三重四级杆质谱仪,Analyst 1.4软件(美国ABI公司);DAS药物代谢动力学专用程序。受试制剂那格列奈分散片(石药集团中诺药业<石家庄>有限公司,批号为041101,规格为每片30 mg);参比制剂那格列奈片(商品名为唐力®,北京诺华制药有限公司,批号为04008,规格为每片120 mg);那格列奈对照品(河北省药品检验所,批号为040801,含量为99.5%);地西泮对照品(内标,中国药品生物制品检定所,批号为171225-9601);甲醇、乙腈(色谱纯),甲酸、乙醚(分析纯),试验用水为市售娃哈哈纯净水。
2 方法与结果
2.1 研究对象选择
选择健康志愿者20名,男,无烟酒嗜好,年龄(22±1)岁,体重(63±6)kg,身高(172±5)cm。试验前经病史询问和体格检查,心电图、胸部X线透视、血常规、尿常规、肝功能、肾功能等均正常。试验前2周及试验期间未服用其他药物。试验前受试者均签署知情同意书。
2.2 给药方案和样品采集
采用两制剂两周期交叉试验设计。将20名受试者随机分为2组,交叉服用参比制剂或受试制剂。受试者于试验前进食清淡晚餐后禁食10 h过夜,试验当日早晨空腹口服参比制剂或受试制剂,剂量均为120 mg,用温开水250 mL送服。服药2 h后方可饮水,4 h和10 h后统一进餐。试验期间保持日常轻微活动,避免剧烈活动。清洗期为1周。受试者于服药前及服药后0.33,0.67,1,1.5,2,2.5,3,4,6,8,10 h 分别从肘静脉取血 2 mL,置肝素抗凝管中,离心分离血浆,-20℃冷冻保存至用。试验方案经白求恩国际和平医院伦理委员会批准实施。
2.3 血浆样品分析方法
2.3.1 色(质)谱条件与系统适用性试验
色谱柱为 Symmetry Shield RP18柱(20 mm × 3.9 mm,3.5 μm);流动相为甲醇-0.5%甲酸水溶液(80∶20,V/V);流速0.5mL/min;柱温20℃;进样量5 μL。质谱分析采用电喷雾离子化(ESI)源;负离子多离子反应监测(MRM)模式检测;喷雾电压为-4.5 kV;雾化温度为450℃;雾化气流速为35 L/min;帘气流速为25 L/min;碰撞气流速为4 L/min;辅助气流速为35 L/min。用于定量分析的离子反应分别为 m/z 318→m/z 166(那格列奈,[M-H]-),m/z 258→ m/z 193(内标,地西泮,[M -H]-),碰撞诱导解离(CID)电压分别为20 V(那格列奈)和40 V(内标,地西泮);驻留时间均为200 ms。上述色(质)谱条件下,血浆中内源性物质不干扰那格列奈及内标物的测定,那格列奈和内标物的保留时间分别为 0.95 min 和 0.65 min,色谱图见图 1。

图1 测定血浆中那格列奈的典型色谱图
2.3.2 血浆样品处理
取血浆样品 100 μL,依次加入内标工作液(1.0 μg/mL 地西泮水溶液)100 μL,水 0.5 mL,0.1 mol/L 的 HCl溶液 200 μL,再加入乙醚3 mL,涡流混合 1.0 min,1800×g离心10 min后,取上层有机相至另一干燥试管中,40℃水浴挥干,残留物用1.0 mL流相动溶解,进样5 μL用于 LC-MS/MS分析。
2.3.3 方法学考察
标准曲线制备:取空白血浆,分别加入不同质量浓度的那格列奈对照品溶液,制备成 10.00,3.00,1.00,0.30,0.10 和 0.05 mg/L的血浆样品,按2.3.2项下方法操作后进样分析,以血浆样品中那格列奈质量浓度(C,mg/L)为横坐标、那格列奈与内标的峰面积比(Y)为纵坐标,采用加权(1/C2)最小二乘法进行线性回归[4-5]。回归方程为 Y=1.724 C+1.522 × 10-2,r=0.9994(n=6),血浆中那格列奈的质量浓度在0.05~10 mg/L范围内与内标物的峰面积呈良好线性关系,最低定量限为0.05 mg/L。
回收率和精密度试验:取低、中、高(0.1,1,8 mg/L)3 个质量浓度的含那格列奈血浆样品,按照标准曲线制备项下方法操作,于1 d内和连续4 d处理并测定,每日各6份,计算日内、日间变异(RSD)及相对回收率。另分别配制上述3个质量浓度的那格列奈对照品溶液,按血浆处理方法不经萃取直接进样,记录色谱图和峰面积,与相应质量浓度的血浆样品测得的峰面积进行比较得绝对回收率。结果见表1。

表1 回收率和精密度试验结果(n=6,%)
稳定性试验:取低、中、高(0.1,1,8 mg/L)3 个质量浓度的含那格列奈血浆样品,每个质量浓度各2份,分别考察上述样本在室温放置24 h,经3次冻融循环及-20℃冷冻保存2周的稳定性。结果那格列奈血浆样品室温放置24 h,经3次冻融循环及-20℃冷冻保存2周相对偏差均小于10%,表明在上述条件保存稳定。
2.4 血药浓度和主要药物代谢动力学参数
20名健康受试者口服单剂量参比制剂和受试制剂120 mg后的平均血药浓度-时间曲线见图2,主要药物代谢动力学参数和相对生物利用度见表2。

图2 平均血药浓度-时间曲线
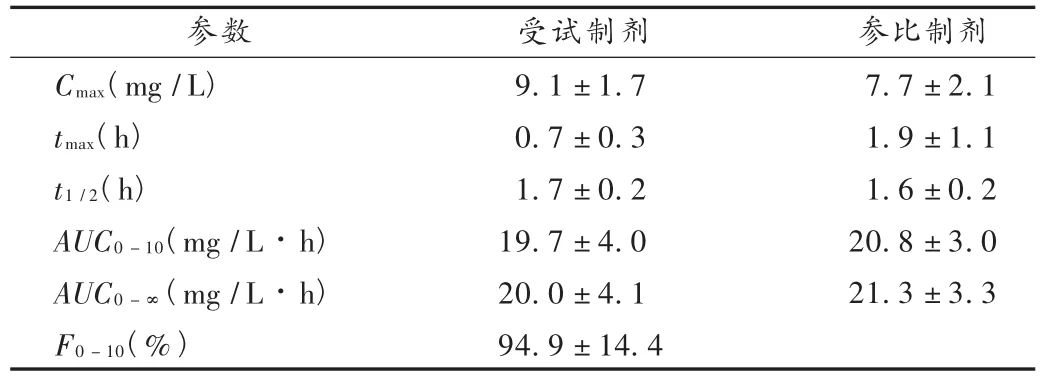
表2 主要药物代谢动力学参数(n=20)
2.5 生物等效性检验
非参数秩和检验结果表明受试制剂的达峰时间(tmax)与参比制剂存在显著性差异,口服受试制剂后达峰较快;峰浓度(Cmax)、0~10 h药时曲线下面积(AUC0-10)、0~∞药量曲线下面积(AUC0-∞)经对数转换后进行方差分析,2种制剂lnAUC0-10h差异无统计学意义,而lnAUC0-∞和lnCmax的差异均有统计学意义,口服受试制剂后 Cmax值较高、AUC0-∞值较低。双单侧 t检验结果表明,受试制剂与参比制剂具有生物等效性,其lnCmax的90%置信区间为104.6% ~130.3%(落在参比制剂的75% ~133%之间);lnAUC0-10h和 lnAUC0-∞的 90% 置信区间分别为 88.7% ~ 99.5%和88.2% ~99.4%(均落在参比制剂的80% ~125%之间)。
3 讨论
本试验采用专属、灵敏、准确的高效液相色谱-质谱/质谱法测定健康人口服那格列奈后的血药浓度。当口服剂量为120 mg时,平均最大血药浓度值约为10 mg/L,每个样品测定时间不足2 min,样品处理采用以乙醚为提取溶剂的液液提取法,操作简单、快捷,适用于人体药物代谢动力学研究。
试验结果显示,那格列奈片口服给药吸收迅速,血药浓度较低,半衰期短,消除迅速。单剂量口服参比制剂和受试制剂后在健康人体内的过程略有差异,受试制剂为分散片,口服后达峰较快、最大血药浓度(Cmax)值较高,而药物在体内吸收的程度相当(AUC0-10,P >0.05)或略低(AUC0-∞,P < 0.05)。
双单侧 t检验结果表明,两种制剂具有生物等效性,受试制剂的相对生物利用度为(94.9±14.4)%,表明受试制剂在临床使用可望取得与参比制剂相同的疗效。部分受试者服药后出现一过性头晕、乏力、出虚(冷)汗等症状,但均可耐受,无人因不良反应而终止试验。
[1]Tentolouris N,Voulgari C,Katsilambros N.A review of nateglinide in the management of patients with type 2 diabetes[J].Vasc Health Risk Manag,2007,3(6):797-807.
[2]黄晓程,贤晓丽.新型降糖药那格列奈的药理作用和临床应用[J].中国新药与临床杂志,2005,24(2):148-150.
[3]杨惠娣,徐 彬.2型糖尿病治疗新药那格列奈[J].世界临床药物,2004,25(9):564 -567.
[4]钟大放.以加权最小二乘法建立生物分析标准曲线的若干问题[J].药物分析杂志,1996,16(5):343 -346.
[5]于 洋,刘建芳,薛洪源,等.液相色谱-电喷雾质谱联用法测定人血浆中托吡酯[J].药物分析杂志,2004,24(4):358-361.

