2-甲基-5-取代苯硫基-1,3,4-噻二唑的合成研究
杨 梅,李 焰,任 君,冯锦锋
(1.湖北大学化学化工学院,湖北 武汉 430062;2.武汉工程大学化工与制药学院 绿色化工过程省部共建教育部重点实验室,湖北 武汉430074)
自20世纪80年代以来,1,3,4-噻二唑类化合物以其优越的物理性质和良好的化学活性而受到科学家们的关注,在很多领域都有相当重要的应用。该类化合物通常具有抑菌、抗菌活性[1],在农业上,可以作为除草剂、除莠剂、植物生长调节剂等[2];在医药上,常作为医药中间体来合成抗菌、抗焦虑、抗癌、舒张血管的药物[3~5];在工业上,常作为润滑油脂抗磨挤压剂[6,7],也用作钼、石墨等矿石的浮选剂[8]。
含1,3,4-噻二唑结构的分子大多涉及到C-S键的构建,因此,C-S键的构建是其分子合成的关键。C-S键的传统构建方法是用钯或镍作催化剂催化反应合成,但此类反应不仅需要结构复杂、价格昂贵的配体,而且反应条件苛刻(需无氧环境)。
作者在此以对空气不太敏感的碘化亚铜为催化剂、2-吡啶甲酸为配体,在较温和的条件下实现了芳基C-S键的构建,合成了2-甲基-5-取代苯硫基-1,3,4-噻二唑。
1 实验
1.1 试剂与仪器
所用试剂均为市售分析纯。
PE-SpectrumOne型傅立叶红外光谱仪(KBr压片);VARIANUnity-Inova600型核磁共振仪(600MHz,CDCl3为溶剂,TMS为内标);API-2000型液相色谱-质谱联用仪;X-6型显微熔点仪(温度计未经校正),北京泰克仪器有限公司。
1.2 合成路线
1.3 方法
在25 mL圆底烧瓶中加入3 mmol碳酸钾、 1 mmol 取代碘苯、1 mmol 2-巯基-5-甲基-1,3,4-噻二唑、0.4 mmol 2-吡啶甲酸、0.2 mmol碘化亚铜、2 mL二甲基亚砜,于70~80 ℃反应24~36 h,用二氯甲烷萃取(20 mL×3),水洗,饱和食盐水洗,无水硫酸镁干燥,过滤,浓缩,硅胶柱层析[乙酸乙酯∶石油醚=1∶(2~10)],得到目标化合物2-甲基-5-取代苯硫基-1,3,4-噻二唑。
2 结果与讨论
2.1 目标化合物的表征
2-甲基-5-(苯硫基)-1,3,4-噻二唑:白色固体;产率68%;m.p.93.6~94.6 ℃。IR(KBr),ν,cm-1:3662,2926,1474,1438,768,754,705,680,500;1HNMR(600 MHz,CDCl3,TMS),δ:7.607(d,J=6.6 Hz,2H,2,6-ArH),7.400(t,J=7.8 Hz,3H,3,4,5-ArH),2.642(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.92(Het-C),168.01(S-C-S),166.44(Me-C-S),134.07 (ArC-S),131.44,130.15,130.10;MS,m/z:209.0(M+)。
2-甲基-5-(4-甲基苯硫基)-1,3,4-噻二唑:白色固体;产率72%;m.p.113.5~113.7 ℃。IR(KBr),ν,cm-1:3655,2965,2924,1592,1492,1419,1388,1194,1082,815,509;1HNMR(600 MHz,CDCl3,TMS),δ:7.533(d,J=7.8 Hz,2H,2,6-ArH),7.233(d,J=7.8 Hz,2H,3,5-ArH),2.392(s,3H,Ar-CH3),2.648(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.65(Het-C),21.30(Ar-C),166.97(S-C-S),165.75(Me-C-S),140.64(ArC-Me),134.25(ArC-S),130.69,127.43;MS,m/z:223.0(M+)。
2-甲基-5-(4-硝基苯硫基)-1,3,4-噻二唑:黄色固体;产率92%;m.p.88.4~89.7 ℃。IR(KBr),ν,cm-1:3662,2926,2553,1742,1601,1530,1475,1390,1348,1198,1074,851,741,682,523,484;1HNMR(600 MHz,CDCl3,TMS),δ:7.657(d,J=9.0 Hz,2H,2,6-ArH),8.215(d,J=9.0 Hz,2H,3,5-ArH),2.806(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.89(Het-C),168.67(S-C-S),161.25(Me-C-S),147.39(ArC-NO2),140.60 (ArC-S),130.97,124.42;MS,m/z:254.0(M+)。
2-甲基-5-(4-甲氧基苯硫基)-1,3,4-噻二唑:白色固体;产率83%;m.p.106.2~106.4 ℃。IR(KBr),ν,cm-1:3662,2962,2929,2836,1589,1495,1388,1291,1250,1175,1077,1026,829,522;1HNMR(600 MHz,CDCl3,TMS),δ:7.594(d,J=8.4 Hz,2H,2,6-ArH),6.952(d,J=9.0 Hz,2H,3,5-ArH),3.850(s,3H,-OCH3),2.641(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3) ,δ:55.42(ArO-C),15.66(Het-C),170.43(S-C-S),165.42(ArC-OMe),161.32(Me-C-S),136.48(ArC-S),121.28,115.47;MS,m/z:239.0(M+)。
2-甲基-5-(4-氰基苯硫基)-1,3,4-噻二唑:黄色固体;产率74%;m.p.178.3~178.8 ℃。IR(KBr),ν,cm-1:3662,3078,3029,2230,1591,1488,1417,1393,1271,1194,1080,846,555;1HNMR(600 MHz,CDCl3,TMS),δ:7.653(d,J=8.4 Hz,2H,2,6-ArH),7.620(d,J=8.4 Hz,2H,3,5-ArH),2.782(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.92(Het-C),168.38(S-C-S),161.92(Me-C-S),138.33(ArC-S),132.97(ArC-CN),112.33(-CN),131.45,117.93;MS,m/z:234.0(M+)。
2-甲基-5-(4-氯苯硫基)-1,3,4-噻二唑:白色固体;产率73%;m.p.101.3~102.4 ℃。IR(KBr),ν,cm-1:3662,2923,1571,1477,1388,1193,1094,1082,1012,831,746,504;1HNMR(600 MHz,CDCl3,TMS),δ:7.570(d,J=9.0 Hz,2H,2,6-ArH),7.394(d,J=8.4 Hz,2H,3,5-ArH),2.697(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.77(Het-C),166.58(S-C-S),157.90(Me-C-S),136.34(ArC-S),134.98(ArC-Cl),130.07,129.40;MS,m/z:243.0(M+)。
2-甲基-5-(4-三氟甲基苯硫基)-1,3,4-噻二唑:黄色固体;产率57%;m.p.79.9~80.6 ℃。IR(KBr),ν,cm-1:3661,2966,1592,1583,1491,1390,1287,1211,1151,1081,924,840,807,517;1HNMR(600 MHz,CDCl3,TMS),δ:7.678(d,J=9.0 Hz,2H,2,6-ArH),7.265(d,J=8.4 Hz,2H,3,5-ArH),2.712(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.76(Het-C),166.74(S-C-S),166.14(Me-C-S),150.12,135.27,129.38,121.99,121.07;MS,m/z:277.0(M+)。
2-甲基-5-(2-三氟甲基苯硫基)-1,3,4-噻二唑:白色固体;产率62%;m.p.85.9~86.5 ℃。IR(KBr),ν,cm-1:3662,3035,1440,1390,1318,1176,1128,1112,1032,773,644,515;1HNMR(600 MHz,CDCl3,TMS),δ:7.786(t,J=9.0 Hz,2H,5,6-ArH),7.577(t,J=7.8 Hz,1H,3-ArH),7.542(t,J=7.2 Hz,1H,4-ArH),2.711(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.76(Het-C),167.35(S-C-S),164.99(Me-C-S),137.17,132.90,132.23,132.02,129.89,127.29,122.19;MS,m/z:277.0(M+)。
2-甲基-5-(3-三氟甲基苯硫基)-1,3,4-噻二唑:黄色固体;产率62%;m.p.72.2~72.6 ℃。IR(KBr),ν,cm-1:3663,3061,2976,1480,1425,1392,1321,1300,1176,1191,1159,1072,1047,902,806,696,649;1HNMR(600 MHz,CDCl3,TMS),δ:7.875(s,1H,2-ArH),7.807(d,J=7.8 Hz,4-ArH),7.676(d,J=7.8 Hz,6-ArH),7.551(t,J=7.8 Hz,5-ArH),2.712(s,3H,Het-CH3);13CNMR(150 MHz,CDCl3),δ:15.80(Het-C),167.16(S-C-S),164.81(Me-C-S),136.37,132.47,130.22,129.71,126.31,124.15,122.34;MS,m/z:277.0(M+)。
2.2 反应条件的优化
以取代碘苯(R=H)和2-巯基-5-甲基-1,3,4-噻二唑为原料,研究了溶剂、催化剂、配体、碱等条件对反应收率的影响,结果见表1。
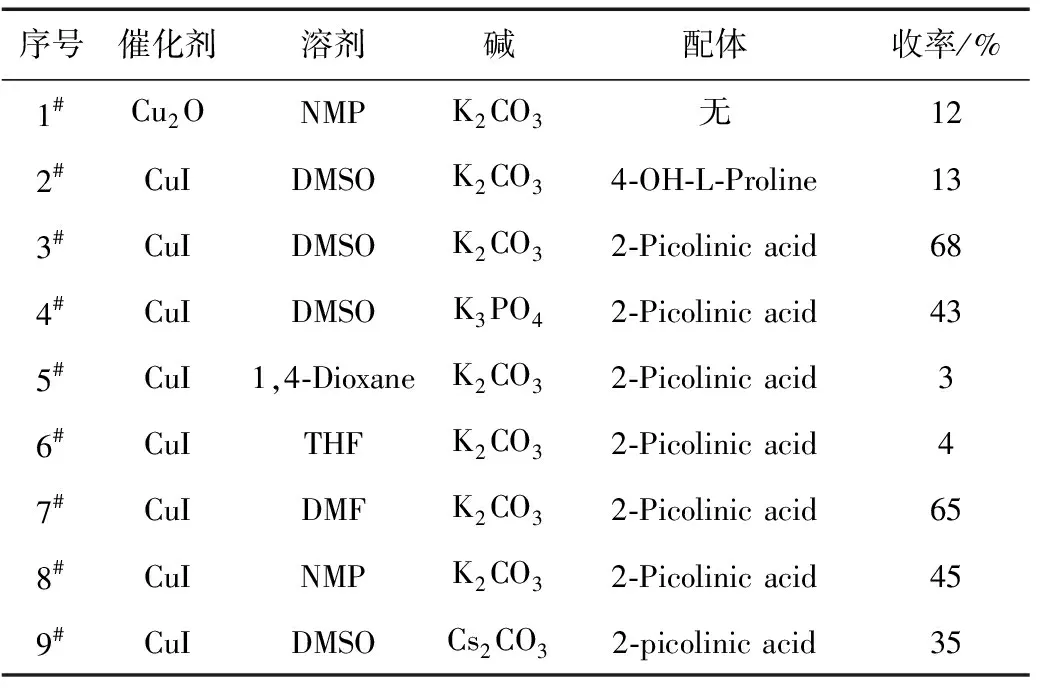
表1 不同反应条件对收率的影响
由表1可以看出,溶剂对反应收率的影响较大,在相同条件下,当使用非极性醚类溶剂(如1,4-Dioxane、THF)时,反应收率很低(<5%);而使用极性较大的质子性溶剂时,收率很高(>60%)。这可能是由于,CuI在醚类溶剂中的溶解度很小,很难与2-吡啶甲酸形成配合物,导致催化效率偏低;而CuI在DMF、DMSO和NMP中有一定的溶解度,较易与2-吡啶甲酸形成螯合物,因而催化效果较好。
配体的选择对反应收率也有较大的影响。当使用4-羟基-L-脯氨酸作配体(2#)、DMSO作溶剂时,收率只有13%;当配体为2-吡啶甲酸时(3#),收率达到68%,说明2-吡啶甲酸可以作为一种有效的配体促进反应的进行。这可能是由于,铜离子与4-羟基-L-脯氨酸的螯合配位体没有铜离子与2-吡啶甲酸的螯合配位体稳定,而硫的亲核性强于其它亲核原子(如N、O等),所以含硫化合物具有很强的配位能力,易造成金属催化剂中毒,一定程度上抑制了反应的进行。
无机碱对反应收率也有较大的影响。当选用碳酸铯时(9#),收率相比磷酸钾和碳酸钾要低。这是由于,碳酸铯的溶解度较小,导致反应体系的碱性不够,不能很好地吸收反应释放出的碘化氢。当使用强碱如氢氧化钾、乙醇钠时,无法得到目标产物。这是由于2-巯基-5-甲基-1,3,4-噻二唑在强碱条件下杂环开环。
3 结论
以取代碘苯和2-巯基-5-甲基-1,3,4-噻二唑为原料、碘化亚铜为催化剂、2-吡啶甲酸为配体、二甲基亚砜为溶剂,合成了一系列2-甲基-5-取代苯硫基-1,3,4-噻二唑类化合物。该方法反应条件温和、操作简便、经济、易行且不需要无氧的环境。
[1] Nigam R,Swarup S,Saxena V K,et al. Synthesis and pharmacological screening of some new 2-thioxo-3-(substituted aminomethyl)-5-(3,5-dinitrophenyl)-1,3,4-oxadiazoles[J].Indian Chem Soc,1992,69:692-693.
[2] 王忠义,元田耙,元凌峰.3,6-二芳基-5,6-二氢均三唑[3,4-b][1,3,4 ] 噻二唑的合成及生物活性[J].有机化学,1999,19(3):289-293.
[3] 胡国强,张忠泉,许启泰.相转移催化合成吡啶三唑并噻二唑及舒张血管活性研究[J].化学学报,2004,62(2):204-207.
[4] Clerici F,Pocar D,Guido M,et al.Synthesis of 2-amino-5-sulfanyl-1, 3, 4-thiadiazole derivatives and evaluation of their antidepressant and anxiolytic activity[J].J Med Chem,2001,44(6):931-936.
[5] Hovsepian T R,Dilanian E R,Encoyana A P,et al. Synthesis of substituted 1,2,4-thiazoles and 1,3,4-thiadiazoles[J].Chemistry of Heterocyclic Compounds,2004,40(9):1194-1198.
[6] 康茵,孙洪伟.含酯基的二巯基噻二唑二聚物的摩擦学性能[J].石油学报(石油加工),2007,23(1):82-86.
[7] Yao Jun-bing, Wang Rui-hua. The thiadiazole derivatives used as antiwear/extreme pressure additives[J].Lubricating Oil,2005,2(20):53-58.
[8] Bishop M D,Bartlesvlle O. Ore flotation employing amino mercaptothiadiazoles[P].USP 4 966 688,1990-10-30.

