急性缺血性肾损伤大鼠VEGF表达与肾小管坏死评分的相关性研究▲
霍冬梅 伍巧源 冯 炜 张影华 廖蕴华
(广西医科大学第一附属医院肾内科,南宁市 530021)
急性肾损伤(AKI)是一种常见的临床综合征,其病死率很高。已发现在原发肾脏疾病及糖尿病肾病肾组织中血管内皮生长因子(VEGF)的表达常有改变,并且参与了疾病的发生、发展及转归。而在AKI时VEGF水平变化研究较少。本文在建立大鼠肾脏缺血再灌注损伤(IRI)模型的基础上,采用双抗体夹心ELISA法和快速型免疫组化二步法检测IRI术后不同时间段肾脏组织VEGF表达水平,并与肾功能、肾小管坏死等相关指标做相关分析,以了解VEGF在肾脏IRI中的作用,为AKI发病机制以及治疗提供理论依据。
1 材料和方法
1.1 实验对象 健康雄性 Wistar大鼠 60只,体重(268.9±8.94)g,随 机 分 成 假 手 术 组、手 术 组 2 组(各30只)。两组大鼠再分别随机分成手术后5个不同时段亚组(6、12、24、48、72 h),每个亚组6 只大鼠,各亚组大鼠体重差异无统计学意义。
1.2 实验方法 实验参照Jorge等[1,2]的方法,每组大鼠均以水合氯醛腹腔内注射麻醉后,经背双侧肋弓下缘距脊柱约0.5 cm处行约长1.5 cm的纵行切口,钝性分离并暴露双侧肾脏,各组处理分别如下,①手术组:小心分离双侧肾动脉,用无创性动脉夹夹闭双侧肾动脉,双侧肾脏颜色先由鲜红色变苍白,然后转为暗红色,60 min后松夹恢复灌注,肾脏颜色再变成鲜红色,确定肾脏恢复血流后逐层关腹并缝合切口,建立肾脏 IRI模型,术后大鼠自由摄食和饮水。②假手术组:暴露双侧肾脏后,覆盖浸有生理盐水的纱布,60 min后去除纱布后逐层关腹,缝合切口,术后大鼠自由摄食和饮水。
1.3 标本采集及检测
1.3.1 采血 术前每只大鼠采血,分别于手术后6 h、12 h、24 h、48 h、72 h将手术组和假手术组大鼠采血,血清送检测血 BUN、Cr。
1.3.2 处置 取部分肾脏组织置于10%中性甲醛溶液固定,送病理科由专人负责常规石蜡包埋、切片及染色等操作。
1.3.3 光镜观察及肾小管坏死评分 肾组织常规切片做HE染色。用显微镜观察肾组织学改变,病变严重处用400倍高倍镜观察,并取10个高倍镜视野共100个肾小管,根据Paller氏法进行肾小管评分[3]:肾小管明显扩张、细胞扁平(1分);肾小管内出现管型(2分);肾小管腔内有脱落、坏死的细胞,但未成管型或细胞碎片(1分);上皮细胞颗粒变性(1分);空泡变性(1分);细胞核固缩(1分)。
1.3.4 肾组织VEGF的表达 使用快速型免疫组化二步法检测肾脏组织VEGF表达。结果分析:①肾小球VEGF表达。阅片时计算平均每个肾小球横切面中VEGF阳性细胞数目,以细胞/肾小球横向联合切面表示(VEGF+cells,gcs-1),每张片计数10个以上肾小球。数据以s表示。②肾小管内VEGF表达。200倍视野下随机选取20个不同视野场,测定集合管VEGF阳性面积占视野面积的百分比,取均值作为衡量肾小管内VEGF表达的指标。
1.4 统计学方法 所 有数据应用SPSS 13.0统计软件进行统计分析。计数数据以均数±标准差(s)表示,各组间样本均数比较均采用单因素方差分析(one-way ANOVA),各指标间的相互关系采用Pearson直线相关分析。
2 结果
2.1 各组手术前后肾功能检测 ①各组不同时段术前血清BUN、sCr之间、假手术组术后与术前对比及假手术后不同时段间对比差异均无统计学意义(P>0.05)。②手术组血清BUN、Cr于术后6 h较术前及相应时段假手术组对比已经显著升高,并随时间延长逐渐升高,高峰期在术后48 h。差异有统计学意义(P<0.05),见表1。

表1 各组大鼠不同时段血清BUN、sCr变化
2.2 肾组织VEGF的表达
2.2.1 肾小球VEGF表达 各手术组肾小球VEGF表达在不同时间段间及与各假手术组间比较均无统计学意义(P>0.05)。见表2。显微镜下观察比较术后6 h、12 h、24 h、72 h各组情况见图1~图10。

表2 各组大鼠不同时段肾小球VEGF表达 (gcs-1)
2.2.2 肾小管内VEGF表达 ①假手术组各时段肾小管内VEGF表达差异无统计学意义(P>0.05);②手术组肾小管VEGF表达于术后6 h较相应时段假手术组显著增多,于术后12 h达到最高,从术后24 h开始表达逐渐减少,并于术后72小时肾组织VEGF表达较假手术组无显著差异。见表3。显微镜下两组各时间段对比见图1~图10。
表3 各组大鼠不同时段肾小管内VEGF表达 ( s)
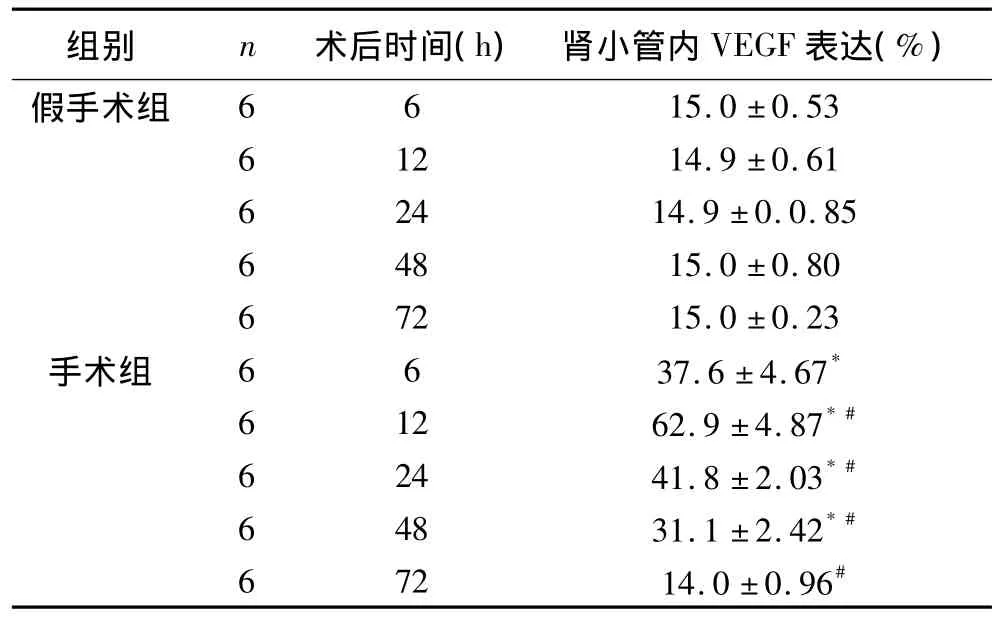
表3 各组大鼠不同时段肾小管内VEGF表达 ( s)
*vs假手术组P<0.01;#vs前一时段手术组P<0.01。
组别 n 术后时间(h)肾小管内VEGF表达(%)假手术组6 6 15.0 ±0.53 6 12 14.9 ±0.61 6 24 14.9 ±0.0.85 6 48 15.0 ±0.80 6 72 15.0 ±0.23手术组 6 6 37.6 ±4.67*6 12 62.9 ±4.87*#6 24 41.8 ±2.03*#6 48 31.1 ±2.42*#6 72 14.0 ±0.96#
2.3 光镜下肾小管坏死评分 ①各不同时段假手术组肾小管坏死评分差异无统计学意义(P>0.05);②手术组肾小管坏死评分于术后6 h与相应时段假手术组对比已经显著升高 ,并随时间延长而逐渐升高,高峰期在术后48 h(P <0.01),见表4。
表4 各组大鼠不同时段肾小管坏死评分 ( s)

表4 各组大鼠不同时段肾小管坏死评分 ( s)
*vs假手术组P<0.01;#vs前一时段手术组P<0.01。
肾小管坏死评分假手术组组别 n 术后时间(h)15.3 ±0.56 6 12 14.8 ±0.75 6 24 15.3 ±0.82 6 48 15.2 ±0.75 6 72 14.5 ±1.05手术组 6 6 44.3 ±3.50*6 12 62.5 ±1.87*#6 24 97.3 ±1.63*#6 48 148.7 ±5.43*#6 72 122.5 ±3.78 6 6*
2.4 肾组织VEGF表达及与其他指标的Pearson直线相关分析 肾小球内VEGF表达与术后血BUN、Cr水平、肾小管坏死评分均无显著相关性(P>0.05);肾小管VEGF表达与术后血 BUN、Cr水平、肾小管坏死评分均呈正相关(P <0.05)。见表5。
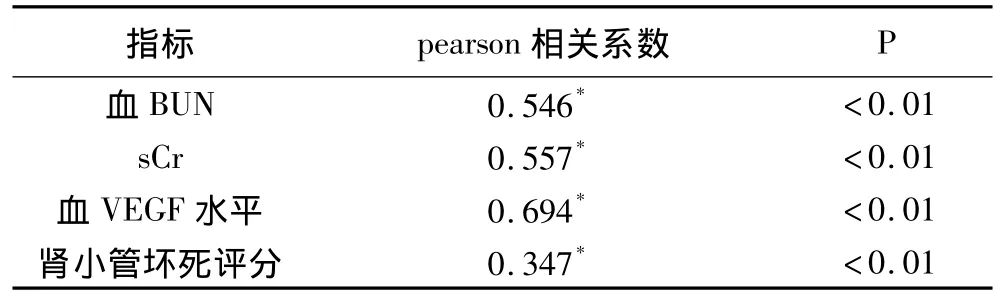
表5 肾小管VEGF表达与其他指标的相关性分析
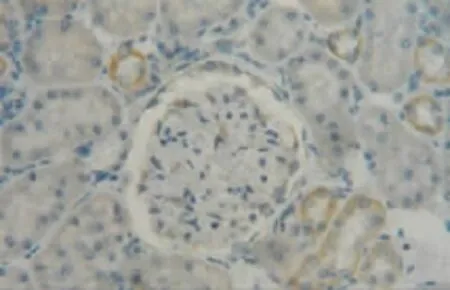
图1 肾假手术6 h组肾组织VEGF少量表达(DAB染色,×400)
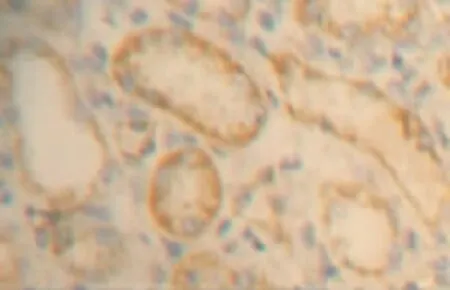
图2 肾IRI 6 h组肾小管VEGF表达明显增多(DAB染色,×400)
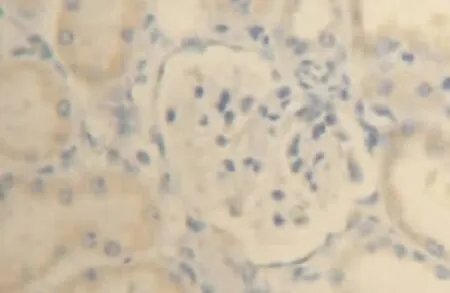
图3 肾假手术12 h组肾组织VEGF少量表达(DAB染色,×400)

图4 肾IRI 12 h组肾小管VEGF高度表达(DAB染色,×200)

图5 肾假手术24 h组肾组织VEGF少量表达(DAB染色,×400)
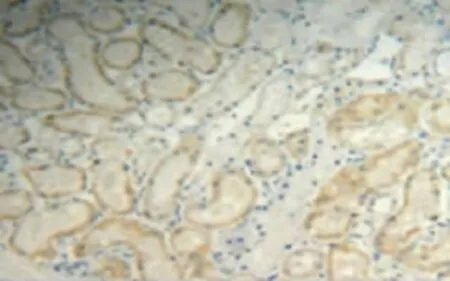
图6 肾IRI 24 h组肾小管VEGF表达增多(DAB染色,×200)
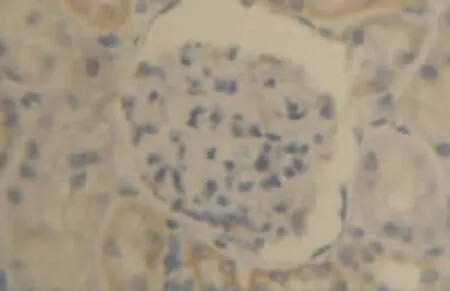
图7 肾假手术48 h组肾组织VEGF少量表达(DAB染色,×400)
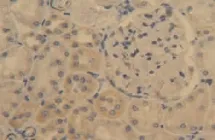
图8 肾IRI 48 h组肾小管VEGF表达增多(DAB染色,×400)
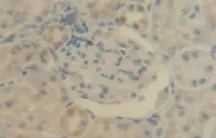
图9 肾假手术72 h组肾组织VEGF少量表达(DAB染色,×400)

图10 肾IRI 72 h组肾小管VEGF表达无增多(DAB染色,×400)
3 讨论
1989年Ferrara等[4]报道在牛垂体星形胶质细胞体外培养液中分离并纯化出血管内皮细胞生长因子(VEGF)。此后许多研究表明,VEGF与受体结合后具有促新血管生长、增加血管通透性、维持血管作用、促进内皮细胞增殖、细胞质聚钙作用、增加单核细胞趋化性并能活化蛋白酶等作用[5]。通过大量实验表明,缺血或缺氧是诱导VEGF表达的最主要的因素。Bernaudin等[6]在对新生大鼠脑缺血缺氧的研究中亦发现有VEGF表达的明显增多。本研究检测肾IRI模型中肾组织VEGF的表达和肾功能、肾小管坏死评分变化,探讨VEGF在肾脏IRI过程中的变化及可能的发病机制。
3.1 肾功能指标的变化 国内外文献均显示在肾脏IRI模型中血BUN、Cr均较假手术组明显增高。本研究显示大鼠肾脏IRI术后6 h血BUN、Cr已明显增高,于手术后48 h达高峰,术后72 h开始回落。提示本研究肾脏IRI模型中肾功能损害最严重是在术后48 h。本研究以手术后6 h为始点,手术后6 h血BUN、Cr水平已显著升高,但血BUN、Cr水平从手术后何时开始升高暂不清楚,有待进一步研究观察。
3.2 肾组织VEGF的表达 本研究显示假手术组有少量肾小球内VEGF表达及较普遍的肾小管内VEGF表达,主要分布在外髄部肾小球和远端肾小管、集合管。本研究假手术组肾脏VEGF表达主要分布在外髄部的原因还不明确。根据肾脏外髄部供氧的特殊性[7],这个区域的氧分压较低,推测即使在不缺血的情况下这个区域上皮细胞亦可诱导VEGF的合成。本研究显示肾小管内VEGF表达于手术后6 h较假手术组显著增多,术后12 h达高峰,后渐下降,于手术后72 h降至假手术组水平。肾小管表达增多的部位最早出现在外髄部、小叶间动脉末梢附近肾小管,并随灌注时间延长逐渐波及肾皮质及其他部位。本研究肾小管内VEGF表达于手术后12 h开始下降,推测可能因为严重缺血缺氧导致肾小管上皮细胞坏死增加、肾小管上皮细胞绝对数量减少,使得肾小管分泌和表达VEGF减少。从以上结果,我们推测VEGF可能参与早期肾脏IRI的病理过程并扮演着重要的角色,但其具体作用机制还有待于进一步的研究证实。
3.3 光镜肾小管坏死评分变化 本实验手术组肾小管坏死评分随术后时间的延长逐渐增高,于手术后48 h达高峰,手术后72 h开始回落。肾小管坏死评分的过程支持肾小管损伤于肾脏IRI后48 h达最严重程度,而此时的血BUN、Cr水平亦达到高峰,说明肾小管坏死是肾IRI模型肾功能受损的主要因素。
3.4 肾组织VEGF表达与其他指标的相关性分析 为了进一步探讨肾组织VEGF的表达是否与肾脏IRI严重程度有关,以及其在该病变过程中的作用,本研究把肾组织VEGF表达水平与其他指标做了相关性分析。结果显示,肾小球VEGF表达与手术后血BUN、Cr水平和肾小管坏死评分呈正相关。随着肾小管内VEGF表达的升高,血BUN、Cr水平和肾小管坏死评分也逐渐升高。提示肾小管内VEGF表达程度可以作为反映肾脏IRI损伤严重程度的指标。
综上所述,肾IRI模型中再灌注后肾功能、肾小管坏死评分均有不同程度的升高,高峰期均在手术后48 h,提示该模型在手术后48 h肾功能损害最严重;肾小管VEGF表达与IRI后血BUN、Cr水平和肾小管坏死评分呈正相关,提示肾小管VEGF表达的增高程度可以作为反映肾脏IRI严重程度的指标。
[1]Flores J,Donald R,DiBona OR.The role of cell swelling in ischemic renal damage and the protective effect of hypertonic solute[J].J Clin Invest,1972,51(1):118 -126.
[2]张维平,潘淑琴,刘 英,等.急性肾功能衰竭动物模型的电镜观察[J].白求恩医科大学学报,1996,22(5):505.
[3]Jablonski P,Howden BO,Rae DA,et al.An experimental model for assessment of renal recovery from warm ischemia[J].Transplantation,1983,35(3):198 -204.
[4]Ferrara N,Henzel WJ.Pituitary follicular cells secrete a novel heparin-binding growth factor specific for vascular endothelial cells[J].Biochem Biophys Res Commun,1989,161(2):851 -858.
[5]Honkanen EO,Teppo AM,Gronhagen-Riska C.Decreased urinary excretion of vascular endothelial growth factor in idiopathic membranous glomerulonephritis[J].Kindey Int,2000,57(6):2343 -2349.
[6]Bernaudin M,Tang Y,Reilly M,et al.Brain genomic response following hypoxia and re-oxygenation in the neonatal rat:identification of genes that might contribute to hypoxia-induced ischemic tolerance[J].J Biol Chem,2002,277(42):39728 -39738.
[7]Brezis M,Rosen S.Hypoxia of the renal medulla-its implications for disease[J].N Engl J Med,1995,332(10):647 - 655.

