羊藿三七提取物中主成分淫羊藿苷的肠吸收研究
吴青青, 陈 彦, 蔡 垠, 贾晓斌
(江苏省中医药研究院,国家中医药管理局中药释药系统重点研究室,江苏南京210028)
组分配伍中药中有效组分的生物药剂学特性是影响创新中药口服吸收及其生物利用度的关键环节[1-2]。而以往创新中药的研发较重视活性组分的提取纯化及制剂工艺成型等过程,较少关注提取物的生物药剂学特性。“复方羊藿三七片”收载于国家药品标准,由药材淫羊藿和三七组成,具有温阳通脉,化瘀止痛之功效[3],但其活性组分的生物药剂学特性不详,影响了其深度开发与疗效的发挥。因此本研究选择羊藿三七复方为模型药物,采用Caco-2细胞模型,考察羊藿三七提取物中主成分淫羊藿苷的肠吸收转运情况并与淫羊藿提取物及单体淫羊藿苷比较,为中药组分尤其是难溶性组分与低膜渗透性组分的适宜剂型的设计提供科学依据。
1 材料
Caco-2 TC7细胞株 (由法国 Moniqué Rousset博士馈赠);非必需氨基酸 (JRH公司);谷氨酰胺、胰蛋白酶 (Sigma公司);胎牛血清 (Equitech-Bio,INC公司);DMEM培养基 (Hyclone公司);淫羊藿苷 (批号110737-200312,供定量测定用)购自中国药品生物制品检定所;乙腈为色谱纯,水为超纯水,其他试剂均为分析纯。
三七药材购于同济药业有限公司,产地:云南;淫羊藿药材,购自吉林敦化,经南京中医药大学吴德康教授鉴定分别为朝鲜淫羊藿Epimedium koreanum Nakai和三七Panax notoginseng。
二氧化碳培养箱 (Nuaire,美国);XDS—1B倒置显微镜 (重庆);高速冷冻离心机 (Allergra X-22R,Beckman, 美 国);Transwell培 养 板(NUNC,丹麦);Millicell—ERS跨膜电阻仪 (Millipore,美国);Agilent 1200型高效液相色谱仪(Agilent,美国);Milli—Q纯水机 (Millipore,美国)。
1.1 羊藿三七提取物及淫羊藿提取物的制备 羊藿三七提取物制备:称取处方量淫羊藿600 g,加水煎煮2次,第1次2 h,第2次1 h,合并煎液,滤过;称取三七粗粉200 g,加水煎煮3次,第1次3 h,第2次2 h,第3次1 h,合并煎液,滤过,滤液与淫羊藿滤液合并,减压浓缩成相对密度为1.30~1.35(80~85℃)的稠膏,干燥即得羊藿三七提取物。
淫羊藿提取物制备:称取淫羊藿600 g,加水煎煮2次,第1次2 h,第2次1 h,合并煎液,滤过,滤液减压浓缩 (80~85℃)成稠膏,干燥即得淫羊藿提取物。
1.2 不同样品淫羊藿苷的跨膜转运实验
1.2.1 样品溶液的配制 淫羊藿苷溶液配制:精密称取淫羊藿苷3.38 mg,将其溶解于500 μL DMSO-无水乙醇溶液中,精密吸取该溶液100 μL置50 mL量瓶中,用 Hank's平衡盐溶液 (HBSS溶液)溶解定容,配制成含淫羊藿苷 20 μmol/L的溶液。
羊藿三七提取物溶液配制:精密称取羊藿三七提取物132.0 mg,按“淫羊藿苷溶液配制”方法,将其配制成含淫羊藿苷20 μmol/L的溶液。
淫羊藿提取物溶液配制:精密称取淫羊藿提取物101.3 mg,按“淫羊藿苷溶液配制”方法,将其配制成含淫羊藿苷20 μmol/L的溶液。
睾丸酮内标溶液配制:精密称取睾丸酮14.4 mg,加乙腈溶解定容至5 mL,配制成质量浓度为10 μmol/L的贮备液。精密吸取该贮备液0.1 mL,加入9.4 mL乙腈与0.6 mL冰乙酸,混合均匀,即得含睾丸酮100 μmol/L的内标溶液。
1.2.2 转运实验[4-5]Caco-2细胞培养于 DMEM培养液,其中含10%胎牛血清,1%非必需氨基酸,1%谷氨酰胺和青霉素 (100 U/mL)-链霉素(100 μg/mL)双抗液,于37℃、5%CO2培养箱中培养,细胞培养19~21 d可用于实验。
转运实验前,先用37℃ pH 7.4的HBSS溶液将细胞单层洗涤3次,检测各孔跨膜电阻值大于100 Ω/4.2 cm2以上,方可用于实验。将已配置的药物溶液分别加在细胞绒毛面顶侧 (AP侧)或基底面侧 (BL侧),相对应的BL侧或AP侧加入空白HBSS溶液,体积分别为2 mL。将加完药和空白HBSS溶液的培养板置于恒温摇床中 (50 r/min,37℃),分别在1,2,3、4 h在细胞供给池或接收池取样400 μL,同时在细胞供给或接收侧补充等体积的药物溶液或HBSS溶液。试验平行做3份。
1.2.3 样品处理 将所取样品立刻加入100 μL的睾丸酮 (100 μmol/L)内标溶液,13000 r/min离心15 min,按照HPLC分析方法进行检测。
1.2.4 高效液相样品分析 ZORBAX SB-C18柱(4.6 mm ×250 mm,5 μm);流动相为乙腈-水,梯度洗脱:0~15 min,乙腈10% ~25%;15~38 min,乙腈25%;38~61 min,乙腈25% ~71%;61~70 min,乙腈71%;体积流量1 mL/min,检测波长268 nm;柱温为30℃。HPLC图谱见图1。

图1 淫羊藿苷 (A)、淫羊藿提取物 (B)和羊藿三七提取物 (C)Caco-2细胞实验转运4 h HPLC图(BL-AP)Fig.1 HPLC chromatography of 4h Caco-2 cell transport sample(BL-AP)of icariin(A),extract of Epimedii Herba(B)and extract of Yanghuo Sanqi Tablats(C)
1.2.5 数据分析[6]药物透过Caco-2细胞单层的能力以表观渗透系数Papp值为考察指标,其计算公式:Papp=(dQ/dt)/SC
其中dQ/dt为接收池待测药物浓度变化的表观线性速率,S为Caco-2细胞膜表面积 (4.2 cm2),C为药物的初始浓度。用Excel表对实验数据进行计算分析。
2 结果
20 μmol/L淫羊藿苷及含有20 μmol/L淫羊藿苷的复方羊藿三七提取物及淫羊藿提取物通过Caco-2细胞单层转运的渗透系数测定结果见表1。实验结果表明,在淫羊藿苷浓度相同的条件下,羊藿三七提取物及淫羊藿提取物中淫羊藿苷的吸收渗透系数均较小,且略小于单体,但无显著性差异,而分泌渗透系数与单体相比较均有显著性降低的趋势,整体外排比率下降了1倍左右。各样品中淫羊藿苷的双向转运量随时间的变化见图2。实验结果表明,各样品中淫羊藿苷双向转运量在4 h内都随着时间的增加而呈线性增长趋势。
表1 淫羊藿苷表观渗透系数测定结果(±s,n=3)Tab.1 The Pappof icariin(±s,n=3)
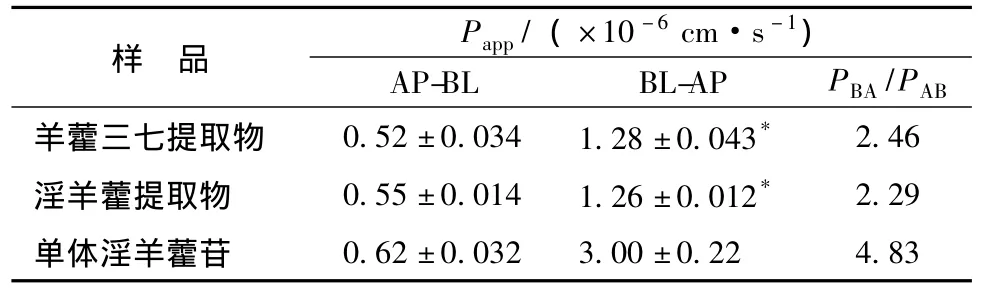
表1 淫羊藿苷表观渗透系数测定结果(±s,n=3)Tab.1 The Pappof icariin(±s,n=3)
注:与淫羊藿单体比较,*P<0.05。
样 品Papp/(×10-6cm·s-1)AP-BL BL-AP PBA/PAB羊藿三七提取物 0.52±0.034 1.28±0.043*2.46淫羊藿提取物 0.55±0.014 1.26±0.012* 2.29单体淫羊藿苷0.62±0.032 3.00±0.22 4.83

图2 淫羊藿苷1~4 h跨膜转运量Fig.2 Transport of icariin during 1-4 h
4 讨论
本研究采用Caco-2细胞模型,考察了羊藿三七提取物中主成分淫羊藿苷的肠吸收转运情况并与淫羊藿提取物及单体淫羊藿苷比较。课题组在前期研究中对单体淫羊藿苷的生物药剂学特性如溶解性、膜渗透性、稳定性、吸收代谢特性等进行了深入的研究[7-12],结果表明单体淫羊藿苷吸收较差,其机制除与其单纯的膜渗透性较差外,还可能存在着小肠上皮细胞中P-gp转运蛋白的外排作用。对淫羊藿苷生物药剂学特性的深入研究,有利于对以淫羊藿苷为主要活性成分的中药剂型的设计提供科学依据。
中药多以提取物或复方制剂应用,但对中药及复方提取物中活性成分或组分的生物药剂学特性的研究目前还比较薄弱,中药及复方提取物中活性成分由于与其它成分共存,其吸收代谢可能与单体化合物不同而更加复杂,因此不能以单体化合物的特性简单替代提取物中的情况。本研究的实验结果亦表明,羊藿三七提取物及淫羊藿提取物中所含淫羊藿苷的吸收渗透系数虽与淫羊藿苷单体相差较小,但分泌渗透系数却显著降低,外排比率降低了1倍左右,表明提取物中所含的其它成分可能对外排泵产生竞争抑制作用,抑制了淫羊藿苷的外排,从而有利于淫羊藿苷的吸收。由于羊藿三七提取物及淫羊藿提取物中淫羊藿苷的吸收渗透系数与分泌渗透系数相近,因此推测外排比率的下降主要与淫羊藿中所含的其它成分影响相关。然而,尽管淫羊藿中其他成分对淫羊藿苷具有促吸收作用,但与其它吸收较好的药物相比,其本身的理化性质仍然决定了其较差的胃肠道吸收特性。因此若以常规剂型制备以淫羊藿苷为主要成分的中药或复方制剂,有可能因为淫羊藿苷较差的肠道吸收导致其生物利用度较低,不利于其药理作用的发挥。因而在研制以淫羊藿为主药的中药制剂时,应采用能促进淫羊藿苷等成分吸收的新剂型 (如微丸、纳米制剂等)或添加促吸收的辅料 (如去氧胆酸钠、维生素E-聚乙二醇-琥珀酸酯等)进一步促进吸收,从而提高生物利用度,充分发挥其药理作用的目的。
对中药及复方提取物中活性成分、组分生物药剂学特性的深入了解,有利于将其设计成适宜的剂型,克服中药活性成分、组分生物药剂学特性的缺陷,提高其生物利用度,从而提高创新中药的研制水平。
[1]曾昭征,刘建平,李素春.复方配伍对三七总皂苷生物药剂学性质的影响[J].药学进展,2009,33(10):466-472.
[2]王胜春,赵惠萍,皇甫孟军.五味子与丹参配伍对其成分五味子乙素、醇甲的药代动力学影响[J].中成药,2004,26(12):987-991.
[3]国家中医药管理局.中华本草[M].上部.上海:上海科技出版社,1999:3821.
[4]陈 彦,贾晓斌,胡 明.Caco-2细胞单层研究淫羊藿黄酮类成分的吸收转运[J].中草药,2009,40(2):220-224.
[5]Hu M,Chen J,Zhu Y,et al.Mechanism and kinetics of transcellular transport of a new β-actam antibiotic loracarbef across an human intestinal epithelial model system(Caco-2)[J].Pharm Res,1994,11(10):1405-1413.
[6]Artursson P,Karlsson J.Correlation between oral drug absorptionin humans and apparent drug permeability coefficients in human intestinal epithelial(Caco-2)cells[J].Biochem Biophys Res Commun,1991,175(3):880-885.
[7]陈 彦,贾晓斌,胡 明,等.淫羊藿苷在Caco-2细胞单层模型中的吸收机制[J].中国中药杂志,2008,33(10):1164-1167.
[8]赵艳红,贾晓斌,陈 彦,等.淫羊藿苷大鼠在体肠吸收动力学的研究[J].中华中医药杂志,2007,22(10):681-684.
[9]王亚乐,贾晓斌,陈 彦,等.淫羊藿苷平衡溶解度和表观油水分配系数的测定[J].中华中医药杂志,2008,23(9):777-779.
[10]蔡 垠,贾晓斌,陈 彦,等.大鼠原味单向肠灌注模型研究淫羊藿苷肠吸收代谢特性[J].中国药学杂志,2009,44(13):985-988.
[11]陈 彦,贾晓斌,谭晓斌,等.大鼠肠道水解酶对淫羊藿黄酮苷的处置影响[J].中国药学杂志,2010,45(7):516-519.
[12]陈 彦,贾晓斌,谭晓斌,等.大鼠在体肠灌流模型研究淫羊藿不同黄酮苷的吸收代谢[J].中国中药杂志,2009,34(22):2928-2931.

