大鼠血浆中绿原酸和木犀草苷的HPLC法测定
沈 熊, 梁 健, 杨春欣, 吕迁洲
(复旦大学附属中山医院药剂科,上海200032)
咽炎合剂为本院自制制剂,临床应用已十余年,疗效确切,副作用小。本品由金银花、射干、山豆根、甘草、陈皮五味中药组成,具有清热解毒、消炎止痛,用于急、慢性咽炎及扁桃体炎等。金银花是咽炎合剂的主药,为忍冬科植物忍冬Lonicera japonica Thunb.的干燥花蕾或带初开的花[1]。金银花中含有机酸、黄酮类、挥发油、三萜类、苷类、微量元素等成分,其中活性成分是绿原酸(Chlorogenic acid)为代表的有机酸类以及木犀草苷 (Luteoloside)为代表的黄酮类成分[2-3]。二者的研发报道较多[4-6],而同时测定其在血浆中质量浓度则尚未见报道。LC-MS法用于分析生物样品,在灵敏度和特异性方面有很大优势,但该仪器昂贵,本实验建立了HPLC法,并优化色谱和血浆处理条件,以槲皮素 (Quercetin)为内标,测定大鼠灌胃后体内绿原酸和木犀草苷的质量浓度,并计算药动学参数,为咽炎合剂的进一步研发提供参考。
1 仪器与试药
Agilent 1200高效液相系统 (G1312A二元泵、G1329A自动进样器、G1314D可见紫外光检测器等),Agilent ChemStation B.04.02工作站。
绿原酸对照品 (10713-205213),木犀草苷对照品 (1112061200302)和内标槲皮素对照品(1113202101216)由中国食品药品检定研究院提供,甲醇为色谱纯,其余试剂均为分析纯,试验用水为二次蒸馏水。样品咽炎合剂 (批号20110403),本院自制。
SPF级SD大鼠,体质量155~175 g,由上海西普尔-必凯动物有限公司提供,动物许可证:SCXK(沪)2008-0016,实验前适应1周。
2 方法与结果
2.1 溶液配制 对照品贮备液:精密称取绿原酸对照品适量,加甲醇溶解,制得质量浓度为850 g/L的绿原酸对照品贮备液,同法制得质量浓度为1010 g/L的木犀草苷对照品贮备液。避光,4℃冰箱中保存,使用前用甲醇稀释至所需浓度。
内标溶液:精密称取槲皮素对照品适量,参照上述方法制得质量浓度为360 g/L的槲皮素内标贮备液。
2.2 色谱条件 Phenomenex Luna C18柱 (150 mm×4.6 mm,5.0 μm),流动相为0.4%醋酸溶液(A)-甲醇 (B),B泵的比例0~40 min从10%上升到80%,体积流量1.0 mL/min;检测波长350 nm;柱温30℃,进样量20 μL。
2.3 血浆样品预处理 精密吸取血浆样品200 μL,置10 mL具塞试管中,精密加入内标溶液10 μL,漩涡30 s,加入叔丁基甲醚2 mL,漩涡混合2 min,5000 r/min离心5 min,取上清液,50℃水浴中氮气吹干,以甲醇 -0.4%醋酸溶液(50∶50)200 μL溶解残渣,5000 r/min离心 5 min,取 100 μL 进样。
2.4 专属性试验 分别取混合对照品溶液、大鼠空白血浆、空白血浆加入绿原酸、木犀草苷和槲皮素,以及大鼠给药后30 min后的血样,进行测定,色谱图见图1。结果表明,绿原酸、木犀草苷和槲皮素与其它组分分离良好,血浆中内源性物质和代谢产物不干扰测定,结果见图1。
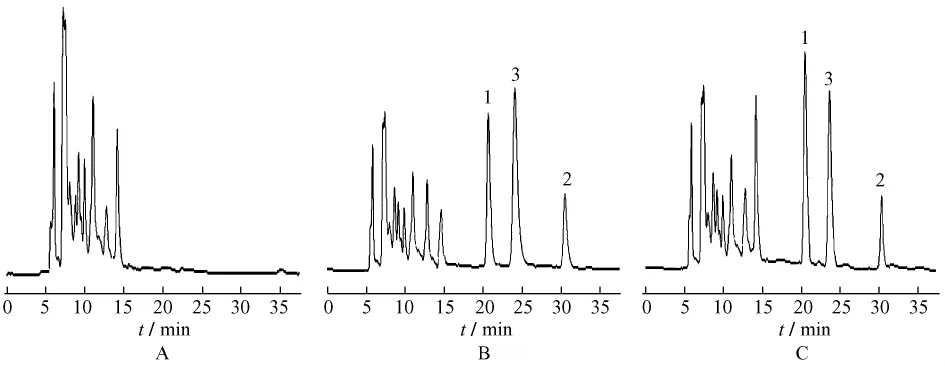
图1 绿原酸、木犀草苷和檞皮素的HPLC图谱Fig.1 HPLC chromatograms of chlorogenic acid in rat plasma
2.5 线性范围 取大鼠空白血浆200 μL,加入10、40、80、120、160、200 g/L系列质量浓度对照品绿原酸溶液10 μL,混匀;再分别加入2、10、20、30、40和50 g/L系列质量浓度对照品木犀草苷溶液10 μL,混匀,则血浆中绿原酸质量浓度分别为0.5、2、4、6、8和10 g/L,木犀草苷质量浓度分别为0.1、0.5、1、1.5、2和2.5 g/L,按2.3项下方法处理,进行测定,记录色谱图。分别以绿原酸、槲皮素峰面积之比 (R1)以及木犀草苷、槲皮素峰面积之比 (R2)为纵坐标,质量浓度C为横坐标,进行线性回归,得回归方程为R1=3.61C+0.128,r=0.999;R2=5.06C+0.296,r=0.999,表明血浆中绿原酸和木犀草苷分别在0.5~10 g/L和0.1~2.5 g/L范围内线性关系良好,绿原酸和木犀草苷的定量限分别为为0.5 g/L和0.1 g/L。
2.6 回收率试验 同上配制含绿原酸和木犀草苷高、中、低质量浓度的血样,各5份,按2.3项下方法处理,进行测定,记录绿原酸、木犀草苷和槲皮素的峰面积,将绿原酸、槲皮素以及木犀草苷、槲皮素比值分别代入各自回归方程,计算相对回收率,结果见表1。
2.7 精密度试验 同上配制含绿原酸和木犀草苷高、中、低质量浓度的血样,各5份,按2.3项下方法处理,于1 d内进行测定,记录绿原酸、木犀草苷和槲皮素的峰面积,将绿原酸、槲皮素以及木犀草苷、槲皮素比值分别代入各自回归方程,计算日内变异。上述各浓度样品连续测定5 d,同上计算日间变异。结果见表2。

表1 绿原酸和木犀草苷相对回收率试验结果Tab.1 Recovery rate of chlorogenic acid and luteoloside

表2 绿原酸和木犀草苷精密度试验结果Tab.2 Intra-day and inter-day precision of chlorogenic acid and luteoloside
2.8 药动学试验 大鼠6只,雌雄各半,实验前禁食12 h,自由饮水,按10 mL/kg剂量灌胃给药,给药后 5、15、30、60、120、240、360、480 min于眼底静脉丛采血,置1.5 mL肝素抗凝离心管,4000 r/min离心10 min,分离出血浆,-80℃冷冻保存待测。
按2.3项下方法处理血浆,测定绿原酸和木犀草苷在大鼠体内的平均血药浓度,药—时曲线见图2,用WinNonlin(Ver 4.1,Pharsight,USA)软件处理,绿原酸和木犀草苷呈非房室模型,采用非房室模型 (统计矩)计算结果,主要药动学参数见表3。

图2 绿原酸和木犀草苷的药—时曲线Fig.2 Mean drug plasma concentration-time profiles of chlorogenic acid and luteoloside

表3 主要药动学参数Tab.3 Main pharmacokinetic data
3 讨论
绿原酸为金银花活性成分,常用作药材和制剂的质量控制指标。木犀草苷是金银花区别山银花的特征成分,具有较强的抗呼吸道合胞体病毒活性,是其抗菌抗病毒的有效成分之一。因此,在金银花药材提取工艺、制剂质量标准、以及药效监测研究中,不能仅以单一成分为指标进行评价,应结合药理研究,选择合理的指标,以保证方法的可行性和药效。
在色谱条件的选择上,参考绿原酸和木犀草苷的最大吸收波长分别为330 nm[7-8]和350 nm文献[4,6],也有文献采用 350 nm 检测绿原酸等成分[9],实验中比较两种波长测定绿原酸,发现积峰面积相差不超过5%,采用350 nm测定绿原酸,可以达到本次实验的要求,因此设置统一波长测定绿原酸和木犀草苷,使实验更加简便易行。合剂作为中药制剂的典型,其成分十分复杂,给测定带来一定困难,在测定前,必须对样品进行分离纯化处理[10]。经参考文献[11-12]及根据实际操作结果不断改进,最终确定了HPLC法测定绿原酸和木犀草苷的含量的方法。
从药—时曲线和药动学参数上看,绿原酸和木犀草苷在体内的浓度差别很大,但变化趋势相似,吸收快速,两者均呈现非房室模型。
[1]国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010:205.
[2]黄喜茹,刘伟娜,曹 冬.金银花的化学成分药理作用研究评价[J].中医药学刊,2005,23(3):418-419.
[3]宋 健,张会敏,郭承军,等.金银花抗流感病毒活性成分峰的化合物归属研究[J].中成药,2011,33(6):1017-1021.
[4]闵春艳,游本刚,许琼明,等.正交试验比较金银花药材中绿原酸与木犀草苷的乙醇提取工艺[J].中成药,2011,33(10):1815-1818.
[5]赵琰玲,尹 莲.金银花化学成分与有效成分提取研究进展[J].医药导报,2007,26(5):521-522.
[6]郭 玉,郑 兴,曹 轩,等.RP-HPLC测定金银花叶中木犀草苷的含量[J].中成药,2009,31(8):1299-1300.
[7]孙艳涛,王 冰,李 莉.梯度洗脱法同时测定不同配比金银花连翘药对中绿原酸、连翘脂素[J].中成药,2011,33(5):821-823.
[8]梁少强,谢仕伟,李国荣,等.治感灵颗粒质量标准的研究[J].中成药,2010,32(6):1078-1080.
[9]施 法,侯 峰.金银花中3种成分含量的超高速液相色谱法同时测定[J].时珍国医国药,2010,21(11):3014-3015.
[10]刘德军.对《中国药典》2010版一部同名不同剂型中药制剂质量控制的探讨[J].中成药,2010,32(12):2151-2153.
[11]陈泽宾,姚 芳,雷雪儿,等.液相串联质谱联用法研究金银花黄酮提取物在大鼠体内的药动学[J].中国医院药学杂志,2010,30(09):743-746.
[12]于天杰,张玲昂.咽炎合剂的质量控制[J].中国实用医药,2009,4(26):151-152.

