鲟鱼硫酸软骨素的免疫调节及抗炎抗过敏活性
黄世玉,李江森,关瑞章,黄文树
(1.集美大学 水产学院,福建 厦门 361021;2.福建省高校水产科学与食品安全重点实验室,福建 厦门361021)
硫酸软骨素(Chondroitin sulfate,ChS)是存在于动物软骨组织中的一类具有多种异构体的酸性黏多糖,具有抗炎[1]、抗血栓[2]、抑制肿瘤细胞增殖和免疫调节等作用[3-5]。
ChS的主要来源是家禽、家畜和鲨鱼等动物软骨,但家禽、家畜的软骨含量低,鲨鱼是国家野生保护动物,资源相对缺乏。目前,中国的鲟鱼养殖业发展良好,且鲟鱼的软骨含量相当高(提取率为31.56%[6]),鲟鱼 ChS 的提取工艺较为成熟[6]。前期的研究表明,鲟鱼ChS的化学结构不同于家禽、家畜以及鲨鱼等的ChS[7-8]。有关鲟鱼中ChS生物活性未见报道,本文研究其免疫调节及抗炎抗过敏等作用,为鲟鱼ChS的开发利用提供参考。
1 材料
鲟鱼(史氏鲟,Acipenser schrenki Brandt),属于鲟形目、鲟科、鲟属,购自福建省厦门市同安某鲟鱼养殖场。
鸡红细胞(chicken red blood cells,CRBC)由市售鸡无菌取血,以阿氏液抗凝离心沉淀后配成10%和5%的CRBC混悬液,保存于4℃冰箱,在2周内使用。
鲨鱼ChS对照品购自Sigma公司。
清洁级KM小鼠,雌雄各半,体重(20±2)g,购自中国医学科学院医学实验动物研究所繁育中心,合格证号:SCXK(京)2005-0013。并于集美大学水产学院SPF实验动物中心饲养,SYXK(闽)2007-001。
2 方法
2.1 鲟鱼ChS的提取
参考徐传屯等[6]的方法提取鲟鱼ChS粗品,综合利用乙醇和色谱法对粗品进行纯化,纯度通过咔唑法测定。根据产品中葡萄糖醛酸含量换算得到的鲟鱼ChS纯度为96.18%。
2.2 分组及给药方法
小鼠随机分成鲟鱼ChS高、中、低剂量组、鲨鱼ChS组和对照组等5组,每组10只。给药剂量参考ChS成人用药量[9-10],高、中、低剂量组分别为 600,60和6 mg/kg;鲨鱼ChS组采用鲨鱼ChS对照品60 mg/kg;对照组给生理盐水;灌胃给药,0.5 mL/次,1次/d。
2.3 鲟鱼ChS对免疫器官重量指数的测量
连续灌胃14 d,在最后一次灌胃的24 h后,称重,脱颈椎处死小鼠,剖取胸腺和脾脏并称重。
2.4 鲟鱼ChS对外周血白细胞分析
连续灌胃14 d,在最后一次灌胃的24 h后,眼球采血0.1 mL,以EDTA抗凝送往厦门第二医院血液检查科检验。
2.5 鲟鱼ChS对迟发型变态反应
在连续灌胃7 d后,每鼠腹腔注射10%CRBC混悬液200 μL致敏,于第14天灌胃后24 h,每只小鼠右后足垫注射10%CRBC混悬液 20 μL,用游标卡尺测量注射前、注射后1及24 h右足垫的厚度,计算其肿胀度。
2.6 鲟鱼ChS对体液免疫功能-血清溶血素含量的测定(CRBC免疫法)
在连续灌胃7 d后,每鼠腹腔注射10%CRCB混悬液200 μL进行免疫。饲养7 d后从小鼠眼眶取血并分离出血清测定溶血素含量。每只小鼠取血清10 μL,用生理盐水稀释100倍。取稀释血清1 mL 与5%CRBC 混悬液 0.5 mL、10%补体 0.5 mL混合,在37℃下保温30 min,冰水浴上终止反应。离心取上清液,测定在540 nm波长处的吸光度值,以不加血清的空白作对照。以吸光度值作为判断血清溶血素的指标。
2.7 鲟鱼ChS对二甲苯诱发小鼠耳过敏性肿胀的测定
连续灌胃14 d,末次灌胃后24 h在小鼠的右耳正反两面涂抹二甲苯20 μL致炎,左耳不做处理,4 h后颈椎脱臼处死小鼠,剪下双耳,用9 mm的打孔器分别在左、右耳同一部位打下圆耳片,称重。用左、右耳片重量差值作为肿胀度。
2.8 鲟鱼ChS对蛋清致足垫炎的测定
连续灌胃14 d,末次灌胃后24 h每鼠右后足垫注射10%蛋清溶液20 μL,用游标卡尺测量注射前及注射后30 min及4 h右足垫的厚度,计算肿胀度。
3 结果
3.1 鲟鱼ChS对免疫器官重量指数的影响
结果见表1。鲟鱼ChS三个剂量组和鲨鱼ChS组的小鼠脾指数均显著高于对照组(P<0.01),但鲟鱼ChS三个剂量组间及其与鲨鱼ChS组间没有显著性差异(P>0.05)。对于胸腺指数,只有鲟鱼ChS 600 mg/kg剂量组显著高于对照组(P<0.05),其他各组间没有显著差异(P>0.05)。
3.2 鲟鱼ChS对外周血白细胞数量的影响
结果见表1。鲟鱼ChS三个剂量组和鲨鱼ChS组的外周血中的白细胞数量均显著高于对照组(P<0.05),白细胞中的淋巴细胞数量显著增加(P<0.01),此外,与鲨鱼 ChS组相比,鲟鱼 ChS 60和600 mg/kg剂量组的白细胞数量均显著增高(P<0.01),主要也是由于淋巴细胞数量显著增加(P<0.01)。且在60和600 mg/kg剂量时除淋巴细胞数增加外,中性细胞数也显著性增加(P<0.05)。
3.3 鲟鱼ChS对迟发型变态反应的影响
结果见表2和图1。与对照组和鲨鱼ChS组相比,鲟鱼ChS 60和600 mg/kg剂量组,在注射CRBC后1 h小鼠右后足垫的肿胀度显著提高(P<0.01),鲨鱼 ChS组显著提高(P <0.05);在注射24 h后对照组和实验组对比注射前均出现显著性肿胀(P <0.05),且肿胀度明显高于对照组(P <0.05),以60和600 mg/kg剂量最为显著(P<0.01)。表明鲟鱼ChS对迟发型变态反应具有促进作用。
3.4 鲟鱼ChS对血清溶血素的影响
结果见表2。连续灌胃鲟鱼ChS能显著升高血清溶血素的吸光度值,且随剂量增加呈上升趋势。鲟鱼ChS使血清溶血素升高说明其能促进CRBC抗体产生,并与体液免疫功能调节有关。

表1 鲟鱼ChS对小鼠免疫器官重量指数及外周血白细胞数量的影响(n=10,x±s)Tab.1 The effects of sturgeon chondroitin sulfate on the weight of immune organs and the amount of the perivascular leukocytes in mice(n=10,x±s)

表2 鲟鱼ChS对迟发型变态反应小鼠足垫肿胀度及血清溶血素的影响(n=10,x±s)Tab.2 The effects of sturgeon chondroitin sulfate on delayed-type hypersensitivity response,hemolysin and agglutinin(n=10,x±s)

图1 鲟鱼ChS对迟发型变态反应小鼠足垫肿胀度的影响Fig.1 The effects of sturgeon chondroitin sulfate on degree of swelling of ear induced by dimethylbenzene
3.5 鲟鱼ChS对二甲苯诱发小鼠耳肿胀的影响
结果见表3。雄性小鼠对二甲苯致鼠耳肿胀度显著高于雌性。同时鲟鱼ChS能明显降低雄性小鼠对二甲苯致鼠耳肿胀度,在600 mg/kg剂量最为显著。但6和60 mg/kg剂量对雌性小鼠因二甲苯致鼠耳肿胀度无降低作用,而在600 mg/kg剂量能显著降低雌性小鼠对二甲苯致鼠耳肿胀度。表明鲟鱼ChS能显著降低二甲苯致鼠耳肿胀度。
3.6 鲟鱼ChS对蛋清致足垫炎的影响
结果见表3。鲟鱼ChS 60和600 mg/kg剂量能显著降低因蛋清致炎引起足垫肿胀度,但鲟鱼ChS 6 mg/kg剂量组的足垫肿胀度与对照组差异不显著。表明ChS对蛋清致足垫炎肿胀度有抑制作用,并与其给药剂量有关。
4 讨论
本研究证明,鲟鱼ChS能提高小鼠胸腺和脾脏的器官指数,具有明显增重作用;同时使小鼠外周血白细胞数量特别是淋巴细胞数显著性增多并有一定的剂量浓度依赖关系。本实验中得出的鲟鱼ChS和鲨鱼ChS对照品对小鼠胸腺和脾脏器官指数影响结果与戴小慧等[5]研究结果一致。
本研究证明,鲟鱼ChS能明显增加小鼠足垫肿胀度提高迟发超敏反应能力,并提升CRBC血清溶血素水平,提示鲟鱼ChS能促进T淋巴细胞的活化,增强细胞免疫功能;且对机体特异性免疫功能有促进作用。推测鲟鱼ChS对小鼠免疫功能的促进作用可能与免疫细胞增殖转化和功能状态以及一些免疫因子(如抗体、细胞因子等)水平的变化有关。其作用机制有待进一步研究。
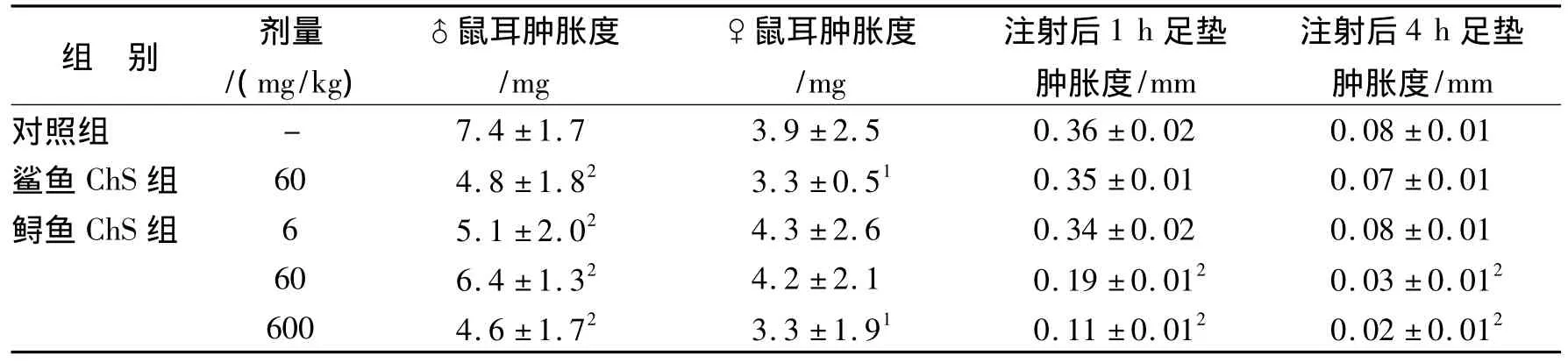
表3 鲟鱼ChS对小鼠耳过敏性肿胀度及蛋清致足垫炎肿胀度的影响(n=10,x±s)Tab.3 The effects of sturgeon chondroitin sulfate on degree of swelling of ear induced by dimethylbenzene and the swelling of foot pad induced by egg albumen(n=10,x±s)
本研究证明,鲟鱼ChS能显著降低因二甲苯致敏引发的鼠耳肿胀度及对蛋清致足垫炎肿胀度有抑制作用,表明鲟鱼ChS具有抗炎抗过敏活性。
同时鲟鱼ChS实验结果与鲨鱼ChS对照品的实验结果存在相同与差异,如二者对小鼠免疫器官重量指数及外周血白细胞数量影响差异不显著(P>0.05);而对抑制蛋清致足垫炎肿胀度差异显著(P<0.05),在提高迟发超敏反应强度存在着剂量差别。郑江等[7-8]对这两种ChS进行了研究并报道其红外光谱总体基本相似,都含有乙酰氨基、羧基、硫酸基、糖环等官能团的振动峰,但鲟鱼ChS的重均、数均和Z均分子质量、比旋光度、硫酸基团含量与鲨鱼ChS存在显著差异。这表明,与鲨鱼ChS相比,鲟鱼ChS可能具有更好的抗炎活性和增强细胞免疫功能的作用。
近年来,鲟鱼养殖规模不断扩大,分离纯化鲟鱼ChS工艺日益成熟,成本逐渐降低,为鲟鱼ChS的研究开发提供了前提条件。本文研究结果为鲟鱼ChS药用功能提供了实验依据。
[1]陈 磊,凌沛学,贺艳丽.硫酸软骨素和玻璃酸钠联合应用治疗木瓜酶致兔膝骨关节炎[J].中国生化药物杂志,2009,30(1):33-35.
[2]Tapon-Bretaudiere J,Drouet B,Matou S,et al.Modulation of vascular human endothelial and rat smooth muscle cel1 growth by a fucosylated chondroitin sulfate from echinoderml[J].Thromb Haemost,2000,84(2):332-337.
[3]刘克为,迟·依荷巴丽,吕 静.鲨鱼软骨素联合化疗治疗晚期非小细胞肺癌疗效观察[J].中国肿瘤临床与康复,2009,16(2):167-169.
[4]徐永建,刘歆农,刘庆宏,等.鲨鱼软骨素对肿瘤患者T淋巴细胞亚群的影响[J].中国实验血液学杂志,2001,9(1):91-96.
[5]戴小慧,章建芳,陈 龙.硫酸软骨素免疫增强作用研究[J].中国药业,2006,15(16):16-18.
[6]徐传屯,关瑞章,郑 江,等.养殖鲟鱼软骨中硫酸软骨素的优化提取工艺研究[J].中国生化药物杂志,2009,30(3):154-157.
[7]郑 江,关瑞章,黄世玉.鲟鱼和鲨鱼硫酸软骨素红外光谱特性的比较研究[J].光谱学与光谱分析,2008,28(1):106-109.
[8]郑 江,关瑞章,黄文树,等.鲟鱼硫酸软骨素的纯化及其特性[J].水产学报,2008,32(3):478-482.
[9]陈成章.免疫毒理学[M].郑州:郑州大学出版社,2008:430-446.
[10]田惠光,张 兵.保健食品实用指南[M].北京:化学工业出版社,2002:18-27.

