微小RNA-200a在肝癌中的表达及其功能
郑莉莉,李 佳,房 林
(同济大学附属第十人民医院甲乳外科,上海 200072)
原发性肝癌在世界范围内是第五位最常见和第三位致死率最高的恶性肿瘤。我国是原发性肝癌的高发区,占全球肝癌病例的55%。因此,对原发性肝癌发生发展分子机制进行探讨、研究具有十分重要的意义。近10年来,大量研究表明microRNAs参与了肿瘤的形成和演进[1-4]。在肝癌中,研究者发现肝癌组织中microRNAs表达与配对正常组织明显差异。目前尚不知miR-200a在肝癌中表达情况及其功能,因此本研究运用荧光定量PCR检测miR-200a在肝癌细胞HepG2和正常肝细胞QSG-7701中表达水平,后行功能试验探索其对于HepG2细胞增殖、周期、凋亡和侵袭能力的影响。
1 材料与方法
1.1 一般资料
人肝癌细胞HepG2和正常肝QSG-7701细胞株购于中国科学院。
1.2 miRNAs提取和逆转录
按照TIANGEN公司miRcute microRNA提取分离试剂盒说明书进行操作。microRNAs逆转录参照Chen等[10]的方法,通过特异茎环引物,按照下列顺序在PCR试管中加入反应物(体积为8.6 μl):超纯水 2 μl,5 × buffer 1.7 μl,microRNAs 茎环引物(各个 microRNAs 及内参 U6)1.9 μl,逆转录酶(Primescript RT Enzyme MixI)1 μl,microRNAs sample 2 μl。反应条件为:16、42、85、4 ℃ 10 min,反应结束后置于4℃冰箱保存。
1.3 实时定量RT-PCR
按照Takara公司SYBR Premix Ex Taq(Perfect Real Time)DRR041A说明书完成加样,反应条件为95℃预变性2 min;变性95℃ 30 s,退火、延伸60℃45 s,重复35个循环,70℃ ~95℃绘制融解曲线。反应结束后,RQ manager分析软件统计处理,获取Ct值,并根据熔解曲线判断产物的纯度。
1.4 细胞增殖检测
HepG2细胞计数后,用含10%FBS的DMEM培养基以按25×104个细胞/孔接种于6孔板上。待六孔板细胞密度长到约80% ~90%时,按照TIANGEN公司脂质体说明书,以1 μg miR-200a mimics:3 μl脂质体比例完成miR-200a转染,并使miR-200a终浓度分别达到 50、100、150 nmol/L,空对照组为脂质体处理组,负对照组为小分子RNA片段转染组,均不加miR-200a mimics。5~6 h后,细胞消化重悬计数,以1 000细胞/孔分别接种入96孔板。按24、48、72 h三个细胞培养时间段进行如下操作;每孔加入20 μl MTT溶液(5 mg/L),继续培养4 h。吸取上清弃掉,每孔加入150 μl DMSO(二甲基亚砜),置摇床上低速震荡10 min,使结晶物充分溶解。在酶联免疫检测仪测量490 nm处各孔的吸光值。
1.5 细胞周期与凋亡检测
miR-200a mimics转染同 MTT试验,使 miR-200a终浓度达到100 nmol/L。转染24 h后细胞消化重悬离心,4℃,3 200 r/min,10 min;PBS洗涤2次;加入预冷70%乙醇,4℃固定过夜;RNase(终浓度为0.1 g/L)消化30 min;细胞染色:加入0.05 g/L 碘化丙锭(PI)250 μl,室温避光染色 30 min,流式细胞仪检测。按照以下公式计算细胞增殖指数(PI),以衡量细胞的分裂活动:PI=(S+G2/M)/(G0/G1+S+G2/M)。细胞凋亡实验,配置标记液:Buffer以ddH2O四倍稀释;Annexin V液:50 μl Buffer+2.5 μl Annexin V;PI 液:250 μl Buffer+5 μl PI;标记:每 105细胞加入 52.5 μl Annexin V液,混匀,避光反应15~20 min;加入255 μl PI液,避光反应3~5 min;混匀上机检测,统计结果。
1.6 Transwell实验
①1%BSA配制;②细胞六孔板铺板及miR-200a mimics转染同MTT试验;③包被基底膜:用50 mg/L Matrigel 1∶8稀释液包被Transwell小室底部膜的上室面,4℃风干;水化基底膜:吸出培养板中残余液体,每孔加入50 μl含10 g/L BSA的无血清培养液,37℃,30 min;④转染后48 h,在24孔板中,每孔加入500 μl含有10%FBS的DMEM 培养基;将转染后细胞消化,PBS清洗后用含有0.1%BSA的不含血清的DMEM培养基重悬。重悬细胞计数后,按照8×104个细胞/小室接种于transwell上室中,最终保持上室内100 μl培养基。在5%CO2、37℃培养箱中培养48 h;⑤Transwell小室染色:取出小室,吸取小室中培养液,然后用棉签将上室内部擦干净;将小室膜的下表面用PBS浸泡清洗,然后用95%乙醇固定10 min,然后风干;用0.1%结晶紫染色10 min,自来水冲洗3次;风干后拍照;拍照后用300 μl 33%冰醋酸溶解膜上的结晶紫,酶标仪测定573 nm处吸光值。
1.7 统计学方法
实时荧光定量检测,结果分析根据Kenneth[11]的描述,采用半定量分析。本实验用两独立样本t检验检测miR-200a在肝癌细胞HepG2和正常肝QSG-7701细胞中的表达水平,P<0.05认为有统计学意义。细胞功能试验所有标本均重复检测三次,去除异常值后取平均值行t检验统计数据分析HepG2细胞株转染组及对照组之间的差异。
2 结 果
2.1 Real-time PCR 结果
Real-time PCR结果显示肝癌细胞HepG2中miR-200a相对表达水平为正常肝细胞的4.79倍,miR-200a的表达水平在癌细胞相较于正常细胞明显高表达(P<0.01)。
2.2 MTT试验结果分析
分别以50、100和150 nmol/L浓度的miR-200a mimics作用于肝癌细胞株HepG2 24、48和72 h后,测定各组490 nm处吸光值,并计算促进率。促进率计算公式如下:促进率(%)=(对照组吸光值-实验组吸光值)/对照组吸光值×100%。与对照组比较,miR-200a促进作用一定程度上呈剂量及时间依赖性。当作用时间为72 h、浓度为150 nmol/L时,对该株细胞的增殖促进最强,促进率为38.4%(表1)。

表1 miR-200a mimics转染肝癌细胞株后对细胞增殖的影响Tab.1 The effect of miR-200a on the proliferation of liver cancer HepG2 cells
2.3 细胞周期、凋亡检测
用100 nmol/L miR-200a mimics转染HepG2细胞株24 h后,流式细胞仪分析显示G0/G1期细胞数量无显著增多,G2/M期细胞数量无明显变化,S期细胞数量未见明显减少,细胞增殖指数无明显降低(表2)。Annexin V-FITC/PI双染流式细胞计数定量分析结果显示,miR-200a在肝癌细胞株中的表达升高不能明显诱导其发生早期凋亡(0.5±0.06)%,与空对照组(0.3 ±0.04)%,负对照组(0.48±0.02)% 比较差异无统计学意义(P>0.05)n=3(图1)。
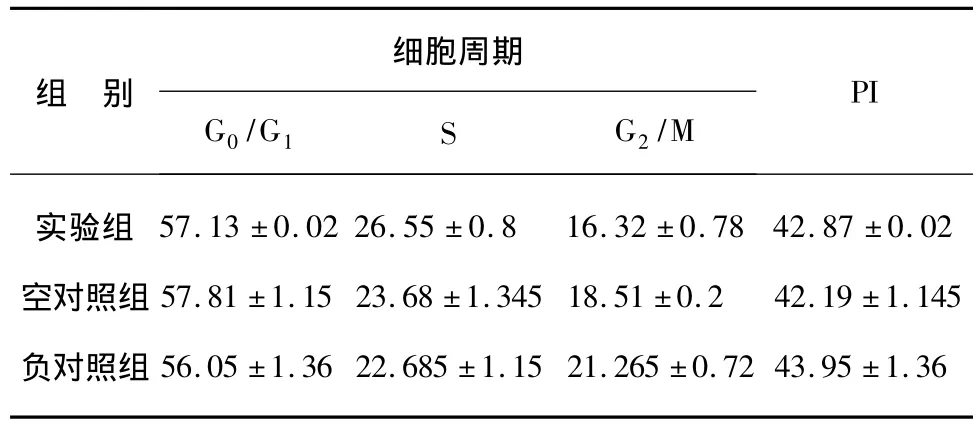
表2 miR-200a mimics转染肝癌细胞株后对细胞周期的影响Tab.2 The effect of miR-200a on the cell cycle changes of liver cancer HepG2 cells
2.4 Transwell试验
酶标仪测定573 nm处吸光值显示100 nmol/L miR-200a mimics实验组相对穿出小室膜肿瘤细胞数为 0.348 ±0.005 657,与空对照组 0.296 ±0.006 364,负对照组0.287 ±0.005 364 差异有显著性(P<0.05),表明miR-200a能够明显促进肿瘤细胞侵袭。
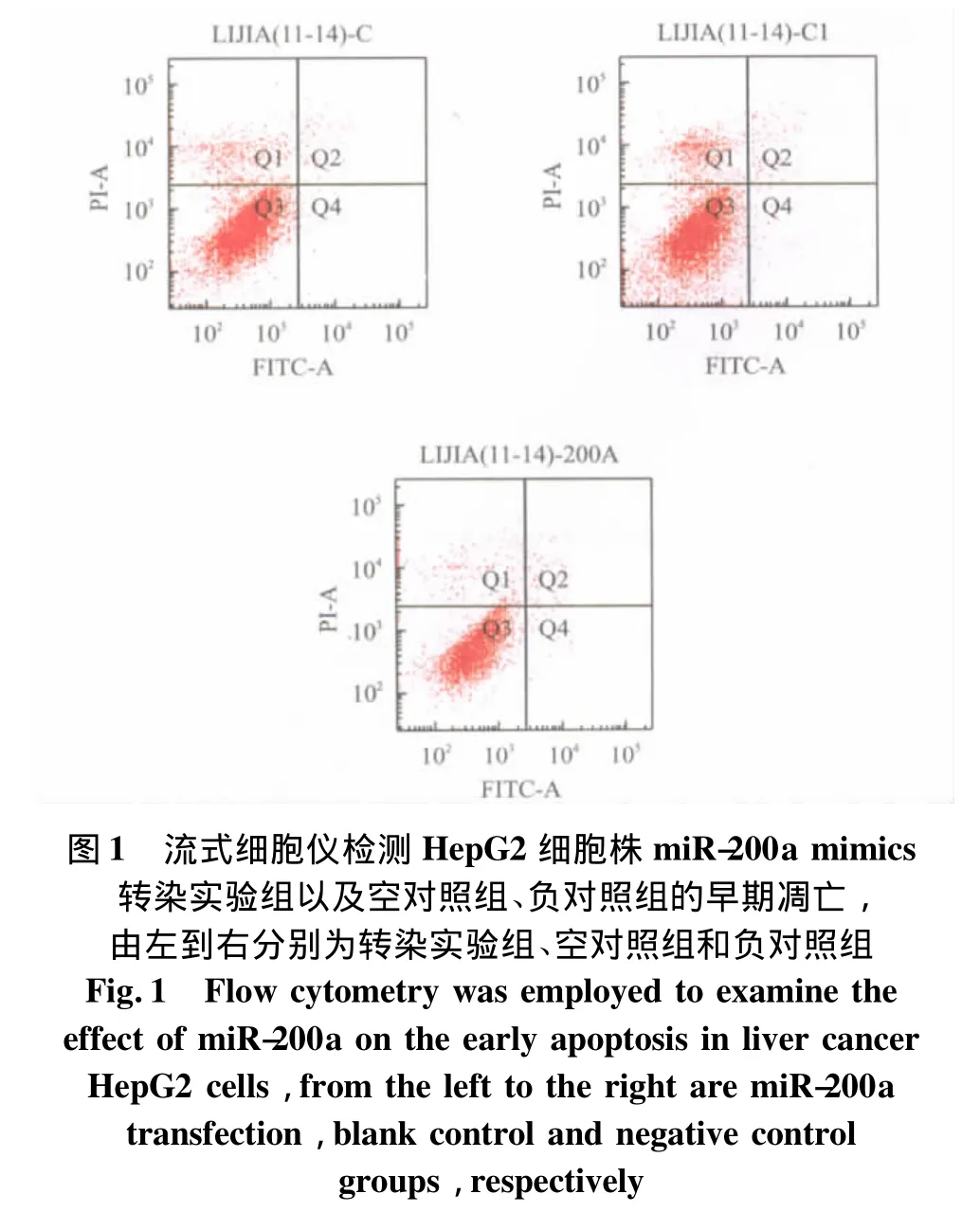
3 讨 论
microRNAs作为非编码性小分子 RNA通过mRNA降解和翻译抑制参与了肝癌细胞的增殖[5]、凋亡[6]、侵袭转移[7],肿瘤干细胞的恶性转化[8]。越来越多的研究表明血液中microRNAs表达谱可以作为早期诊断肝癌的指标[9-10]。本次研究发现miR-200a在肝癌细胞HepG2中表达明显高于正常肝细胞,Li等发现miR-200a在胰腺癌组织及其血液标本中高表达[11],而在乳腺癌标本中,miR-200a表达水平却明显下调[12],这些发现提示 miR-200a在肿瘤组织中的表达具有组织特异性,未来可用于协助早期诊断肝癌。
MiR-200a在肝癌细胞HepG2中的表达水平明显上调,相比较负对照组和空对照组,上调miR-200a表达能够明显促进肝癌细胞增殖和侵袭。Li,YX等使用反义核苷酸链下调miR-200a表达,发现脐静脉内皮细胞的增殖和侵袭能力明显下降[13],而Xia等研究发现 miR-200a通过作用于 ZEB2和CTNNB1抑制鼻咽癌细胞C666-1和CNE-1的增殖和侵袭[14],提示miR-200a在不同的肿瘤类型中功能不同,其在肝癌中扮演着原癌基因的角色。
传统的恶性肿瘤的治疗策略,包括外科手术、放疗和化疗三种手段。近年来,又出现了肝癌特异性抗原的肿瘤免疫治疗,刘扬等的研究发现AFP特异性的CD4+T和CD8+细胞在体外对人肝癌HepG2细胞有显著杀伤活性,有望成为肝癌免疫治疗新方法[15]。杨丽娟等[16]研究抗肿瘤抗生素光辉霉素MIT,MIT对肝癌Huh-7细胞有明显的诱导凋亡和生长抑制作用,为探索肝癌治疗的新方法提供可靠的理论依据。MicroRNAs介导的肿瘤分子治疗将是根治肿瘤的重要发展方向。未来可将抗miR-200a的寡核苷酸转染入肿瘤细胞,寡核苷酸包含可与致癌性microRNA互补结合的序列,竞争性抑制后者功能,从而达到消除肿瘤细胞的目的。也可将miR-200a海绵转染入肿瘤细胞,“吸附”大量oncomicroRNA,从而避免其对天然 RNA的抑制。OncomiR-9在乳腺癌表达上调,参与肿瘤转移,miR-9海绵有效终止了肿瘤细胞的侵袭[17],为克服肿瘤提供了新的方向。
[1]Sonia AM,Manel E.Dysregulation of microRNAs in cancer:Playing with fire[J].FEBS Lett,2010,585(13):2087-2099.
[2]Babashah S,Soleimani M.The oncogenic and tumour suppressive roles of microRNAs in cancer and apoptosis[J].Eur J Cancer,2011,47(8):1127 -1137.
[3]Aigner A.MicroRNAs(miRNAs)in cancer invasion and metastasis:therapeutic approaches based on metastasis-related miRNAs[J].J Mol Med(Berl),2011,89(5):445 -457.
[4]Dillhoff M,Wojcik SE,Bloomston M.MicroRNAs in solid tumors[J]. J SurgRes,2009,154(2):349-354.
[5]Furuta M,Kozaki KI,Tanaka S,et al.miR-124 and miR-203 are epigenetically silenced tumor-suppressive microRNAs in hepatocellular carcinoma [J].Carcinogenesis,2010,31(5):766 -776.
[6]Shimizu S,Takehara T,Hikita H,et al.The let-7 family of microRNAs inhibits Bcl-xL expression and potentiates sorafenib-induced apoptosis in human hepatocellular carcinoma[J].J Hepatol,2011,52(5):698-704.
[7]Budhu A,Jia HL,Forgues M,et al.Identification of metastasis-related microRNAs in hepatocellular carcinoma[J].Hepatology,2008,47(3):897 - 907.
[8]Li R,Qian NS,Tao KS,et al.MicroRNAs involved in neoplastic transformation of liver cancer stem cells[J].J Exp Clin Cancer Res,2010,29:169.
[9]Xu JA,Wu,C,Che X,et al.Circulating microRNAs,miR-21,miR-122, and miR-223, in patients with hepatocellular carcinoma or chronic hepatitis[J].Mol carcinog,2011,50(2):136 -142.
[10]Qu KZ,Zhang K, LiHR,etal. Circulating microRNAs as biomarkers for hepatocellular carcinoma[J].J Clin Gastroenterol,2011,45(4):355 - 360.
[11]Li A,Omura N,Hong SM,et al.Pancreatic cancers epigenetically silence SIP1 and hypomethylate and overexpress miR-200a/200b in association with elevated circulating miR-200a and miR-200b levels[J].Cancer Res,2011,70(13):5226 -5237.
[12]Eades G,Yao Y,Yang MH,et al.miR-200a regulates SIRT1 expression and epithelialto mesenchymal transition(EMT)-liketransformationinmammary epithelial cells[J].J Biol Chem,2011,286(29):25992-26002.
[13]Li YX,Liu DQ,Zheng C,et al.miR-200a modulate HUVECs viability and migration[J].IUBMB Life.2011,63(7):553 -559.
[14]Xia HP,Ng SS,Jiang SS,et al.miR-200a-mediated downregulation of ZEB2 and CTNNB1 differentially inhibits nasopharyngeal carcinoma cell growth,migration and invasion[J].Biochem Biophys Res Commun,2010,391(1):535 -541.
[15]刘扬,宋振顺,周波,等.AFP特异性CD8+T/CD4+T肝癌疫苗体外杀伤肝癌细胞的实验研究[J].同济大学学报:医学版,2011,32(1):18 -23.
[16]杨丽娟,李宁,周翡,等.Mithramycin A对肝癌细胞Huh-7增殖的影响[J].同济大学学报:医学版,2009,30(5):32 -39.
[17]Ma L,Young J,Prabhala H,et al.miR-9,a MYC/MYCN-activated microRNA,regulates E-cadherin and cancer metastasis,Nat[J].Cell Biol,2010,12(3):209-211.

