靶向VEGF的shRNA对皮肤鳞癌A431细胞的作用
曹一鑫,冯 新,王建力,陈 莉
(1.南通大学附属医院皮肤科,江苏南通226001;2.海门市皮肤病防治医院;3.南通大学医学院病理学系,江苏南通 226001)
随着现代分子生物学的发展,从基因水平上探索防治皮肤鳞癌的新途径已日益成为国内外研究的热点,其中RNA干扰(RNA interference,RNAi)技术是目前最有希望攻克肿瘤的方法之一[1-2],将为皮肤鳞癌未来的临床治疗开辟一个新的领域。本研究拟通过RNAi技术沉默人皮肤鳞癌细胞系(A431细胞)中VEGF基因,观察癌细胞增殖、迁移和黏附的改变,为进一步开发以VEGF基因为靶点的皮肤鳞癌基因治疗提供实验依据。
1 材料与方法
1.1 材料
人皮肤鳞癌细胞(A431)由西安第四军医大学附属西京医院高天文教授惠赠。PCR Maker(Tiangen公司);脂质体(Invitrogen公司),DMEM培养基及胎牛血清(Gibco公司),PCR试剂盒、DNA连接试剂盒、分子质量标记和限制性内切酶(宝生物工程有限公司)。EILSA试剂盒、FN、鼠抗VEGF单克隆抗体和羊抗鼠IgG抗体(Santa Cruz公司),CCK-8(日本同仁公司),Transwell小室(Coastar公司)。
1.2 方法
1.2.1 质粒构建:利用Qiagen siRNA设计软件,根据基因库中的VEGF序列设计2个靶位点的VEGF shRNA序列(55 nt的寡核苷酸)[3]。通过真核表达载体pSilencer4.1-CMVneo构建靶向VEGF基因的shRNA表达载体(psilencer-VEGF-shRNA,VEGF-s1和VEGF-s2)。同法构建与人类任何基因序列均无同源关系的随机靶序列作为阴性对照表达质粒(Target-off-shRNA,T-off),设计质粒序列见表1。
1.2.2 实验方法:取对数生长期细胞接种于100 mL培养瓶中,待细胞生长至90% ~95%汇合时,参照试剂盒说明书进行细胞转染。设未转染的A431细胞为对照组(N)。1)实时荧光定量反转录-聚合酶链反应(real-time qutant RT-PCR,RT-QPCR)检测A431细胞中VEGF mRNA的表达,VEGF引物序列:上游:5'-ATGCGGATCAAACCTCACCA-3',下游:5'-TTACACGTCTGCGGATCTTG-3',内参GAPDH引物序列:5'-CGAAGTCAACGGTGGTCGTAT-3',下游:5'-AGCCTTCTCGGT GGTGAAGAC-3',反应条件:95℃7 min,95 ℃ 变性20 s,55 ℃ 退火30 s,72 ℃ 延伸30 s,45个循环,最后72℃延伸7 min。2)ELISA检测A431细胞中VEGF分泌蛋白的表达。3)Western blot检测A431细胞中VEGF蛋白的表达。选择450 nm波长,在酶标仪上测定各孔吸光度(A)值。4)流式细胞仪检测细胞周期,细胞增殖指数(Proliferation Index,PI)=(S+G2/M)/(G0/G1+S+G2/M)。5)细胞划痕法检测细胞二维空间迁移情况,在倒置显微镜(×100)下分别测量每组细胞在0、24、48和72 h通过划痕区的长度占划痕区总长度的百分比代表其相对迁移率。6)Transwell小室试验细胞三维空间迁移情况,迁移细胞用结晶紫染色,在倒置显微镜下分别计数5个视野,取其均值。7)细胞黏附实验中0.02%结晶紫染色,酶联免疫仪上测定各孔570 nm A值。黏附率(%)=[(实验组细胞A值/BSA组细胞A值)-1]×100%。上述实验中每组3个复孔,实验重复3次。

表1 shRNA真核表达质粒的序列Table 1 Sequences of shRNA
1.3 统计学分析
用SPSS14.0统计学软件进行数据分析,均数±标准差以(±s)表示,进行方差齐性检验与方差分析。配对计量资料采用配对t检验。率的比较用χ2检验。
2 结果
2.1 沉默VEGF后A431细胞中VEGF mRNA和蛋白的表达
转染VEGF-s1,VEGF-s2的细胞中VEGF mRNA和蛋白表达量较N组显著减少(P<0.05),VEGF-s1与VEGF-s2组间以及转染T-off组与N组间均无差异(图1)。
2.2 沉默VEGF对A431细胞增殖的影响
2.2.1 CCK-8法检测转染各组A431细胞的增殖:转染后 24、48、72 和96 h,VEGF-S1,VEGF-S2 两组与N组相比细胞增殖能力显著下降(P<0.05)。转染VEGF-S1,VEGF-S2两组间以及转染T-off组与N组间均无差异(图2)。
2.2.2 流式细胞仪检测结果:与N组相比,转染VEGF-s1和VEGF-s2组细胞阻滞于G1期,S期细胞数显著减少,细胞增殖指数明显减小(P<0.001);转染VEGF-s1和VEGF-s2组间以及转染T-off组与 N组组间均无差异。转染 VEGF-s1,VEGF-s2的细胞出现有意义凋亡峰(12%和11.28%)显著高于转染 T-off组(0.91%)(P<0.05),N组未出现凋亡峰(图3)。
2.3 沉默VEGF对A431细胞迁移的影响


2.3.1 划痕实验:显示转染VEGF-s1和VEGF-s2两组相对迁移率明显比N组小(均P<0.05),其他时间点各组间均无显著差异(图4)。
2.3.2 Transwell小室检测结果:显示转染VEGF-s1和VEGF-s2两组细胞穿膜数(111±29和103±16)明显少于N组(332±10)(P<0.05),而VEGF-s1与VEGF-s2组间以及N组与转染T-off组(290±12)组间均无显著差异(图5)。
2.4 沉默VEGF对A431细胞黏附的影响
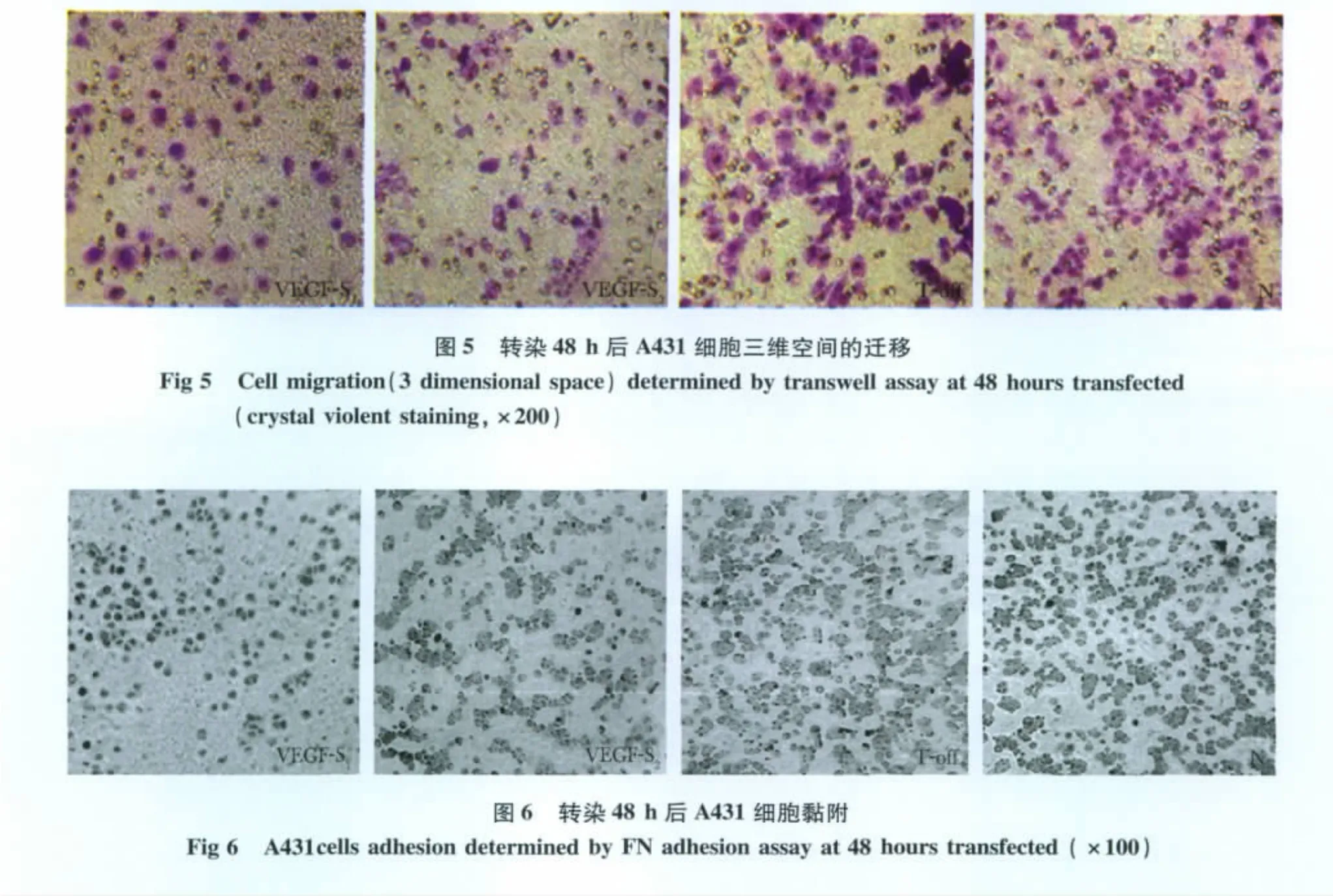
细胞黏附的结果:显示转染VEGF-s1和VEGF-s2两组细胞黏附率(15.06%±0.28%和16.70%±0.65%)明显比 N组(39.60% ±0.92%)低(P<0.01)。VEGF-s1与 VEGF-s2组间及 N组与 T-off组(36.02% ±5.02%)间均无显著差别(图6)。
3 讨论
本研究通过RNAi技术抑制皮肤鳞癌A431细胞中VEGF表达,研究VEGF对癌细胞增殖、迁移和黏附的作用。研究结果显示,本研究设计与构建的靶向VEGF的shRNA(VEGF-s1,VEGF-s2)质粒转染A431细胞后能显著抑制细胞内VEGF mRNA和VEGF蛋白的表达。通过靶向VEGF的RNAi技术处理A431细胞后细胞增殖能力明显下降,发生G1期细胞周期阻滞,并使细胞调亡增加,进一步抑制了细胞迁移和黏附。该结果提示,VEGF与A431细胞增生、凋亡、迁移、黏附存在着密切关系。研究结果证明,本文构建的靶向VEGF的RNAi质粒具有较好的靶向性和高效性,为今后进一步在皮肤鳞癌中靶向VEGF的抑癌研究提供了基础。
[1]Wang S,Liu H ,Ren L,et al.Inhibiting colorectal carcinoma growth and metastasia by blocking the expression of VEGF using RNA interference [J].Neoplasia,2008,10:399-407.
[2]Takei Y,Kadomatsu K,Yuzawa Y,et al.A small interfering RNA targeting vasculator endothelial growth factor as cancer therapeutics[J].Cancer Res,2004,64:3365 -3370.
[3]荆春霞,张洹.VEGF siRNA的筛选、评价及siRNA的设计规则探讨[J].基础医学与临床,2006,126:579 -585.

