PDE4B、BCL-2 在B 细胞非霍奇金淋巴瘤中的表达及其意义
杜 丽,古力巴哈尔·阿不力米提,顾 霞,郭祥萍
B 细胞非霍奇金淋巴瘤是淋巴造血系统肿瘤中最常见的类型,分类繁多、复杂,诊断困难,临床预后较差。磷酸二酯酶(phosphodiesterase,PDE)是催化环腺苷酸(c-AMP)和(或)环鸟苷酸(c-GMP)水解的蛋白酶超家族。PDE4B 对c-AMP 水解失活从而废除c-AMP 对B 淋巴细胞的抑制作用,导致B 淋巴细胞过度增殖[1]。PDE4B 在炎性反应过程中扮演重要角色,因其抑制药具有较强的抗炎作用而作为药物研究的新靶点[2]。BCL-2 是一种抗凋亡蛋白,在多种类型的淋巴瘤中存在高表达,认为与预后不良有关。本研究应用免疫组化技术检测B-NHL 中PDE4B 和BCL-2 的表达,探讨二者在淋巴瘤发生、发展中的作用及对临床诊断、分型的意义。
1 对象与方法
1.1 对象 收集中山大学第一附属医院和新疆医科大学第一附属医院病理科2001-2007 年诊断为B-NHL 的石蜡标本93 例,另选10 例淋巴结反应性增生做为对照。所有病例均做免疫组化CD3、CD5、CD10、CD20、CD23、CD30、CD38、CD79α、BCL-2、BCL-6、MUM-1,按照WHO2008 年淋巴造血组织肿瘤分类方案进行重新分类诊断[3]。
1.2 试剂 PDE4B(美国SIGMA 试剂公司);BCL-2(ZAME 试剂公司);S-P 超敏试剂盒(北京中杉试剂公司)。
1.3 方法 组织用10%中性缓冲甲醛固定,石蜡包埋,切厚度4 μm 切片,采用S-P 免疫组织化学染色方法,常规脱蜡至水化;枸橼酸缓冲液(pH =6.0)中微波加热10 min(95℃)进行抗原修复;一抗(PDE4B、BCL-2 稀释浓度分别为1∶35,1∶50)4℃过夜,DAB 显色,苏木素复染。胆囊癌切片作为阳性对照,以PBS 代替一抗作阴性对照。
1.4 结果判定 根据肿瘤细胞中阳性细胞所占的百分比分为:≤4%为0 分,5% ~15%为1 分,16%~30%为2 分,31% ~50%为3 分,≥51%为4 分;阳性细胞的着色强度分为:无着色或与背景均匀一致的淡黄色为0 分,浅棕黄色为1 分,棕黄色为2分,棕褐色为3 分。两积分相乘,0 分为阴性(-),1 ~4 分为弱阳性(+),5 ~8 分为中等阳性(+ +),9 ~12 分为强阳性(+ + +)[4]。
1.5 统计学处理 数据应用SPSS17.0 统计软件处理,采用确切概率法,以P <0.05 有统计学意义。
2 结果
2.1 PDE4B 在B 细胞非霍奇金淋巴瘤各亚型中的表达 有两种定位表达模式:弥漫性细胞质着色和核旁细胞质中类似高尔基体的点状着色(点状着色较弥漫性着色强度强)。PDE4B 在B-NHL 中表达强度存在差异,以LPL 最高,2 例均为强阳性(++)(图1);DLBCL 阳性率为44.26%(27/61)(图2)、LBL 为40%,3 例BL 均不表达(表1)。
2.2 BCL-2 在B 细胞非霍奇金淋巴瘤各型中的表达 BCL-2 在淋巴瘤瘤细胞的细胞质和部分细胞膜定位表达。在FL 中全部表达;在DLBCL 阳性率为83.61%(51/61)(图3);3 例BL 均为阴性表达(表2)。

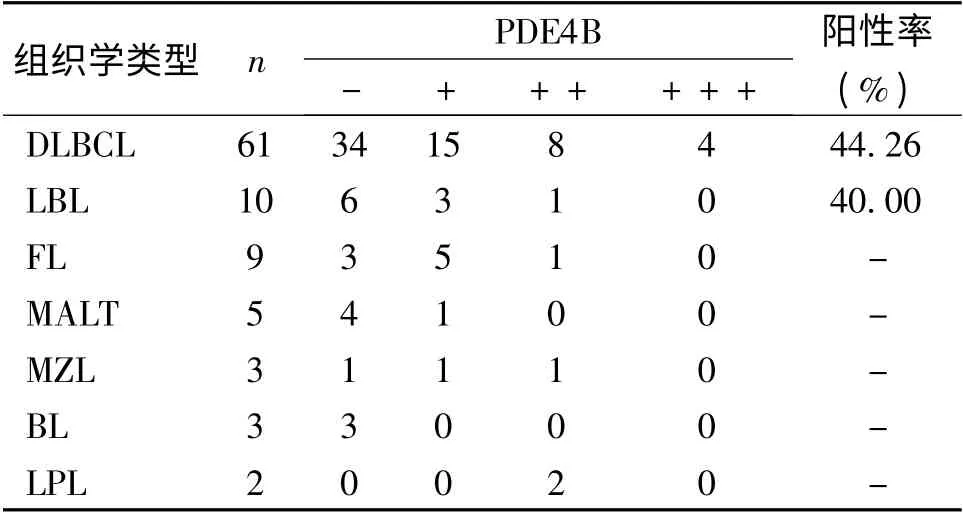
表1 PDE4B 在B 细胞非霍奇金淋巴瘤各型中的表达

表2 BCL-2 在B 细胞非霍奇金淋巴瘤各型中的表达
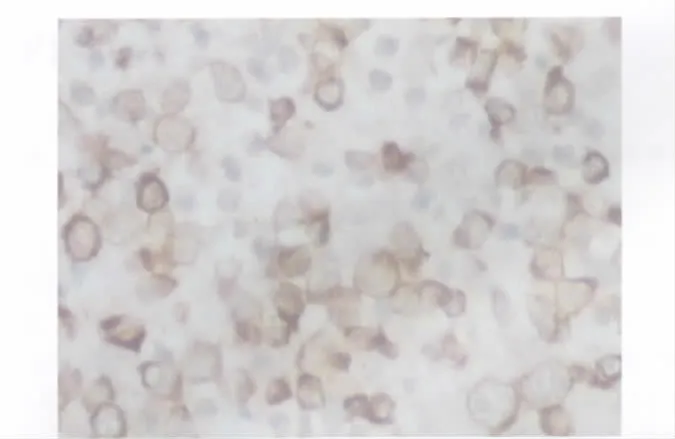
图3 BCL-2 在DLBCL 中的阳性表达(HE,×400)
2.3 PDE4B、BCL-2 在弥漫大B 细胞淋巴瘤中的表达 PDE4B 在DLBCL-GCB (生发中心型)的阳性表达率为61.54%(16/26),在DLBCL-non-GCB(非生发中心型)的阳性表达率为31.43%(11/35),差异有统计学意义(χ2=5.482,P <0.05)。BCL-2在DLBCL-GCB 亚型中的阳性表达率为80.77%(21/26),在DLBCL- non-GCB 亚型中的阳性表达率85.71%(30/35),差异无统计学意义(P >0.05)。PDE4B 和BCL-2 在性别、民族、年龄、发病部位方面差异均无统计学意义(P >0.05,表3)。
2.4 PDE4B 在DLBCL 不同亚型中的表达形式在GCB 和non-GCB 亚型中点状表达分别为(5/16),(5/11);弥漫表达分别为(5/16),(3/11);两种同时表达分别为(6/16),(3/11)。表达形式在DLBCL-GCB 和DLBCL-non-GCB 亚型中的差异无统计学意义(χ2=0.594,P >0.05)。

图4 PDE4B 在淋巴结反应性增生的表达(HE,×100)
2.5 PDE4B 和BCL-2 在淋巴结反应性增生中的表达 PDE4B 在反应性增生的滤泡生发中心吞噬细胞呈较强阳性表达,中心母细胞和中心细胞呈弱阳性表达,套区细胞呈阴性,副皮质区毛细血管内皮细胞呈阳性表达,并可见散在的小淋巴细胞呈阳性表达,窦组织细胞呈阳性表达(图4)。BCL-2 在淋巴结反应性增生中套区小淋巴细胞和副皮质区的小淋巴细胞呈较强阳性表达,滤泡生发中心细胞(中心细胞和中心母细胞)毛细血管内皮细胞呈阴性。
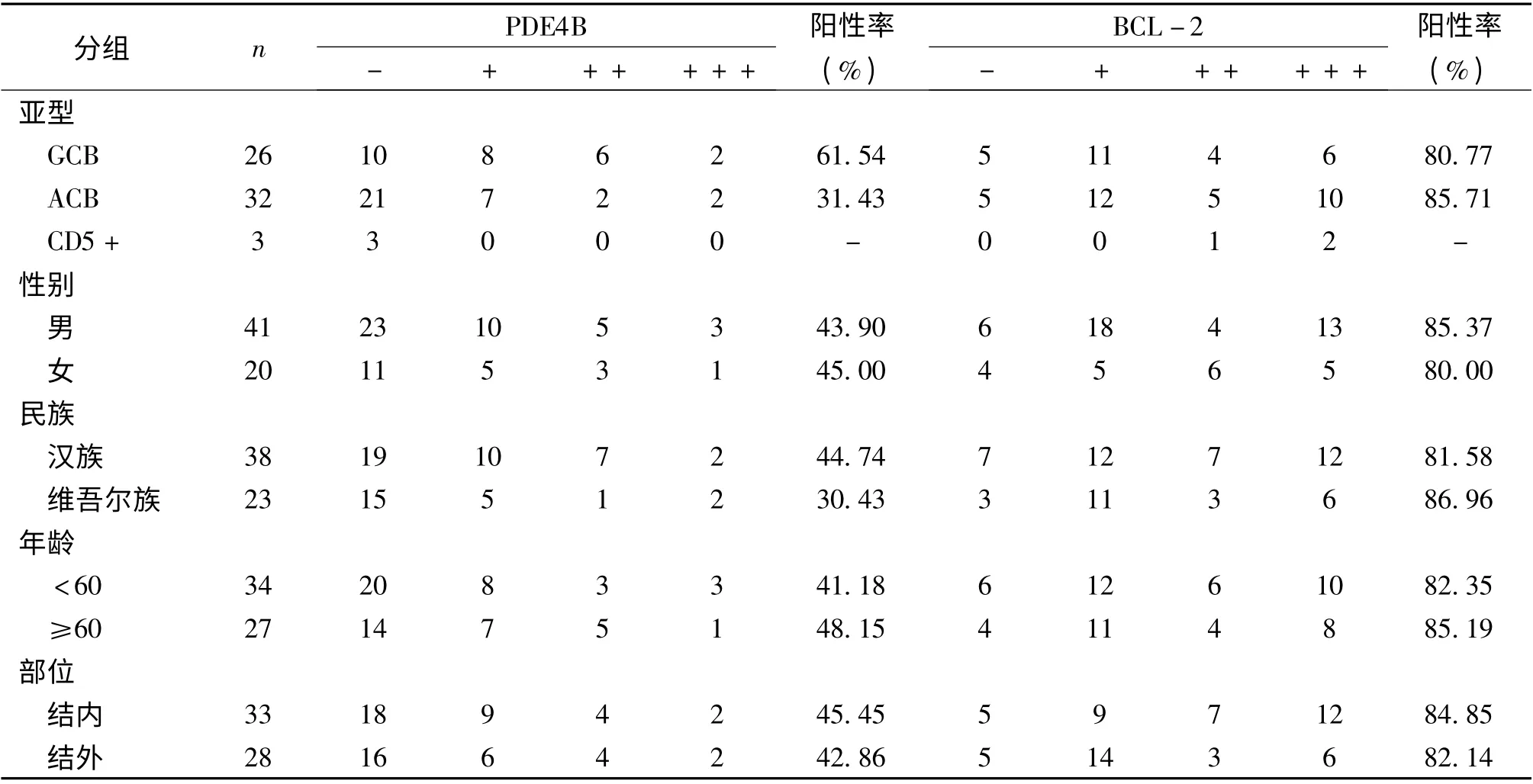
表3 PDE4B,BCL-2 在弥漫大B 细胞淋巴瘤中的表达
3 讨论
PDE 催化c-AMP 和c-GMP 水解开环分别生成AMP 和GMP,这是细胞内降解c-AMP 和c-GMP 的主要途径,通过调节细胞内c-AMP 水平,从而抑制c-AMP 诱导的凋亡[5];同时PDE4B 选择性刺激单核细胞产生TNF-α,促进T 淋巴细胞增殖,在炎性反应、过敏反应中起着重要的作用,已作为药物研究的新靶点[2]。Smith 等[5]研究发现,在反应性增生淋巴结生发中心的中心细胞和中心母细胞PDE4B 的水平很低(与本研究在反应性增生淋巴结的表达一致),而DLBCL-GCB 型PDE4B 的表达水平也较低。文献[6]报道,对化疗药物耐药的DLBCL 为PDE4B 高表达,高表达的PDE4B 抑制了c-AMP 诱导的细胞凋亡,可促进肿瘤细胞增生。Adam Lerner 等[7]研究认为PDE4B 可作为B-NHL 的治疗靶点和判断预后指标。
本实验中,PDE4B 在LPL、FL、MZL 中表达较高,在DLBCL、LBL、MALT 和BL 中表达较低。不同类型的淋巴瘤,PDE4B 表达变化不一,似乎与淋巴瘤侵袭性的关系不密切。病变过程呈惰性的LPL、FL、MZL,临床上病程进展较慢,侵袭性较弱,PDE4B表达率较高;而在恶性程度较高的LBL 中表达较低,在高度侵袭性的BL 不表达。因此,笔者认为,PDE4B 与淋巴瘤的侵袭性可能呈负性相关,在判断惰性淋巴瘤分期和预后方面可能具有一定意义。
本研究发现,PDE4B 阳性表达的均为中等大小的瘤细胞,而恶性程度高、细胞增殖旺盛、核分裂明显的大瘤细胞一般没有表达;在DLBCL-GCB 中PDE4B 表达较高于non-GCB 亚型,3 例CD5+DLBCL 全部为阴性,进一步说明PDE4B 与淋巴瘤恶性程度和侵袭性呈负性相关。这与Smith 等[5]和Adam Lerner 等[7]的研究结果不一致。由于PDE4B 与淋巴瘤关系的研究报道较少,笔者推测其发生机制可能与cAMP 的活化和水解有不同途径有关:在non-GCB 亚型中淋巴瘤细胞c-AMP 的活化路径可能除了PDE4B,还可能有别的成员(如PDE4A 或D等)参与[8];而在GCB 亚型的活化路径PDE4B 可能起着主要的作用,所以表达较高。另外,61 例DLBCL 中有23 例为维吾尔族患者,是否可能存在别的作用机制,有必要做进一步的研究。
本研究发现,PDE4B 在淋巴瘤肿瘤细胞有两种定位表达形式,有报道PDE4B 在鼠胚纤维母细胞内水解c-AMP 存在不同的亚细胞定位[9],推测两种表达形式可能反映了PDE4B 在细胞内功能上的变化。本研究中这两种表达形式单独或同时存在,在DLBCL-GCB 和non-GCB 亚型的表达差异无统计学意义。PDE4B 的不同表达形式是否存在功能上的差异,与肿瘤的恶性程度是否有关,尚不清。
BCL-2 也是一种原癌基因,其异常表达可促进肿瘤的发生[10]。在DLBCL 中BCL-2 阳性率为83.61%,与文献报道及笔者前期的研究一致[11,12]。虽然在GCB 和non-GCB 亚型中没有统计学差异,但两者表达的机制却不同,GCB 亚型通常与t(14;18)(q32;q21)染色体易位有关,易位的BCL-2 基因位于IgH 增强子调控下,导致BCL-2 过表达。而另一种表达机制是由于BCL-2 的基因扩增。Muris 等[13]推荐在GCB/ACB 相关CD10 和MUM1中加入BCL-2,进行新的预后分型,认为BCL-2可以作为DLBCL 预后的一个辅助参数。
本研究中BCL-2 在FL、LPL、MZL 表达较高(多为强阳性),其中在FL 全部阳性,推测BCL-2对诊断FL 具有重要意义。但大多数低级别B 细胞性肿瘤均表达BCL-2,故不能作为淋巴瘤鉴别诊断的指标。
[1] 鲍红娟,张燕玲,乔延江. 磷酸二脂酶4 抑制剂药效团模型的构建[J]. 中国医药生物技术,2008,3(4):266-272.
[2] 汤慧芳,陈季强,王 鹏. 磷酸二脂酶4 作为抗炎药物靶点的研究现状及未来发展方向[J]. 中国药科大学学报,2006,37(1):9-13.
[3] Jaffy E S,Harris N L,Stein H,et al.World Health Organization Classification of Tumours Path-ologyand Genetics of Tumours of Haematopoietic and Lymphoid Tissues[M].Lyon:IARC Press,2008:168-268.
[4] 孟 伟,石雨薇,顾 霞,等. PKC-βⅡ、NF-κBp50在弥漫性大B 细胞淋巴瘤中的表达与其意义[J]. 临床与实验病理学杂志,2011,27(1):56-59.
[5] Smith P G,Wang F,Wilkinson K N,et al. The phosphodiesterase PDE4B limits c-AMP associat-ed PI3K/AKT-dependent apoptosis in diffuse large B-cell lymphoma[J]. Blood,2005,105(1):308-316.
[6] Lerner A and Epstein P M.Cyclic nucleotide phosphodiesterases as targets for treatment of haematological malignancies[J].Biochem J,2006,393(Pt 1):21 –41.
[7] Dou A,Wang X. Cyclic adenosine monophosphate signal pathway in targeted therapy of lymphoma[J]. Chin Med J,2010,123(1):95-99.
[8] Whitaker C M,Cooper N G.The novel distribution of phosphodiesterase-4 subtypes within the rat retina[J].Neuroscience,2009,163(4):1277-1283.
[9] Blackman B E,Horner K,Heidmann J,et al.PDE4D and PDE4B function in distinct subcellular compartments in mouse embryonic fibroblasts[J]. Biol Chem,2011,10:328-329.
[10] Green D R,kroemer G. The pathophysology of mitochondrial cell death[J]. Science,2004,70:626-629.
[11] 阳文捷,宋向群.BCL-2 和BCL-6 与淋巴瘤相关性研究进展[J]. 中华肿瘤防治杂志,2006,13 (22):1756-1759.
[12] 顾 霞,林汉良,沈 艳,等. 不同类型淋巴瘤中survivin 和bcl 2 的表达及意义[J]. 临床与实验病理学杂志,2005,21(2):159-163.
[13] Muris J J,Meijer C J,Vosw,et al.Immunohistochemical profiling based on BCL-2,CD10 and MUM1 expression improves risk stratification in patients with primary nodal diffuse large B-cell lymphoma[J]. Pathology,2006,208:714-723.

