国外潜艇硼氢化钠水解制氢的研究与进展
李宏伟,李大鹏,张晓东
(海军工程大学,湖北 武汉 430033)
国外潜艇硼氢化钠水解制氢的研究与进展
李宏伟,李大鹏,张晓东
(海军工程大学,湖北 武汉 430033)
叙述了国外潜艇AIP装置硼氢化钠水解制氢的研究与进展,介绍了硼氢化钠溶液水解制氢方法、水解反应催化剂,描述了潜艇硼氢化钠水解制氢系统、管式和一体式硼氢化钠水解制氢反应器的组成与工作,分析了制氢器反应区内的两相流动现象、反应区体积和换热-冷凝器传热面积要求,以及制氢器内液滴的分离、固体颗粒的沉淀和悬浮物的过滤、制氢器的动态特性等问题。
潜艇;AIP;硼氢化钠;水解制氢
0 引言
基于燃料电池的电化学发电机装置是最具竞争力的潜艇AIP装置之一。其中最常用的是氢氧燃料电池。氢氧燃料电池能量转换效率高,惟一的反应产物为水,散热少,噪声低,维护保养方便,便于实现集中控制和自动化,过载能力强,可根据潜艇内部布置需要灵活配置,随输出功率变化特性好,不足之处在于所使用燃料氢的危险性大,装置功率密度较小。潜艇电化学发电机装置性能的决定因素主要在于氢的储存与制备,目前氧的储存与制备技术已经非常成熟、可靠、安全且经济。制氢与储氢已成为潜艇电化学发电机装置发展的“瓶颈”,关键问题是制造简单、可靠和安全的储氢和制氢系统。
硼氢化钠(Sodium borohydride,NaBH4)水解制氢具有以下优点:
1)NaBH4溶液可在空气中稳定储存数月,只需塑料容器储运;
2)仅在指定催化剂存在下才会发生氢气产生现象,甚至在0℃下也可进行;
3)制得氢气纯度高,可直接供氢;
4)制氢速率可控;
5)生态安全性好;
6)单位体积和重量的氢容量很高,是一种高密度氢源;
7)制氢系统可实现自动化控制,氢气流量和压力可调;
8)水解产物NaBO2可再生。
1 硼氢化钠溶液水解制氢
硼氢化钠溶液水解反应速率与溶液pH值、反应温度有关。当pH=8,即使在常温下,硼氢化钠溶液也会很快水解。当温度为25℃,pH值为14,硼氢化钠溶液半衰期为430天,可满足储存和使用要求[1-4]。催化剂、酸或升高温度都可以加速硼氢化钠溶液的水解速度。
硼氢化物溶液的水解可以通过添加NaOH,提高溶液pH值加以控制。当添加NaOH所占质量百分比在5.5%~14%时,在308 K温度下和30个昼夜期间内,硼氢化钠溶液的水解转化率从10%减小到3.5%[5]。使用蒸馏水制成的硼氢化钠溶液实验表明,在293 K温度下,硼氢化钠就可以水解产生氢气。如果增大反应温度,反应速度将会更为强烈。在366 K温度下,整个硼氢化钠溶液体积内都会有剧烈的氢气泡产生。
常温下硼氢化钠也会溶解于水,但常温下水解反应速度很慢,并且可以通过添加NaOH加以抑制。将硼氢化钠以水溶液形式储存,可以减少向制氢系统中加注反应物的工作量和工作难度。潜艇使用条件下硼氢化钠水解反应制氢的研究方向之一,是保证在271~305 K的海水温度范围内,储存的硼氢化钠溶液不会缓慢地释放出氢气。此外,还要决定最大氢气产生率下的硼氢化钠溶液浓度。
硼氢化钠水溶液中NaBH4浓度(质量百分比)一般在22%~28%之间。浓度上限由舷外水最低温度(271 K)下的硼氢化钠溶解度决定。10%浓度下的硼氢化钠溶液具有最高的水解反应转化率,因此储存容器中的高浓度硼氢化钠溶液必须稀释到10%浓度再加以使用。
在稳定的碱性硼氢化钠溶液中,NaOH浓度在14%~16%范围内,下限由在最大环境介质温度下(305 K),硼氢化钠溶液不可控地发生水解反应释放出的氢气决定。不希望将NaOH浓度提高到16%以上,因为这样潜艇将反应产物排出舷外时形成的尾迹会增大。此外,随着NaOH浓度增大,在其他条件相同情况下,硼氢化钠溶液水解过程的温度会提高,使得氢气中含有更多的自硼氢化钠溶液蒸发的杂质混合物,从而污染氢气。
2 硼氢化钠水解制氢催化剂
催化剂一般使用贵重金属,也可以使用Fe,Co,Ni,Mn等非贵重金属离子或其混合物的水溶液作为催化剂,其中Co对硼氢化钠水解反应的催化作用较好。A.Levy等[6]研究了 Ni、Co及 Raney-Ni、Raney-Co,发现它们对硼氢化钠水解反应具有良好的催化作用。Brown等[7]在研究了一系列的金属盐催化剂后发现,Ru和Rh的金属盐类对硼氢化钠水解反应的催化作用最强。Steven等[8-9]使用离子树脂负载Ru催化剂的方法,通过一系列实验对催化剂制备、Ru覆着量、催化剂利用率、温度以及溶液pH值对氢气生成速率的影响进行了研究,发现覆着在阴离子交换树脂上的Ru催化剂比覆着在阳离子交换树脂上的效率高。Yoshitsugu等[10]研究了Pt-LiCoO2催化剂的使用。在30 g浓度为20%的硼氢化钠溶液(10%NaOH+20%NaBH4+70%H2O)中,加入5 mg的Pt催化剂,氢气生成速率可达9.7×10-4g/s(约10 ml/s),但氢气生成速率随时间增长而增大,这使得控制氢气生成速率的难度增大。Dong等[11]指出,将NixB真空高温处理后,可以提高催化性能。对5%NaOH+10 g NaBH4+18 g H2O溶液研究发现,45℃温度下的产氢量达6.75%,室温下也可达4.0%以上。同时还研究了不同NaOH浓度对溶液产氢量的影响,发现当NaOH浓度高于10%后,产氢量随NaOH浓度的上升而下降,其原因是硼氢化钠水解产物NaBO2覆着在催化剂表面,使得反应速率降低。从另一个角度讲,NaBH4浓度增大意味着溶液中水所占的百分比相对降低,而没有水,则水解反应自然也无从谈起。因此,进入制氢反应器的硼氢化钠溶液浓度应保持在10%左右。在实验室条件下,对直径为0.3~0.8 mm的Ni/Al粉末颗粒状合金催化剂进行了研究,并与CoCl2催化剂进行了比较[12]。CoCl2催化活性要比Ni/Al合金高,但Ni/Al合金价格更便宜,且不会对生态环境有不利影响,因此固体催化剂相比CoCl2溶液催化剂具有优势。若使用固体催化剂,在制氢器体积内进行的是异质催化,催化速度主要由蒸汽-气体气泡从产生到破裂这一阶段决定。
在固体催化剂表面上,硼氢化钠溶液中在异质催化作用下有氢气核生成,随后气核逐渐长大并脱离催化剂表面。气核将在固体催化剂表面的微穴内产生。微穴内形成的气核在长大直至脱离微穴这一阶段内是不稳定的。当气泡脱离微穴,又会有溶液填充原来气泡所占据的空间,这样微穴又可以充当下个气泡的气化核心。
固体催化剂表面上微穴内气泡的充满过程实际上不仅取决于微穴的形状和尺寸,也依赖其他许多因素,如液体和蒸汽-气体的物理化学性质、微穴几何形状和表面粗糙度、微穴中蒸汽-气体的吸附能力、表面材料的物理性质、液体中的外部添加剂等。由可视化观察得知[13],当向硼氢化钠溶液中浸入由Ni/Al固体催化剂制成的板条时,板条周围会产生大量雾状氢气泡,其中仅有很少的大尺寸气泡会从板条表面脱离。固体催化剂表面呈现均匀粗糙化状态,粗糙度一般在15~20 μm,粗糙表面上布满了沟槽状微穴,平均宽度约1.5 μm。
为防止燃料单元电极表面覆着的催化剂中毒,对氢气纯度有较高要求。必须要限制氢气中的水蒸气含量。氢气温度变化范围由在最低负载下电化学发电机的工作要求和电极寿命决定,电极寿命随温度升高而缩短。硼氢化钠水解制得的氢气中不含有COX,SOX,NOX等气体杂质,经干燥后可以直接使用,尤其适用于质子交换膜燃料电池(PEMFC)。
在10%浓度的NaBH4碱性水溶液中,在368~413 K温度,2.5 MPa压力和CoCl2催化剂作用下,反应方程为
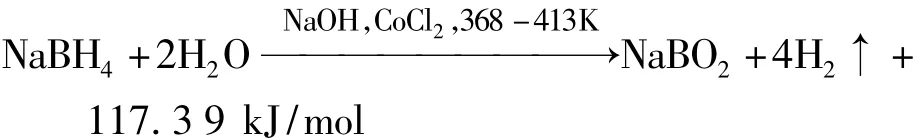
水解反应过程中有大量热量放出。对于AIP潜艇,如果这部分热量直接排出舷外,会增大潜艇热特征,因此,须对硼氢化钠水解制氢系统的冷却系统予以重视。
催化可分为同质催化和异质催化2种。在同质催化反应中,参加反应的分子和以原子、分子或离子形式存在的催化剂处于同相,构成均匀化学系统。在异质催化反应中,化学反应在相间表面上进行。在以CoCl2为催化剂的NaBH4水解反应中,CoCl2和NaBH4作用,生成CoB,反应方程为
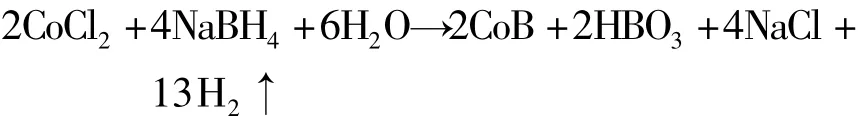
上述反应生成CoB离散状微小颗粒,因此在制氢器反应区内进行的是异质催化反应。静止溶液中的CoB颗粒由于具有较高密度(~7 200 kg/m3),会慢慢沉淀。
异质催化剂活性受催化剂和反应物分界面面积影响很大。催化剂的一个重要特性参数是比表面积,定义为1 g或1 cm3催化剂对应的相分界面面积。实际装置中,制氢器反应区所需CoCl2催化剂的浓度为2%。
3 潜艇硼氢化钠水解制氢系统
硼氢化钠水解制氢系统在实验室原型系统和理论分析上已经进行了非常充分的研究[12](见图1)。硼氢化钠溶液储存箱布置在耐压壳体之外。这种布置可以减小耐压壳体内动力装置所占体积,简化由于反应物消耗而需使用舷外水替换其所占质量的过程。气瓶布置在耐压壳体和非耐压壳体之间,左右舷对称。气瓶为不规则的曲线形状,设计成独立模组。
弹性挤出器的作用是排出储存箱中制备好的硼氢化钠溶液。在较大舷外水压力下,可以实现溶液的无泵输送。其他设备如2台制氢器、过滤器-沉淀槽、2台氢气干燥器及储存箱等,都布置在耐压壳体内部。净化过滤器-沉淀槽用于净化过滤经过制氢器的溶液。反应产物中分离出不溶于水的CoB黑色沉淀物后,再排出舷外。净化干燥器的吸附剂可通过预热,实现重复使用。
制氢器入口处硼氢化钠溶液的最佳NaBH4浓度保持在10%~15%。制氢器出口处引入电化学发电机反应产物冷凝水及在制氧和储氧系统中来自蒸汽-氧气混合物的冷凝水。这些蒸馏水先进入凝水箱,再泵入制氢器。为加速水解反应,向制氢器还输入2%NaBH4质量的CoCl2。CoCl2溶液使用氮气自催化剂箱中送出。
目前,还未见有专门报告发表溶剂水的化学组成对硼氢化钠水解过程的影响研究,但一般都认为为保证制得氢气具有较高纯度,溶剂水中含有的杂质应尽可能地少。使用蒸馏水可以很好地解决这个问题。硼氢化钠在15~20 MPa压力下的容器中以溶液形式储存,溶液密度在800 kg/m3左右。当固体硼氢化钠在常温(305 K)下与水接触时,水解反应速度很小,这时进行的主要是溶解过程。
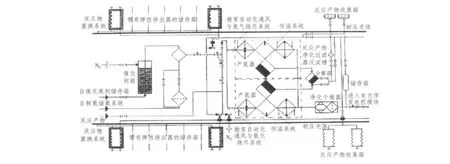
图1 潜艇硼氢化钠水解制氢系统Fig.1 Submarine AIP sodium borohydride hydrolysis hydrogen generation system
溶液中含有杂质有助于气体分解反应,杂质是水解过程的催化剂,也即气化核心。如果不提高溶液温度,当杂质消耗完毕后,气体分解过程也就中止了。如向溶液中添加少量碱(到质量百分比的1%左右),可以增大水解过程进行难度,使水解过程放缓。如将自来水溶解的硼氢化钠溶液加热到318~323 K,可以加速氢气分解。使用海水可以使强化氢气分解的预热温度降低到310~315 K。
若硼氢化钠溶液中不含或含有少量碱,可以在一个较宽溶液浓度范围内控制氢气分解速度。淡水中,这个浓度范围是1.5%~25%。浓度范围主要取决于水解反应温度。当硼氢化钠溶液浓度降低到2%~3%时,氢气分解速度会降低。
使用海水可以改变硼氢化钠水解反应进程,可将硼氢化钠溶液浓度降低至0.5%,并可实现硼氢化钠溶液几乎完全得到利用。而使用淡水时,当溶液浓度低至2%~3%时,就只有使用催化剂才能分解出氢气。使用海水应满足以下条件:
1)海水中不应含有气化和污染氢气的杂质;
2)海水中不应含有在产氢过程中会分解或带来其他有害影响的物质。海水通过净化完全可以满足上述要求。
以加压容器储存硼氢化钠溶液的制氢系统见图2。在反应器-水解槽处于长期待机状态期间,气体管道和空置的系统空间如硼氢化钠储存罐都以惰性气体填充。制氢系统投入时,先启动海水泵和启动泵。启动泵将水自排放箱打入硼氢化钠储存箱,在其中硼氢化钠开始溶解,生成的硼氢化钠溶液进入1台制氢器中。硼氢化钠溶液充满循环管路后,停止供水。
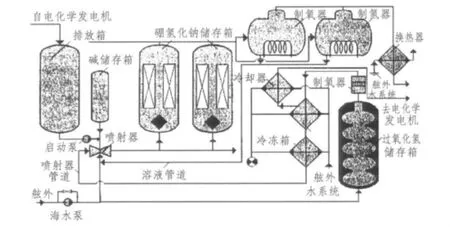
图2 以加压容器储存硼氢化钠溶液的制氢系统Fig.2 Hydrolysis hydrogen generation system with sodium borohydride liquor pressurized storge
为防止硼氢化钠溶解期间气体生成,利用氮气压力将NaOH水溶液自碱储存箱注入溶液回路,这时允许在制氢器上部空间有少量气体产生。当硼氢化钠储存箱中的溶液温度升高时,硼氢化钠储存箱中的海水冷却器投入。
自过氧化氢储存箱中排出过氧化氢,并将过氧化氢输入过氧化氢分解反应器与使用溶液填充制氢器操作同步进行。过氧化氢分解反应器中生成的蒸汽-氧气混合物进入冷凝器,在其中水蒸气被冷凝,出口处的蒸汽-氧气混合物温度取决于过氧化氢浓度,工作压力不应低于保证喷射泵正常工作的最小压力。凝结水在必要时要进行冷却,将其从饱和温度降到喷射泵工作所需温度,并注入到喷射泵入口。喷射泵进入工作状态后,启动泵停止运行,之后循环由喷射泵保证。
在硼氢化钠溶解过程中,硼氢化钠溶液浓度不断增大。当溶液浓度增大到足够保证达到所需的产氢率时,制氢器工作准备宣告完毕,并从循环回路中解除。当第1台制氢器解除、工作状态准备就绪后,第2台制氢器接入并进行工作准备。
冷凝器中分离出来的氧气进入冷却器冷却,然后流向电化学发电机舱室。制氢器和制氧器投入并进入到工作状态后,产生气体流向燃料电池。
通过监测反应器中的溶液温度,增大或减小内置于反应器中冷却器的舷外水供给流量来实现制氢器产氢率的调节。通过调节舷外水供给流量,将进入电化学发电机的氢气冷却到所需温度。根据制氢器中溶液浓度的降低程度,视情将第2台制氢器投入。第2台制氢器投入后,第1台制氢器处理剩余的硼氢化钠溶液。
在这种制氢系统中,可以包括液态催化剂供给系统,该系统可在硼氢化钠溶液浓度降低的工作过程关键阶段向溶液中添加催化剂。液体催化剂能在较低浓度的硼氢化钠溶液中得到更为充分的利用。使用固体催化剂时,可以适当降低溶液工作温度,并在较低硼氢化钠溶液浓度下也可进行水解反应。
4 管式和一体式硼氢化钠水解制氢反应器
NaBH4水解制氢反应器主要有以下2种形式:
1)管式反应器(见图3)
沿高度方向上有3个取样接管,用于确定溶液浓度,并据此判断NaBH4的转化程度。管式反应器为可拆卸式结构,球状下封头和球状上顶盖使用法兰紧固联接到主壳体上。反应区内有312根垂直布置的8 mm内径管子,NaBH4溶液在管内流动,反应区冷却水在平行管束构成的流道空间内流动。
反应器启动时,注入热水,反应区加热到363~368 K。随着NaBH4溶液和CoCl2催化剂的注入,水解反应开始并放出热量,反应区温度升高,反应强度增大。在大部分情况下,反应器会稳定工作。当负荷减小时,NaBH4溶液流量和氢气产量会出现脉动,这主要由2个原因造成:①产氢率调节系统的调节特性;②反应区平行通道内存在水力学波动。打开反应器顶盖和封头对其内部表面进行检查,仅在管道表面和下封头有部分CoB沉淀物。
2)一体式反应器

一体式硼氢化钠水解制氢反应器结构如图4所示。与管式不同,一体式反应器的结构更加紧凑,具有蒸汽-氢气混合物冷却、蒸汽冷凝和分离氢气中含有水分等功能。壳体内布置有2级反应区,用于冷却氢气和冷凝水蒸气的换热器及碟形分离器等。第一级反应区为不锈钢双入口蛇形管,管内直径15 mm,长12.3 m。以210 mm的曲率直径,节距为23 mm地盘绕在筒体上。NaBH4溶液自2根独立的输入接管流入反应器下部空间蛇形管。内部含有氢气泡的乳状溶液进入反应器上空间,蒸汽-氢气混合物再由反应器上部空间进入换热器,未分解的NaBH4溶液落入第二级反应区,在其中进行最后的分解,水解产生氢气与水蒸气一起流入并沿环形间隙向上,与来自第一级反应区的蒸汽-氢气混合物一起进入换热器,水解产物沿接管排出。换热器中的蒸汽-氢气混合物被冷却,水蒸气被冷凝,润湿的氢气进入碟形分离器,除去水分后进入第二级反应区,氢气沿环形间隙向上流动,通过排出接管流出反应器。一体式制氢反应器是为无催化剂水解反应设计的。水解过程中,温度保持在470 K。
在反应区内,硼氢化钠溶液应自下向上运动,以减小NaBH4溶液和催化剂管道被CoB结垢堵塞的可能性。向制氢反应器壳体内输送硼氢化钠溶液和催化剂的接管必须使用不同的管道。无催化剂的制氢反应器可使用回收热量加热和来自制氧系统的蒸馏水稀释溶液。
反应区容积的上部空间内布置有孔板,保证负荷均匀。催化剂自接管流入反应区。在蛇形管换热器中进行氢气的冷却和水蒸气的冷凝。使用离心式分离器粗分离湿润氢气中含有的水分,然后在百叶窗式分离器中进行细分离。氢气由布置在制氢反应器上部壳体上的输出接管排出。来自制氧系统、用于硼氢化钠溶液稀释和预热的热水自接管流入。初始浓度为28%的硼氢化钠溶液自接管流入制氢反应器。催化剂水溶液、硼氢化钠溶液和来自制氧系统的热水在收集器中混合。开始水解反应所需热量来自反应区中蛇形管预热器内流动的热水。
5 硼氢化钠水解过程的氢气产生和增长
CoCl2催化剂作用下的硼氢化钠水解时,氢气在固体催化剂颗粒表面优先释放出来。在这种情况下,催化剂是自发调节,因此形成的气相空间减小了进入反应区的反应物质量,一直持续到气液两相空间建立起动态平衡为止。CoB颗粒上发生氢气泡的生长现象。氢气泡尺寸取决于气泡的脱离力和将气泡粘附在固体颗粒表面上的附着力大小。脱离力包括浮升力和溶液流动时的水动力学力,附着力为表面能力。
在溶液流动中,气相的一般性形成机理和过程如下:在初始溶液所占的不大空间内,在液相空间会形成以微小气泡形式存在的气相;溶液温度升高会加速气泡中气体的扩散,并增大出现相对大尺度气泡脉动的发生概率。当气泡尺度增大到足够大,气泡形成将会稳定下来,并成为气化核心。气泡尺寸将持续增大。微小气泡的存在是不稳定的,这是因为当气相空间达到了一定的规模,溶液的体积变化不能弥补相间接触面上出现的能量效应。如果认为气泡为球形,在小尺寸气泡情况下,气泡总的表面积与溶液体积之比相当大。气泡的最小尺寸决定了脉动情况下的液相稳定性。
大量的小尺寸气泡聚集存在的现象称为核态气化。核态气化属于液相的不稳定平衡状态。对于较小尺寸的气泡聚集情况,液相是稳定的;而对于较大尺寸的气泡聚集情况,气相是稳定的。化学反应时存在着确定的最小脉动尺度,进而转向向气相过渡的初始阶段,即气相的形成和初始增长阶段。这种大尺度的异相脉动是由液相空间内自发的核态气化维持的。这个过程发生在气相体积已经较大,并且大量大尺度氢气泡分解产生之前。
硼氢化钠溶液中气泡的长大是质量交换的结果。流动溶液中的传质可归结为以下2个原因:一是溶液中存在组分浓度差;二是水力流动。与组分浓度差和水力流动有关的传质称为溶液中物质的对流扩散。
硼氢化钠碱性溶液中含有的NaOH是很强的表面活化剂。氢气泡表面存在着表面活化剂可以改变扰流条件,增大流动阻力系数,同时减小传质强度。
6 制氢器反应区内的两相流动
蒸汽-氢气气泡在CoB颗粒上长大,将CoB颗粒一起带走,沿制氢反应器流道上升。在这个过程中必须要知道,是否这些气泡将会及时与催化剂颗粒脱离。因为气泡与催化剂脱离后,将会有新的NaBH4溶液补充占据原来气泡所占据的空间,这样反应重新开始。在反应初始阶段,当固体颗粒表面没有被形成气体遮盖,传质不会受到任何限制,反应速度仅由反应动力学效应决定。
生成的氢分子以气泡形式存在,将会遮盖住催化剂颗粒表面。这些气泡将会很快汇合成一个更大的气泡,这个大气泡的存在受表面张力的作用而得以维持。开始形成的氢气泡和催化剂颗粒一起浮升,而催化剂颗粒随后将作为气化核心。在气体外包壳和气化核心之间将会出现相对运动。氢气泡和催化剂的脱离是由于表面张力的作用。
在溶液中存在着的表面活化剂会减小表面张力。溶液中含有4% ~6%的NaOH,将会减小氢气泡的脱离直径。产氢量增大会单调地加大溶液流动速度,也会减小氢气泡的脱离直径,增大脱离频率。在这种情况下,硼氢化钠水解化学反应的反应强度将会增大。水解过程的受限不在于化学反应,而是伴随着氢气泡生长和脱离发生的传质现象。
制氢器反应区存在的两相混合物,从结构上可以分类为气体乳状液,其主要特征体现在含有气体、组成离散(从气泡尺寸和体积分布角度)和气相化学成分上。氢气中不仅包括水解形成的氢气和水蒸气,还有乙硼烷(B2H6)等其他气体,但这些气体含量不超过0.05%,可以忽略对气泡水动力学特性的影响。
气体乳状液中相分布的结构和特征对相间作用过程的流动特性有影响。两相流结构特征影响一些特性,如水动力学压力损失、相间力学作用造成的能量损失等。此外,两相流结构也会影响两相流中的扰动分布。
显然,制氢器反应区中的气相离散度很高,这是由溶液中硼氢化钠浓度分布不均匀、催化剂颗粒在反应区容积内分布的不均匀和流动水动力学特征不均匀引起。对于2组分流,实际研究中常常使用均一化对数形式的离散分布函数描述。
对于制氢反应器的计算,必须考虑到硼氢化钠溶液中大量气泡相互作用的影响。难以获得描述方程的精确解,因为不知道液体中气泡的实际分布情况及其速度。在这种情况下,可以使用单元体积平均方法描述相的运动。在单元体积内包含有足够多的离散组分,但是与在线性尺度上考虑的平均流动特征时相比,单元体积的尺度要小。
7 制氢器反应区体积和换热-冷凝器传热面积
制氢器反应区体积是非常重要的参数,该参数决定了制氢器的整体尺寸。制氢器反应区体积应足够大,能保证在给定产氢量下水解反应的进行。制氢器反应区体积可根据反应器不间断工作情况下的质量平衡方程确定。
实际工作条件下,硼氢化钠水解化学反应速度比实验室条件下要低2倍左右,这是因为实际工作条件下水解过程的压力增大。在异质催化剂作用下,催化剂表面进行的水解化学反应速度对反应区压力的依赖要低些。硼氢化钠水解过程化学反应速度由反应物质在催化剂表面进入和离开的速度决定。由于水解反应形成氢气,因此水解反应速度也由氢气泡增长速度和氢气泡脱离频率决定,也即由水解过程的水动力学特性决定。
采用浸入在水位以下的流量孔板可以减少蒸汽发生器中自蒸发表面带走的液滴。一体式制氢反应器也可以使用同样的流量孔板,但需实验验证,因为对于溶液中含有表面活化剂的情况,流量孔板可能会在溶液液面上形成泡沫。
计算换热-冷凝器传热面积,必须知道换热器进口处蒸汽-氢气混合物和换热器出口处氢气间的温差。无催化剂的制氢器工作时,蒸汽-氢气混合物的温度为473 K。根据干燥器和燃料单元的工作条件,制氢器出口处氢气温度一般不超过313 K。取决于制氢器反应区温度,氢气中水蒸气含量会有所不同。
在不同温度下,制氢器反应区中的传热条件会大不相同。当反应区中温度不太高时,如低于380 K,从蒸汽-氢气混合物向换热器表面的放热可用通常的气体换热公式计算。在较高的反应区温度下,应考虑不凝气体(氢气)影响。蒸汽中存在不凝气体会减小穿过传热管道上凝结物薄层的热流密度,并降低从蒸汽向传热管壁的放热系数。
8 制氢器内液滴的分离、固体颗粒的沉淀和悬浮物的过滤
为分离出氢气中含有的液滴,流出换热-冷凝器后的湿润氢气要进入分离设备,一般采用旋风式分离器(见图5)。旋风式分离器中存在着两级分离。第一级是离心式分离,第二级是沉淀式分离。流出换热器的湿润氢气首先沿切向流道进入旋风式分离器,沿流道旋转流动,气流中液滴被向外抛出,氢气留在旋风中央。由于自中心向外部的离心力作用,氢气湿度增大。为使氢气速度分布均匀,降低旋风上部空间氢气的含湿量,安设有折板式分离器。
自制氢器反应区排出的反应产物(金属硼化物)中包含有弥散状分布的蒸汽-氢气气泡和催化剂颗粒。经过制氢器后,反应产物中未完全反应的硼氢化钠质量百分比为0.5%。为防止向周围介质中排放催化剂颗粒和未分解的硼氢化钠,在制氢系统中需安装过滤-沉淀器(见图6)。过滤-沉淀器为圆柱状,内部布置有过滤单元。反应产物通过位于壳体内圆柱状腔室下部的喷嘴进入过滤-沉淀器,流经过滤单元,然后由过滤-沉淀器上部空间的喷嘴排出。
过滤-沉淀器和制氢器一样,也可作为制氢系统启动前的预热器。使用过滤-沉淀器预热,对于反应产物中剩余硼氢化钠的水解是必须的。

选择过滤-沉淀器体积时,要基于硼氢化钠实现完全水解和催化剂部分颗粒沉淀的条件。实际过程中,发生的是催化剂颗粒的受限沉淀。在这种情况下,阻力将要比单个颗粒沉淀的情况下大些,这是由固体颗粒之间发生碰撞造成的。如果固体颗粒的体积浓度较大,边界层厚度将大于单个颗粒之间的距离。在较大体积浓度下,固体颗粒之间将会相互作用。
为悬浮液分离选择可靠的过滤器问题很复杂,目前主要依靠实验方法。曾使用过带有6个管状过滤单元的过滤-沉淀器。管状过滤单元由烧结金属微小颗粒压紧组成。这种结构形式的过滤单元发生过堵塞现象,且初始阶段过滤能力不足。后来替换成滤网。如果不使用过滤器,则制得氢气中含有大量黑色CoB颗粒,这是由于过滤-沉淀器沉淀性能不强造成的。
过滤过程主要用过滤速度表征。低于此速度时,单位时间内流过单位过滤隔板表面积的过滤液体积将会增大。过滤液的流动阻力包括沉淀层阻力和过滤隔板阻力。过滤隔板阻力由隔板结构形式决定,过滤过程中一般保持不变。沉淀层阻力随沉淀层厚度的增大而增大。过滤过程中,过滤液流经沉淀层和过滤隔板。开始时,过滤液速度最大,而过滤总阻力最小。过滤液速度增大可能会造成过滤隔板较快就被堵塞,并造成隔板阻力的快速增大。初始沉淀层的形成特点对整个沉淀层结构有很大影响。
9 硼氢化钠水解制氢器的动态特性
硼氢化钠水解反应制氢器管道内进行蒸汽-气体分解反应时,可能会在水力特性不变的稳定流动管段产生流动振荡(动力学)不稳定性。这种情况下的流动振荡是由滞后效应和反向作用过程在流动参数(速度、压力、密度、焓及其分布)间的动力学相互作用引起的。管式氢反应器中的流量振荡可由氢气管道上阀门的开启或关闭引起的压力波触发。
流自平行流道的制氢器出口处的气体质量百分比不高,流动不稳定特性具有特殊性。在小出口气体质量百分比下,流动振荡主要对于垂直布置的流道,在具有相对不高的载热剂流速下是重要的,这时流量扰动引起的压降扰动主要由重力效应决定。在这种情况下,能观察到流道入口和出口处的流量变化呈现出同相特征,振荡形式不具有足够明显的周期性谐波特征,振荡周期不等于有蒸汽形成流道的液相部分通过时间。
流动密度和速度沿流道高度方向上变化很大。在流道入口处密度达到最大值,而速度最大值在流道出口处达到。流道入口处即使很小扰动也会影响所有流动参数的变化,但是有些参数如速度,在流道中具有单一相态的部分实际上呈阶跃变化,同时其他参数,如流道出口处速度,明显地存在着相变化滞后的情况,这是由形成的两相流动振荡造成的。在流道间存在流量波动时,单个管道入口处流量的增大将会造成其他流道中流量的减小,并使液相和气相收集箱中的压力实际上保持基本不变。
制氢器中流道间的流量波动不会造成制氢系统回路中总流量改变,但在单个管道中,流量可能较大,主要体现在流量波动幅值会较大,这将造成来自反应区出口处未反应的硼氢化钠浓度增大。氢反应器管道中的流量波动都是低频脉动,属于动力学不稳定性,与滞后效应有关,并且与流量、密度和压降之间存在着的反向关联有关。要消除管道中的流量波动,必须要提高单相流动节段的流动阻力,这可通过在每个平行管道入口处安装流量孔板实现。要指出的是,这种消除制氢器管道中流量波动的方法不会在应用中见到实效,因为在非常低的管道流速情况下,振荡过程发展的主要原因是重力效应,而重力效应与流动速度无关。
对于管式制氢反应器,由于波动时的质量速度大于稳定状态下的质量速度,循环被破坏现象有可能发生。对于一体式制氢反应器,由于波动数值相对小得多,循环即使被破坏,时间也不会持续太久。蒸汽-气体乳状液中的压力波动幅值可能很大,会引起制氢器反应区管道中的流动振荡。另外,氢气管道上自动阀门的开启或关闭引起的扰动也会造成制氢器反应区管道中出现两相流动波动。
10 结语
硼氢化钠的碱性水溶液是制取氢气的方便载体。1 kg硼氢化钠水解反应可以分解出212 g氢气。与高压气瓶储氢相比,可将储氢系统能量密度增大2倍。对于排水量不大的潜艇,如使用硼氢化钠水解制氢,潜艇水下续航力可以增加近60%。硼氢化钠以水溶液形式储存,可以提高火灾爆炸安全性、改善潜艇生活环境。为避免硼氢化钠充分水解所需的蒸馏水不足,可以考虑使用海水造水。硼氢化钠溶液储存的缺点是氢产量占所装载硼氢化钠溶液的质量百分比不高,每kg反应物的产氢率很低。
总的说来,硼氢化钠水解制氢是一种安全、高效、实用性强的制氢方案。硼氢化钠水解制氢过程涉及到复杂的物理化学现象,还需对系统单个设备或部件及其运行进行大量的理论分析、数值计算和实验研究。
[1]BROWN W G, KAPLAN L, WILZBACH K E.The exchange of hydrogen gas with lithium sodium borohydride[J].J.Am.Chem.Soc.,1952,72:1289 -1305.
[2]SCHLESINGER H I,BROWN H C,FINHOLT A E,et al.Sodium borohydride,its hydrolysis and its use as a reducing agent and in the generation of hydrogen[J].J.Am.Chem.Soc.,1953,75:215 -218.
[3]HYDE E K, HOEKSTAHR, SHAEFFERGW.SCHLESINGER H I.Some properties of aqueous solution of sodium and lithium borohydride[J].Div.Phys.In org.Chem.,1964,110:24 -27.
[4]SCHLESINGER H I,BROWN H C,HOEKSTA H R.Reaction of diborane with alkali metal hydride and their addition compounds.New synthess of borohydride.Sodium and potassium borohydride[J].J.Am.Chem.Soc.,1953,75:199-204.
[5]KREEVOY M M, JACOBSON R W.Therateof decomposition of NaBH4in basic aqueous solutions[J].Ventron Alembic,1979,15(2):2-3.
[6]LEVY A,BROWN J B,LYONS C J.Catalyzed hydrolysis of sodium borohydride[J].J.Am.Chem.Soc.,1960,(3):325-336.
[7]BROWN H C,BROWN C A.New highly active metal catalysts for the hydrolysis of borohydride[J].J.Am.Chem.Soc.,1962,(8):112 -120.
[8]STEVEN C A,STEFANIE L S,JANJUA M S.A safe,portable,hydrogen gas generator using aqueous borohydride solution and Ru catalyst[J].J.Am.Chem.Soc.,2000,(10):526-535.
[9]AMENDOLA S C,SHARP-GOLDMAN S L,JANJUA M S.An ultrasafe hydrogen generator:aqueous, alkaline borohydride solutions and Ru catalyst[J].J.Am.Chem.Soc.,2000,(5):1125 -1131.
[10]YOSHITSUGU K,KEN-INCHIROU S,KAOZUHIRO F.Hydrogen generation using sodium borohydride solution and metal coated on metal catalyst oxide[J].J.Am.Chem.Soc.,2002,(10):234-240.
[11]DONG H,YANG H,AI X.Hydrogen production from catalytic hydrolysis of sodium borohydride solution using nickel boride catalyst[J].J.Am.Chem.Soc.,2003,(10):511-516.
[12]А.Н.Дядик,В.В.Замуков,В.А.Дядик.Корабельные воздухонезависимые энергетические установки[M].СПб:Судостроение,2006.
[13]BANKOFF S.G.Entrapment of gas in the spreading of liquid over a rough sueface[J].Aiche.J.,1958,(1):24-27.
[14]Годнев И.Н.,Краснов К.С.,Воробъев Н.И.и др.Физическая химия: Учебн.пособие для хим.техн.спец.вузов[M].М.:высш.шк.,1982.
Research and development of foreign submarine sodium borohydride hydrolysis hydrogen generation
LI Hong-wei,LI Da-peng,ZHANG Xiao-dong
(Naval Engineering University,Wuhan 430033,China)
Research and development of foreign submarine AIP sodium borohydride hydrolysis hydrogen generation is stated in this paper.Method and catalyzer of sodium borohydride hydrolysis hydrogen generation are introduced.Submarine system of sodium borohydride hydrolysis hydrogen generation,constitution and working of tubular and integrative reactors of sodium borohydride hydrolysis hydrogen generation are described.Two-phase flow phenomena,requirements of reactor volume and heat-transfer surface of heat-exchanger-condenser,separation of liquid dribbles,precipitin of solid grains and filtration of suspending particles in the hydrogen generator,as well as dynamic characteristic of hydrogen generator are analyzed.
submarine;AIP;sodium borohydride;hydrolysis hydrogen generation
U664
A
1672-7649(2012)07-0135-09
10.3404/j.issn.1672-7649.2012.07.031
2011-06-20;
2011-12-30
李宏伟(1974-),男,硕士,高级工程师,主要从事动力装置方面的科研与维修工作。

