4株何首乌根部土壤真菌产纤维素酶活性的研究
马雅鸽 赵荣华 赵声兰
云南中医学院,云南 昆明 650000
何首乌作为珍贵药用植物始载于《开宝本草》,为寥科植物何首乌Polygonum multiflorum thumb.的干燥块根。近年来已有大量科学研究证明,何首乌中结合型蒽醌衍生物能刺激肠道引起肠道充血性炎症,导致恶心、呕吐、腹痛、腹泻等不良反应[1]。而结合型蒽醌衍生物大多是以糖苷键结合的化合物[1,2],纤维素酶有水解糖苷键的作用[3]。本课题组从何首乌根部土壤筛选真菌,对何首乌进行固体发酵,找到了4株对结合型蒽醌类分解能力较强的真菌菌株。因此,本文对这4株真菌产生的纤维素酶进行研究。
1 材料和方法
1.1 菌株来源 YZ3.66、YZ3.57、YZ3.23、YZ3.41从云南中医学院关上校区种植何首乌的根部土壤及禄劝县种植何首乌的根部土壤分离获得。
1.2 DNS法测定纤维素酶活力
1.2.1 高产纤维素酶菌株发酵液的制备[3]选取菌株制备孢子悬液:纯化的真菌菌株在PDA斜面培养基上活化7d后,在斜面培养菌种试管中加入0.9%无菌氯化钠溶液3~5m l,再将少许灭菌棉花塞进试管,用吸管将其推进试管,借助棉花将孢子推入试管下部,然后将孢子液吸出,制成孢子悬浮液,在光学显微镜下用红血球计数板计数,得到终浓度为1×106CFU/ml的孢子悬液,取100μl接种于灭菌的150m l液体PDF培养基,28℃、110r/min振荡培养液体发酵,24h后每间隔12h吸取发酵液测定不同培养时间下酶活力,直至168h后检测完毕。
1.2.2 葡萄糖标准曲线的绘制[3、4]准确称量1.0000g去水恒重的葡萄糖,用适量蒸馏水溶解转移至500m l容量瓶定容,得浓度为2mg/ml的葡萄糖标准溶液,置于4℃保存。取25ml刻度试管并编号,按表1顺序加入葡萄糖标准液、水及DNS试剂,上述试剂混匀后,在沸水浴中准确反应5min进行显色,然后以冷流水迅速冷却,蒸馏水定容至25 m l,摇匀。以空白调零在UV-4802H型紫外可见分光光度计测定各反应体系在540nm处的吸光值。以葡萄糖含量(mg)为横坐标,吸光值OD540为纵坐标,绘制标准曲线,求得该曲线的回归方程。

表1 葡萄糖标准溶液配方
1.2.3 样品纤维素酶活力的测定[5]取25ml刻度试管置于50℃的恒温水浴中。吸取一定稀释度的酶溶液0.5ml加入试管中,然后再分别加入已经预热到50℃的0.5m l柠檬酸-柠檬酸钠缓冲液和0.5ml2%的CMC溶液。另取一支25ml刻度试管,在其中加一定稀释度的酶溶液0.5ml,经沸水浴灭活,再加0.5m l2%CMC溶液和0.5m l缓冲液作空白。将两试管一起50℃恒温30min后,沸水终止反应,摇匀吸取上清液0.5m l放入试管中,在各试管中分别加入3mlDNS。然后,将两试管同时置于沸水浴中显色5min,冷却至室温,分别用蒸馏水定容至25m l,摇匀。反复振荡试管,静置约20min,取每个试管中的上清液在540nm波长下测定吸光度A值。
反应生成的葡萄糖的量根据葡萄糖标准曲线求得。纤维素酶活力的按照下式计算:

一个CMC酶活力单位定义为每分钟生成1μmol葡萄糖所需的酶量,单位:IU/m l。
1.2.4 方法学考察[6](1)精密度试验 精密度是指用特定的分析程序在受控条件下重复分析同一样品所得测定值的一致程度,它反映分析方法或测量系统所存在随机误差的大小。极差、平均偏差、相对平均偏差、标准偏差和相对标准偏差都可用来表示精密度大小,较常用的是标准偏差或相对标准偏差。
4个菌株样品分别取一定的量,进行纤维素酶活测定。将同一样品连续测定六次,计算其葡萄糖含量的标准偏差(S)和相对标准偏差 (RSD/%)。
(2)样品的加标回收率试验 加标回收率即在样品中加入标准物质,测定其回收率,以确定准确度,多次回收试验还可发现方法的系统误差,这是目前常用而方便的方法,其计算式是:回收率=(加标试样测定值—试样测定值)/加标量·100%
取一定量的样品溶液,加入不同量的葡萄糖标准品溶液,测其吸光值,并计算葡萄糖浓度,然后计算标准品的回收率。
(3)样品中纤维素酶含量的计算 根据重复测定时所得试验值,4株真菌样品中的纤维素酶的含量。
2 结果与分析
2.1 葡萄糖标准曲线
2.2 精密度试验结果 分别吸取培养120h的4个样品稀释后的溶液0.50ml,进行精密度试验,结果如表2所示。
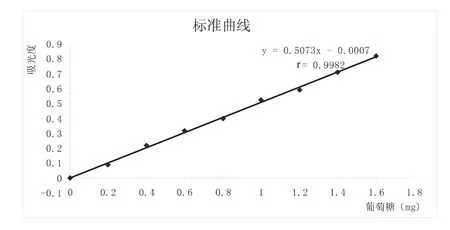
图1 葡萄糖标准曲线图

表2 样品的精密度试验结果
由表2可以看出,4个样品的精密度试验中,YZ3.66相对标准偏差为1.3912%,YZ3.57相对标准偏差为1.0891%,YZ3.23相对标准偏差为1.04%,YZ3.41相对标准偏差为2.4957。精密度试验考察的是一组测量数据间的接近程度,数据之间的相对标准偏差越小,说明测量结果越精确。4个样品的精密度数值都在在误差允许范围5%以内,所以说结果是可信的。
2.3 样品的加标回收率试验 (准确性试验结果) 分别取培养168h的4株真菌稀释溶液不同的量,然后加入不同体积的2mg/ml葡萄糖标准溶液,进行测定。试验结果分别如表3、表4、表5、和表6所示。
由表3可以看出:YZ3.66样品的标准品回收率平均值为100.3%,此次测定加标回收率在允许范围 (95~105%)内,因此可证实此试验结果的可靠性。
由表4可以看出:YZ3.57样品的标准品回收率平均值为99.9%,此次测定加标回收率也在允许范围 (95~105%)内,因此可证实此试验结果的可靠性。
由表5可以看出:YZ3.23样品的标准品回收率平均值为99.5%,此次测定加标回收率也在允许范围 (95~105%)内,因此可证实此试验结果的可靠性。
由表6可以看出:YZ3.41样品的标准品回收率平均值为100.1%,此次测定加标回收率也在允许范围 (95~105%)内,因此可证实此试验结果的可靠性。
2.4 四株真菌纤维素酶活的测定结果与讨论 四株真菌纤维素酶活的测定结果如表7所示。

表3 YZ3.66样品的加标回收率试验结果

表4 YZ3.57样品的加标回收率试验结果

表5 YZ3.23样品的加标回收率试验结果

表6 YZ3.41样品的加标回收率试验结果

表7 纤维素酶活力的测定结果

时间 (h) YZ3.66酶活 (IU/ml) YZ3.57酶活 (IU/ml) YZ3.23酶活 (IU/ml) YZ3.41酶活 (IU/ml)84 0.84 0.80 2.86 0.92 96 1.87 1.83 2.86 0.93 108 2.32 2.21 3.09 1.01 120 2.38 2.34 4.28 2.02 132 2.51 2.49 6.73 2.56 144 2.60 2.58 8.19 2.56 156 3.35 3.33 8.54 4.30 168 3.54 3.52 8.54 4.59
由表7可以看出:随着培养时间的增加,这四个菌株的产酶能力都在增加,YZ3.66和YZ3.57产酶的增长速度近似,最终的产酶能力也近似;YZ3.23产酶速度平稳,并且速度最快;YZ3.41前期产酶速度最慢,中后期加快。在同一培养时间内YZ3.23菌株产纤维素酶活性最大,YZ3.41菌株次之,YZ3.66菌株和YZ3.57菌株产纤维素酶活性接近并且最小。培养7天后,这4株真菌产纤维素酶活性分别为:YZ3.23=8.54IU/ml,YZ3.41=4.59IU/m l,YZ3.66=3.54IU/ml,YZ3.57=3.52IU/ml。
3 结论
本论文采用 DNS法对 YZ3.66、YZ3.57、YZ3.23、YZ3.41四株真菌的产纤维素酶进行性测定,对此方法进行了精密度和准确性的方法学考察,发现此方法准确可靠。经过7天培养,连续测定纤维素酶活力,发现这四株真菌都有产纤维素酶的能力,在同一培养时间内YZ3.23菌株产纤维素酶活性最大,YZ3.41菌株次之,YZ3.66菌株和YZ3.57菌株产纤维素酶活性接近并且最小。培养7天后,这4株真菌产纤维素酶活性分别为:YZ3.23=8.54IU/ml,YZ3.41= 4.59IU/ml, YZ3.66=3.54IU/ml, YZ3.57=3.52IU/ml。
[1]李铁建.不同蒸制时间制首乌对泻下作用的影响[D].延边:延边大学,2007,5-6.
[3] Zhang Ning.The screening of the Chitinase and Cellulase creation fungi and investigation of the activity of both the enyzymes[D].长春:Ji Ling University,2007,17-20.
[4] Lu Jiahua.Cellulase Enzymatic Treatment on Ceulosic Fiber[D].shanghai:Dong Huay University,2003,28 -29.
[5] Zhu Junjun.Immobilization ofβ -glucosidase and its improvement in cellulose enzymatic hydrolysis[D].Nanjing:Nanjing Forestry University,2006,17-18.
[6]国家药典委员会.中华人民共和国药典2010版 (一部) [M].北京:中国医药科技出版社,2010:附录130.

