Triton X-100对红细胞中抗去污剂膜蛋白拆离的影响
张敏妍 张 明
(1.中国人民解放军第四军医大学生物医学工程系 陕西 西安 710032;2.西安理工大学 陕西 西安 710048)
去污剂是一种能在水中形成微囊的双亲性小分子,这种微囊可以与脂双层发生相互作用形成磷脂和去污剂混合的微囊,或者是蛋白质、去污剂以及磷脂混合的微囊,它们是以磷脂—去污剂—蛋白质或者是去污剂—蛋白质混合物的形式存在于水溶液中[1]。非离子型去污剂Trtion X-100已经广泛地应用于不同的学科领域,人们对Trtion X-100与脂质、蛋白质之间的相互作用进行了研究,发现Trtion X-100促使了脂质混合物中脂筏结构的形成并且会诱使脂筏微区内的相态发生改变[2-3]。Trtion X-100作为阻断缓冲液时,它的疏水结构域的存在使得整合蛋白和膜的结合非常紧密,溶解下来的膜蛋白能够保持较强的活性,并且通过透析可以容易地除去去污剂,在脂筏拆离的实验[4]中它已经成为人们首选的非离子去污剂。我们对Triton X-100的浓度以及孵育液/膜溶液的体积比(Vi/Vm)进行了研究,得出了最佳的体积比、浓度。用原子力显微镜对蛋白含量最高组分进行了观察,鉴定出其蛋白质主要成分为脂筏蛋白。实验结果对于迅速、高效的分离脂筏蛋白质提供了一定的参考依据。
1 材料与方法
1.1 材料与仪器
血液样品由陕西省血液中心提供。Tris、TritonX-100、牛血清蛋白(BSA)购买于 Sigma公司,PMSF、考马斯亮蓝 G-250 购买于 Aldrich 公司,甘油、蔗糖、NaCl、NaH2PO4、Na2HPO4等其他试剂均为国产的分析纯。水为离子交换、二次蒸馏水。原子力显微镜,高速离心机,超速离心机,紫外分光光度计等。
1.2 实验方法
1.2.1 红细胞膜的制备
红细胞膜的制备按照文献[5]方法并做了适当的改进,取10mL新鲜A型血液置入含有肝素抗凝剂的离心管中,离心20min(870×g,4℃),移弃上层液及红细胞表层的绒毛状沉淀。红细胞用3倍量预冷的PBS等渗缓冲液 (150mM/L NaCl,5mM/L 磷酸盐,pH 7.4)重悬,离心 15min(2400×g,4℃),除去上清液及沉淀表层,重复洗涤3次。洗净的红细胞用4体积预冷的浓度为10mmol/L的Tris-HCl缓冲液(pH 7.4)重悬,4℃静置 2h,完全溶血。 离心 15min(7900×g,4℃),沉淀用浓度为10mmol/L的Tris-HCl缓冲液(pH 7.4)重悬,重复离心和重悬四次,直至得到乳白色的絮状沉淀,沉淀4℃储存。
1.2.2 脂筏成分的萃取
在4℃条件下,用PBS溶液对膜溶液进行孵育,然后与蔗糖溶液混合,蔗糖最终浓度为40%(m/v),取0.6mL混合液于离心管底部,依次铺置1.8mL 30%蔗糖溶液,1.2mL 5%蔗糖溶液,离心 18h(230,000×g,4℃),从上层开始以 400μL 为单元分别抽取分离的膜片段,共为9个组分,离心10min(15000×g,4℃),4℃储存。
1.2.3 蛋白质含量的测定
采用考马斯亮蓝染色法(Bradford法)测定蛋白质含量[6],配制浓度为1mg/mL的牛血清蛋白溶液为标准液,绘制标准曲线,然后对样品进行测定,由标准曲线计算得出1.2.2中离心得到的各组分中的蛋白质含量。
1.2.4 原子力显微镜的观察
将1.2.3中检测得出的蛋白含量最高的组分用去离子双蒸水稀释1000倍,取4μL滴在新剥离的云母片上,空气中干燥,样品被置于原子力显微镜上测试。
2 结果与讨论
2.1 孵育液/膜溶液的体积比的影响
孵育液 PBS(200μg/mL PMSF, 1%(v/v)Triton X-100)与膜溶液的体积比分别为 1:1、2:1、3:1,4℃静置 30min,然后重新与 PBS 溶液(60%(m/v)蔗糖,1.0%Triton X-100)混合,蔗糖最终浓度为40%,注射器抽提混合,离心,检测各组分中蛋白质含量,结果如图1所示。当Vi/Vm=3:1时第6组分的蛋白质含量最高;当Vi/Vm=4:1时蛋白质含量最大值出现在第7组分中,最大值的位置发生变化。由此可见,在萃取过程中存在着其他膜蛋白微量损失的现象,并且当孵育液/膜溶液的体积比值较大(Vi/Vm=4:1)时脂筏蛋白质存在的组分位置发生改变。

图1 在孵育液/膜溶液不同体积比时各组分蛋白质含量
2.2 Triton X-100的浓度的影响
孵育液 PBS (200μg/mL PMSF,0.5%、1.0%、2.0%Triton X-100) 与膜溶液的体积比为 3:1,4℃静置 30min, 重新与PBS(60%蔗糖,0.5%、1.0%、2.0%Triton X-100)溶液混合,蔗糖最终浓度为40%,注射器抽提混合,离心,检测各组分中蛋白质含量,结果如图2所示。蛋白质含量最高的组分出现在Triton X-100的浓度为1.0%时,当浓度为0.5%时蛋白质含量最大值明显小于其他两种条件下的含量,1.0%时的含量最大值约是0.5%时含量最大值的3倍。这说明随着去污剂浓度的增加,由抗去污剂拆离的去污剂—蛋白质的混合物出现一个最大值。浓度由1%变为2%时,蛋白质含量最大值的变化不大,这说明去污剂浓度达到一定值时,浓度的变化对萃取蛋白数量影响不大,所以萃取抗去污剂脂筏结构时,选择Triton X-100的浓度为1%为最佳值。
2.3 AFM观察
本实验中取100μL离心得到的蛋白质含量最高的组分,用去离子水稀释1000倍,吸取5μL稀释液滴于新剥离的云母片上,置于原子力显微镜上进行测试,结果如图3所示。由图3(A)可见,当脂筏成分稀释到一定倍数时以单个囊泡的形式存在于基片上,并且轮廓清晰,囊泡大小较为均一。图3(B)中显示的是(A)中囊泡的三维立体形貌,由图可见是一些分散的椭球状的囊泡,高度约为60nm左右,由此可以得出上述中的蛋白质含量最高的组分其中的蛋白质主要以脂筏蛋白的形式存在。
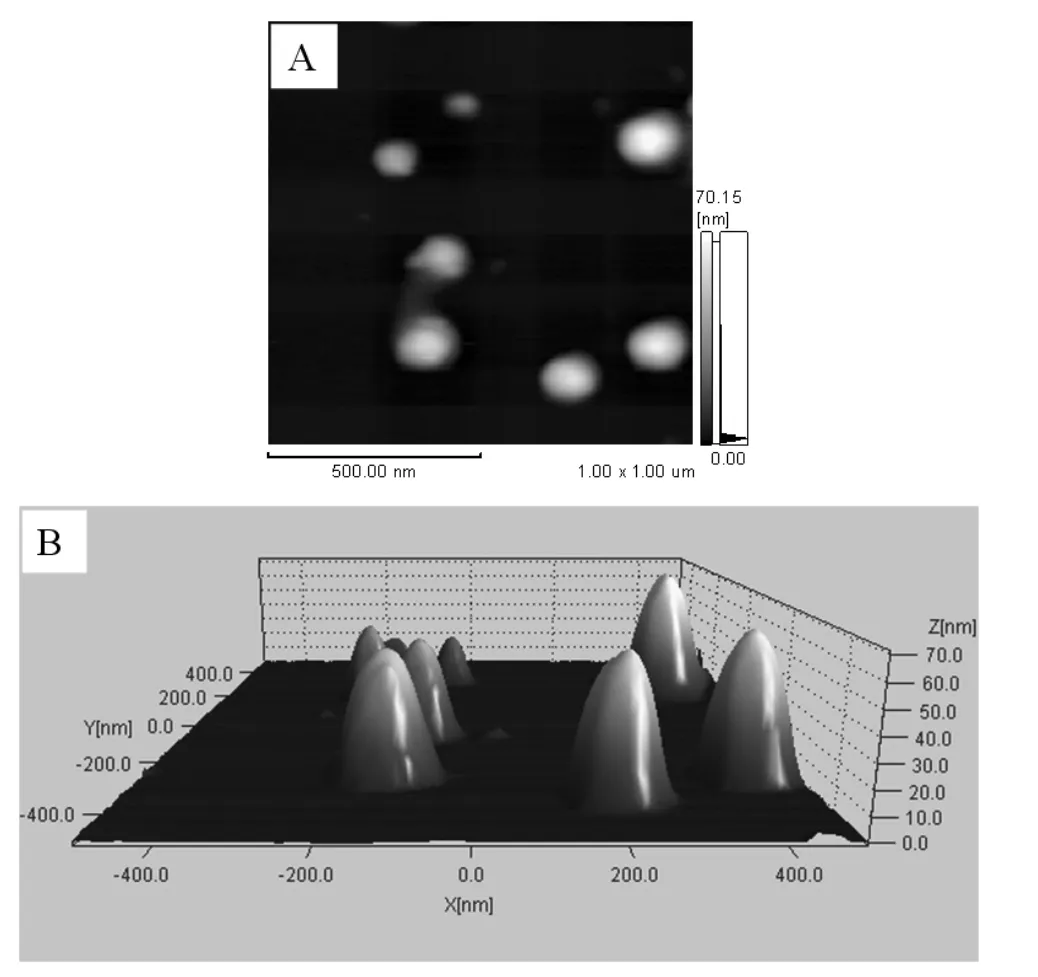
图3 抗去污剂膜片段稀释1000倍的原子力显微镜图像
3 结论
在抗去污剂膜蛋白拆离的过程中,孵育液/膜溶液的体积比、Triton X-100的浓度、孵育时间对不同组分中抗去污剂膜蛋白含量以及膜总蛋白平均的含量存在着不同的影响:(1)孵育液/膜溶液体积比值为3:1时,第6组分中的脂筏蛋白质含量最高,当体积比值较大时(Vi/Vm=4:1)脂筏蛋白质最高组分的位置发生变化(图1);(2)脂筏蛋白质的含量随Triton X-100浓度变化会出现一个最大值(图2),证实了Triton X-100浓度为1%时为最佳值。用原子力显微镜对蛋白质最高的组分进行观察,颗粒尺寸大小在50-100nm左右,从而证实了其主要成分为脂筏蛋白质。实验中较为详尽的研究了不同的因素对抗去污剂膜蛋白拆离的影响,得出了影响因素的最佳值,其实验结果对于迅速、高效的分离脂筏蛋白质提供了一定的参考依据。
[1]Zhang H M, Kurisu G J, Smith J L, Cramer W A.A defined protein-detergent-lipid complex for crystallization of integral mem brane proteins:The cytochrome b6f complex of oxygenic photosynthesis[J].Proc Natl Acad Sci USA,2003,100(9):5160-5163.
[2]张宏炜,孙逊,张志荣.载基因纳米脂质体的制备及有关性质的初步研究[J].四川大学学报:医学版,2006,37(2):298-300.
[3]Goñi F M, Urbaneja M A, Arrondo J L, Alonso A, Durrani A A,Chapman D.The interaction of phosphatidylcholine bilayers with Triton X-100[J].Eur J Biochem,1986,160:659-665.
[4]Schwab W, Galbiati F, Volonte D, Hempel U, Wenzel K W,Funk R H,Lisanti M P,Kasper M.Characterisation of caveolins from cartilage:expression of caveolin-1,-2 and-3 in chondrocytes and in alginate cell culture of the rat tibia[J].Histochem Cell Biol,112:41-49.
[5]Dodge J T, Mitchell C, Hanahan D J.The preparation and chemical characteristics of hemoglobin-free ghosts of human erythrocytes[J].Arch Biochem Biophys,1963,100:119-130.
[6]李琳,焦新之.应用蛋白染色剂考马斯蓝G-250测定蛋白质的方法[J].植物生理学通讯,1980,6:52-54.

