乌司他丁对脓毒症大鼠脏器保护的代谢组学研究
陈名智 林名瑞 肖雄箭 林建东
脓毒症是ICU的常见病,病死率高,据相关统计数据,在ICU感染病人中,30.8%有严重的脓毒症或脓毒症休克,病死率可达38.96%[1]。因此早期有效的诊断加及时的干预显得十分必要。脓毒症是由微生物感染引起的炎症性反应综合征,其引起代谢物的变化特别是血液中不饱和脂肪酸的浓度改变对病程发展起着重要的作用[2-3]。
乌司他丁(Ulinastatin,UTI)对脓毒症大鼠的脏器的保护的研究并不少见,无论是从常规临床生化指标,还是从基因水平上都有相应的研究,而在此方面代谢组学的研究尚未有相关的报道代谢组学作为继基因组学、转录组学和蛋白质组学之后的一门新兴学科,目前已广泛应用于各种临床疾病的研究,在临床医学领域具有广泛的应用前景。
本实验采用HPLC/MS对乌司他丁预处理的脓毒症大鼠代谢物主要是不饱和脂肪酸进行定性和定量分析,试图在代谢水平上对乌司他丁保护脓毒症患者脏器发生机制做一些初步探讨,同时HPLC/MS对脓毒症的早期诊断也有重要的意义。
1 资料与方法
1.1 动物模型制备与分组健康雄性Wistar大鼠30只[动物合格证号:SCXK(沪)2007-0005],体重(200±20)g(购自上海斯莱克实验动物有限公司)。随机等分成3组。乌司他丁组(UTI组)制模前1h肌注UTI(天普洛安,广东天普生化医药股份有限公司)10万U/kg,对照组和脓毒症组则分别肌注平衡液5mL/kg;UTI组和脓毒症组均按Otero等[4]介绍的CLP方法建立大鼠肠源性脓毒症模型。正常对照组则行开腹、关腹,但不予盲肠结扎穿孔。3组术毕均皮下注射平衡液50mL/kg以补充术中丢失的体液并抗休克治疗,术后正常饮食、自由饮水。
表1 已推定代谢物的MS裂解碎片及其在各组大鼠血清中的相对浓度(±s)
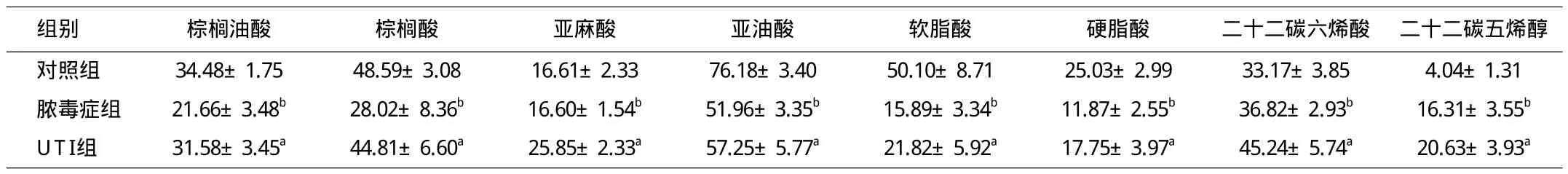
表1 已推定代谢物的MS裂解碎片及其在各组大鼠血清中的相对浓度(±s)
注:与对照组相比aP<0.05,与乌司他丁组相比bP<0.05
?
1.2 血液标本的采集于术后12h经尾静脉采血0.5mL,静置、离心后收集上清液,-80℃冻存,待行HPLC/MS分析。HPLC/MS分析前,取出冷冻标本,自然解冻后取血清200μL加至含乙腈400μL的1mL离心管中,充分振荡30s、静置10min后1000G离心5min,取上清液,经0.2μL注射器式滤器过滤后行HPLC/MS分析。
1.3 观察指标 Agilent-1100型分析仪(Agilent,MA,USA)进行HPLC/MS分析。高效液相色谱梯度洗脱程序、相关步骤、数据处理及标志物鉴定方法参照文献[3]的研究设计。
1.4 统计学方法 通过比较各组间差异有统计学意义的代谢物的关系来说明乌司他丁对脓毒症大鼠脏器的良好保护作用及HPLC/MS对脓毒症的早期诊断的重要意义。
2 结果
2.1 主成分分析(PCA)采用PCA方法对对照组、脓毒症组和乌司他丁预处理组的正、负离子模式下对血清样本的代谢谱数据进行模式识别。根据各组大鼠血清的总离子色谱图(total ion chromatograms,TIC),比较分析质荷比和保留时间,从每一样品中总共确认了787个谱峰。并通过ANOVA检验从其中找出差异有统计学意义(P<0.05)的155个谱峰。对HPLC/MS数据进行PCA后,可获得由第一、第二主成分构成包含了60%的总方差的PCA得分图(图1A)。该得分图提示,所有样品完全按照组别进行聚类,这表明基于HPLC/MS的代谢组学技术能很好地反映假手术组、脓毒症组和乌司他丁预处理组大鼠血清样品的代谢特征,并将其完全区分开来。
2.2 重要代谢物的鉴定和分析 从载荷图(图1B)圆外区域,12个组间差异具有统计学意义的代谢物可以认定。经数据库查找、QT-TOF LC/MS裂解碎片验证,8个代谢物被结构性推断,它们是亚麻酸、棕榈油酸、棕榈酸、软脂酸、亚油酸、硬脂酸、二十二碳六烯酸和二十二碳五烯醇;如表1所示,假手术组大鼠血清亚油酸、棕榈油酸、棕榈酸、软脂酸和硬脂酸水平最高,其次是UTI组,再次是脓毒症组。这表明,UTI预处理组与脓毒症组相比,血清中上述游离脂肪酸(free fatty acids,FFA)浓度明显升高,且差异具有显著意义(见表1)。这表明UTI预处理后,具有抗炎症、抗氧化作用的多不饱和脂肪酸血清水平明显增加,这可能改善脓毒症大鼠预后。
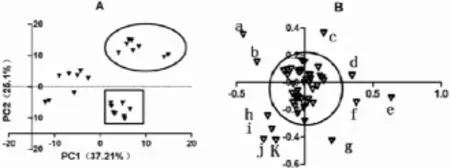
图1 A图:橄圆内为脓毒症组,正方形内为生存组,余为对照组。B图:圆形为Hotelling’s T2统计量阈值为变量,圆外的变量为组间差异有统计学意义的代谢物(P<0.05)。
2.3 疗效的判断 标志物信息构建的模型有其临床的参考价值,但利用所有代谢物信息构建的模型预测效能总体上会高一些,在方法上采用RBFNN构建的模型预测效能高于k-NN[3]。
3 讨论
脓毒症作为内、外科危重病人常见的病,常可发展为脓毒症性休克、多器官功能障碍综合征。在此种情况下往往存在机体高代谢和高消耗为主要特征的代谢紊乱,常表现为蛋白强噬性和自噬性的负氮平衡及组织对葡萄糖摄取和脂肪代谢障碍等代谢紊乱[5],对病情的发展起着重要的推进作用。本实验采用代谢组学方法来分析脓毒症时机体早期的代谢变化及乌司他丁是否对其表达起调节作用,以实现脓毒症的早期诊断以便及时干预,以延缓病情改善愈后。
3.1 乌司他丁对脓毒症的治疗作用 研究表明乌司他丁能抑制胰蛋白酶、α糜蛋白酶、透明质酸酶等多种水解酶的活性。结构上,UTI具有两个活性功能区,这种不完全重叠且有多种酶的独立结合位点决定了它的广谱抑酶活性,可同时抑制胰蛋白酶、α糜蛋白酶、磷脂酶A2、酸性蛋白酶、粒细胞弹性蛋白酶、羧基肽酶、巯基酶等多种水解酶的活性,且抑制效率高从而减轻水解酶对正常组织器官的伤害,一定程度上清除致炎因子,缓解炎症反应。同时有研究表明UTI对单核/巨噬细胞、中性粒细胞过度释放的炎症介质也有抑制作用[6]。此外研究还发现它能够抑制肺泡溶酶体酶及各种炎症因子产生,稳定溶酶体膜而保护肺脏,维持呼吸功能[7-9]。
3.2 建模时机 研究发现CLP术后12h,脓毒症大鼠血清代谢特征已发生明显改变,故本实验把血液标本采集时间点设在脓毒症大鼠建模后的12h[3]。
3.3 脓毒症患者脂类代谢的特异性 脓毒症患者机体处于高度的应激状态,代谢发生剧烈的变化:血糖升高、脂肪动员增强、蛋白质分解增强[10]。但脓毒症后,机体中游离脂肪酸(free fatty acids,FFA)却呈明显下降趋势[11]。游离脂肪酸主要参与氧化供能,比如亚油酸、棕榈酸、棕榈油酸、软脂酸和硬脂酸,且其降低程度与脓毒症预后呈负相关[3]。本试验中发现与对照组相比,经乌司他丁预组大鼠的游离脂肪酸明显高于脓毒症组,且趋向于接近对照组(P<0.05)。说明乌司他丁能有效的保护脓毒症患者,提高患者的血中不饱和脂肪酸的浓度,从而保证了患者机体的氧供。其机理可能为乌司他丁抑制了内毒素和炎症因子释放,降低了脂肪酸转运蛋白活性同时抑制FAT/CD36基因的表达,进而减少FFA被快速转运至肌肉或组织的机会[11],故乌司他丁组大鼠血中FFA总体水平下降不明显从而对脓毒症患者的能量代谢起改善作用。
近年来研究表明脓毒症时免疫系统的紊乱是促使病情发展的重要原因。在机体遭到强烈刺激时,补体C5a经旁路途径大量产生,使中性粒细胞功能下降,增加了感染的易感性。大量炎症介质释放,如TNF-α、IL-1、GM-CSF等[12],从而中性白细胞凋亡率下降,血中的中性白细胞数显著增加;由于粒细胞脱粒时释放髓过氧化物酶、弹性蛋白酶、蛋白酶氧自由基、纤溶酶原激活物等。这些代谢都可增加了自身机体组织的损坏。因此,在过度免疫的情况下一方面机体对致病菌的易感性增高,使炎症反应持续并加剧[13]。机体在感染和创伤刺激下,不仅释放促炎介质,同时也反馈性释放内源性抗炎介质(IL-4、IL-10、TGFβ),引起机体免疫抑制。然而研究表明ω-3多不饱和脂肪酸(ω-3 PUFAs)具有抗炎及免疫调节作用[14-15]。ω-3 PUFAs抗炎及免疫作用的主要机制是ω-3 PUFAs通过与花生四烯酸竞争代谢通路来抑制炎症细胞因子白介素-1β( I L-1β)和肿瘤坏死因子-α( T NF-α)的分泌,还能抑制 PGE2和LTB4的生成,减少白细胞的游走和渗出使炎症的消退组织修复加快[16-17]。同时ω-3 PUFAs作为细胞膜的组成成份可抑制脂筏信号转导通路而对免疫细胞起抑制作用。此外ω-3 PUFAs及其代谢产物也能影响免疫细胞活性的作用即抑制抗原呈递作用而抑制淋巴细胞激活及免疫分子表达等[18]。ω-3 PUFAs一族中药理功能明显的是亚麻酸和二十二碳六烯酸(docosahexaenoic acid,DHA)。而本实验中的UTI预处理组大鼠血液中的亚麻酸、DHA明显高于脓毒症组,从一定程度上可以说明UTI对机体的免疫调节有作用,可作为临床脓毒症患者的辅助治疗药物。
综上所述,脓毒症导致机体的代谢紊乱特别是与能量代谢相关的不饱和脂肪酸代谢的紊乱对其病程的发展起着重要的作用。经过UTI预处理脓毒症大鼠脂代谢的紊乱得到不同程度的纠正,表明UTI在一定程度上对脓毒症患者机体的脂代谢紊乱有改善作用,可缓解病情,争取治疗时间。
[1]Schuerholz T,Marx G. Management of sepsis[J]. Minerva anestesiologica, 2008,74(5):181-195.
[2]Leung B,Harris HW. NKT cells in sepsis[J]. Clinical and Developmental Immunology, 2010.
[3]孟海兵,许平波,许华,等.应用代谢组学技术早期预测脓毒症大鼠的预后[J].中华急诊医学杂志,2009,18(2):120-126.
[4]Otero-Anton E, Gonzalez-Quintela A, Lopez-Soto A, et al.Cecal ligation and puncture as a model of sepsis in the rat: Influence of the puncture size on mortality, bacteremia, endotoxemia and tumor necrosis factor alpha levels[J]. European surgical research, 2000,33(2):77-79.
[5]姚咏明,盛志勇,梁华平,等.脓毒症防治学[M].北京:科学技术文献出版社,2008:228-239
[6]Nakatani K, Takeshita S, Tsujimoto H, et al. Inhibitory effect of serine protease inhibitors on neutrophil-mediated endothelial cell injury[J].Journal of Leukocyte Biology, 2001,69(2):241-247.
[7]Kato Y, Kudo M, Shinkawa T, et al. Role of O-Linked Carbohydrate of Human Urinary Trypsin Inhibitor on Its Lysosomal Membrane-Stabilizing Property[J]. Biochemical and biophysical research communications,1998, 243(2): 377-383.
[8]Zaitsu M, Hamasaki Y, Tashiro K, et al. Ulinastatin, an elastase inhibitor, inhibits the increased mRNA expression of prostaglandin H2 synthase-type 2 in Kawasaki disease[J]. Journal of Infectious Diseases,2000,181(3): 1101-1109.
[9]Ito K, Mizutani A, Kira S, et al. Effect of Ulinastatin, a human urinary trypsin inhibitor, on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J]. Injury,2005,36(3):387-394.
[10]陈淼,戴李华,盛颖.脓毒症的三大物质代谢变化和营养支持原则[J],中华急诊医学杂志,2007,16(6):668-669.
[11]Carley AN, Kleinfeld AM. Kleinfeld. Fatty acid (FFA)transport in cardiomyocytes revealed by imaging unbound FFA is mediated by an FFA pump modulated by the CD36 protein[J]. Journal of Biological Chemistry, 2011,286(6):4589-4597.
[12]Howell G, Tisherman SA. Tisherman. Management of sepsis[J]. The Surgical clinics of North America, 2006,86(6):1523.
[13]盛志勇.脓毒症诊治新策[J].中国医疗前沿,2006,11(6):81-84.
[14]Mittal A, Ranganath V, Nichani A. Omega fatty acids and resolution of inflammation: A new twist in an old tale[J]. Journal of Indian Society of Periodontology, 2010, 14(1): 3-7.
[15]Makris GC, Geroulakos G, Makris MC, et al. The pleiotropic effects of statins and omega-3 fatty acids against sepsis: a new perspective[J]. Expert opinion on investigational drugs, 2010, 19(7): 809-814.
[16]臧俊猛.ω-3多不饱和脂肪酸的临床药理研究进展[J].科协论坛,2010(8):78-79.
[17]Bakker G, van Erk MJ, Pellis L, et al. An antiinflammatory dietary mix modulates inflammation and oxidative and metabolic stress in overweight men: a nutrigenomics approach[J]. The American journal of clinical nutrition, 2010, 91(4):1044-1059.
[18]高颐雄,张坚.ω-3多不饱和脂肪酸与免疫系统关系的研究进展[C].国外医学卫生学分册,2009,36(6):377-380.

