鸡大肠埃希菌I型菌毛pilA 基因的克隆与序列分析
王 东,张燕飞,蒲建明,丁林军,王建波,王旭青,刘军红,吴 燕,殷 东,扈登强
(1.宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021;2.吴忠市畜牧局,宁夏 吴忠 751100;3.银川市农业局,宁夏 银川 750001;4.宁夏大学外国语学院2009级英语师范专业,宁夏 银川 750021;5.宁夏博奥药业有限公司,宁夏 银川 750021)
大肠埃希菌是家禽最常见的病原菌之一,能引起家禽胚胎死亡、脐炎、败血症、肉芽肿、卵黄性腹膜炎和全眼球炎等一系列疾病,给养禽业造成严重的经济损失[1]。菌毛是鸡大肠埃希菌重要的致病因子,在致病菌侵入鸡体时起关键作用。鸡大肠埃希菌有二类菌毛,即I型及P型菌毛,二者均由染色体编码[2]。I型菌毛在禽大肠埃希菌感染过程中,可与禽呼吸道黏膜上皮细胞表面的相应受体以一种“钥匙-锁”的方式特异性结合,从而黏附在宿主的粘膜和上皮表面,借以抵抗机体的机械清除和胃肠黏膜的蠕动作用。结合后的大肠埃希菌不易被机体清除,很容易侵入呼吸道深部增殖,从而在致病过程中发挥重要作用[3]。I型菌毛具有良好的免疫原性,可诱导机体产生抗体,此抗体与入侵细菌菌毛结合,封闭菌毛上受体结合位点,阻断感染的第一个环节,从而防止禽大肠杆菌病的发生[4]。大肠埃希菌I型菌毛的编码基因位于染色体上,由pil及相关基因簇编码,其中pilA基因是编码I型菌毛主要结构亚单位(FimA)的基因[5],因此对I型菌毛pilA基因的研究对禽大肠杆菌病的诊断和防治工作具有重要意义。本研究根据鸡大肠埃希菌I型菌毛pilA基因序列,在其同源区设计并合成引物,采用PCR技术,从3株鸡大肠埃希菌地方分离菌株中分别扩增和克隆I型菌毛pilA基因,并对克隆片段进行序列测定和分析,为鸡大肠杆菌病的诊断和I型菌毛基因工程疫苗的研制提供基因材料和理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株 鸡大肠埃希菌25号菌株(O15)、57号菌株(O78)和58号菌株(O18),为宁夏地区优势血清型菌株[6],由宁夏大学西部特色生物资源保护与利用教育部重点实验室从宁夏地区发病鸡场分离并鉴定,均含有I型菌毛。受体菌DH5α为宝生物工程(大连)有限公司产品。
1.1.2 载体 PMD18-T Simple Vector为宝生物工程(大连)有限公司产品。
1.1.3 主要试剂与酶 胰蛋白胨和酵母提取物为OXOID公司产品;限制性核酸内切酶NcoⅠ、EcoRⅠ为Fermantas公司产品;T4DNA连接酶为Promerga公司产品;细菌基因组DNA提取试剂盒、2×Taq Platinum PCR Master Mix、普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒均为天根生化科技(北京)有限公司产品。
1.2 方法
1.2.1 鸡大肠埃希菌基因组DNA的提取 参照天根生化科技(北京)有限公司细菌基因组DNA提取试剂盒说明书进行。
1.2.2 引物设计与合成 参考GenBank公布的鸡大肠埃希菌I型菌毛pilA基因序列,用Primer Premier 5.0软件设计一对引物,加酶切位点和保护性碱基。上游引物为:5′-CATGCCATGGATGAAAATTAAAACTC-3′(划线部分为Nco Ⅰ 酶切位点);下游引物为:5′-CCGGAATTCTTATT-GATACTGAACC-3′(划线部分为EcoRⅠ酶切位点)。引物由上海生工生物工程技术服务有限公司合成。
1.2.3 PCR扩增 以提取的3株鸡大肠埃希菌地方分离菌株基因组DNA为模板,利用合成的引物进行I型菌毛pilA基因的PCR扩增。PCR反应体系为50μL(DNA模板1μL,上游引物1μL,下游引物1μL,2×Taq Master Mix 25μL,灭菌超纯水22 μL)。PCR扩增条件:94℃3min;94℃1min,55℃30s,72℃30s,循环30次;72℃5min。以12g/L琼脂糖凝胶电泳分析PCR产物[7]。
1.2.4 PCR产物的凝胶电泳回收 参照天根生化科技(北京)有限公司普通琼脂糖凝胶DNA回收试剂盒说明书进行。
1.2.5 PCR产物与克隆载体的连接 参照宝生物工程(大连)有限公司pMD18-T-simple Vector说明书,将pilA基因的PCR回收产物与pMD18-T-simple载体在4℃条件下连接16h。
1.2.6 感受态细胞的制备 参照文献[8]介绍的CaCl2法制备感受态细胞。
1.2.7 重组质粒的转化和筛选 将10μL连接物加入200μL感受态细胞中,混匀,冰浴30min,42℃热激90s,冰浴1min;加入500μL SOB液体培养基,37℃摇振培养1h;吸取100μL培养液涂布于加有适量Amp、X-gal及IPTG的LB平板上,37℃培养12h~16h;挑选白色菌落,接种含Amp的LB培养液,37℃摇振培养16h。
1.2.8 质粒DNA提取 参照天根生化科技(北京)有限公司质粒小提试剂盒说明书进行。
1.2.9 重组质粒的鉴定 以提取的质粒DNA为模板,进行PCR,阳性质粒用限制性核酸内切酶NcoⅠ、EcoRⅠ进行双酶切,酶切产物用15g/L琼脂糖凝胶电泳分析。
1.2.10 序列测定及分析 取PCR鉴定和酶切鉴定均为阳性的重组质粒,送上海生工生物工程技术服务有限公司进行序列测定;测序结果用DNA Man和DNA Star等生物软件进行核苷酸和氨基酸的同源性分析,绘制进化树;并对菌毛蛋白的抗原位点和抗原表位进行预测。
2 结果
2.1 1型菌毛pilA基因的PCR扩增
以提取的3株鸡大肠埃希菌地方分离菌株基因组DNA为模板,利用合成的特异性引物,从鸡大肠埃希菌25号菌株、57号菌株、58号菌株中分别扩增出大小约为574bp的基因片段(图1),与预期结果一致。

图1 鸡大肠埃希菌pilA基因PCR扩增结果Fig.1 PCR products of pilAgene from avian E.coli
2.2 重组质粒pMD18-T-pilA 的鉴定
将PCR产物回收纯化后连接pMD18-T-simple载体,转化宿主菌DH5α感受态细胞,涂布平板后挑取白色菌落,接种含Amp的LB培养液,37℃摇振培养16h后提取质粒,进行重组质粒pMD18-T-pilA的PCR鉴定。选择PCR反应为阳性的质粒,再用限制性核酸内切酶NcoⅠ、EcoRⅠ进行双酶切,电泳分析后发现,重组质粒pMD18-T-pilA显示两个条带,一条大小与574bp的目的基因条带相近,另一条则与2.7 kb的pMD18-T克隆载体条带大小相近(图2),说明得到含I型菌毛pilA基因的阳性克隆。

图2 重组质粒pMD18-T-pilA的酶切鉴定Fig.2 The identification of recombinant plasmid by restriction enzyme digestion
2.3 序列测定及分析
2.3.1 pilA基因的序列测定 挑选经PCR鉴定和酶切鉴定均为阳性的重组质粒,送上海生工生物工程技术服务有限公司进行序列测定。根据测序报告,3个克隆片段全长均为574bp,其中包括I型菌毛pilA基因全序列及完整的开放性阅读框架(ORF),片段大小为549bp,编码信号肽和结构蛋白,说明本试验所克隆的3株外源DNA为鸡大肠埃希菌I型菌毛pilA基因。
2.3.2 pilA基因的同源性分析 利用DNA Man和DNA Star等生物软件将本试验得到的序列与GenBank中已公布的鸡大肠埃希菌I型菌毛pilA基因进行同源性分析。由图3和图4看出,3株鸡大肠埃希菌分离菌株pilA基因与其他菌株的核苷酸同源性为87.25%~98.36%,氨基酸同源性为87.36%~98.35%;3株鸡大肠埃希菌分离菌株pilA基因之间的核苷酸同源性为91.44%~96.72%,氨基酸同源性为92.86%~97.80%。
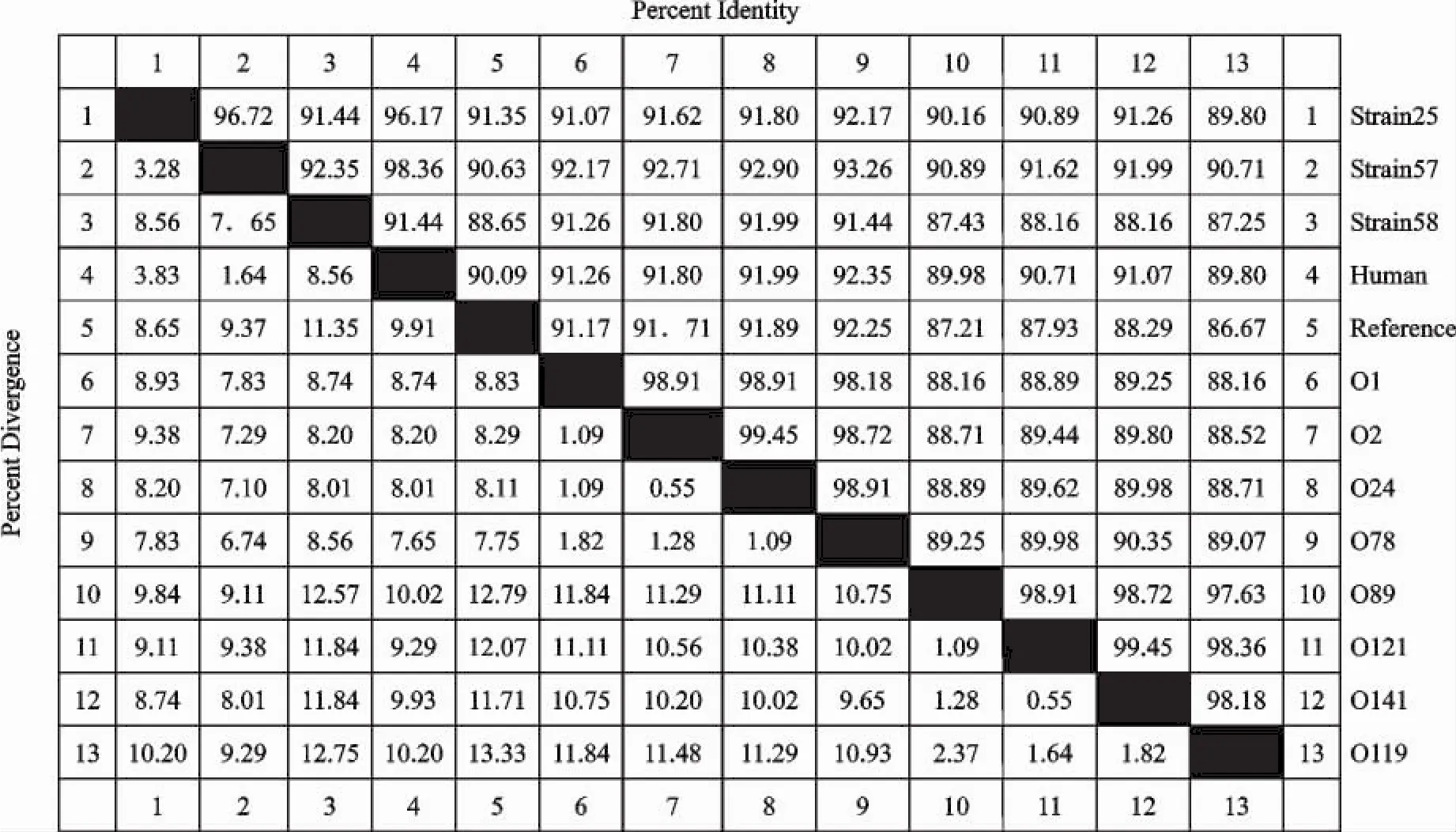
图3 鸡大肠埃希菌pilA基因核苷酸同源性分析Fig.3 The nucleotide homology analysis of E.coli pilAgene from different strains
2.3.3 pilA基因的系统进化树 将13株不同来源的大肠埃希菌pilA基因序列进行聚类分析,绘制系统进化树(图5)。
由图5可知,3株鸡大肠埃希菌分离菌株中58号菌株与其他菌株的亲缘关系较远;25号菌株与57号菌株的亲缘关系较近;不同宿主来源的菌株可以位于相同的分支,如鸡源大肠埃希菌57号菌株与人源大肠埃希菌的亲缘关系较近;不同血清型菌株的亲缘关系可以较近,如O1、O2、O24、O78位于同一分支;相同血清型菌株的亲缘关系可以较远,如57号菌株(血清型为O78)与O78位于位于不同分支。
2.3.4 鸡大肠埃希菌菌毛蛋白抗原位点和抗原表位分析 应用DNAStar生物软件,预测3株鸡大肠埃希菌分离菌株菌毛蛋白的抗原位点和抗原表位,结果见表1和图6。
由表1和图6看出,3株不同血清型的鸡大肠埃希菌分离菌株菌毛蛋白的抗原位点和抗原表位存在较大的相似性,但也有一定的差异,如25号菌株菌毛蛋白有6个主要抗原位点,与57号菌株和58号菌株相比,缺少1个抗原位点(100位~110位);57号菌株和58号菌株都有7个主要抗原位点,但在部分抗原位点上存在抗原峰值的差异。

图4 鸡大肠埃希菌PilA蛋白氨基酸同源性分析Fig.4 The amino acide homology analysis of E.coli PilAprotein from different strains
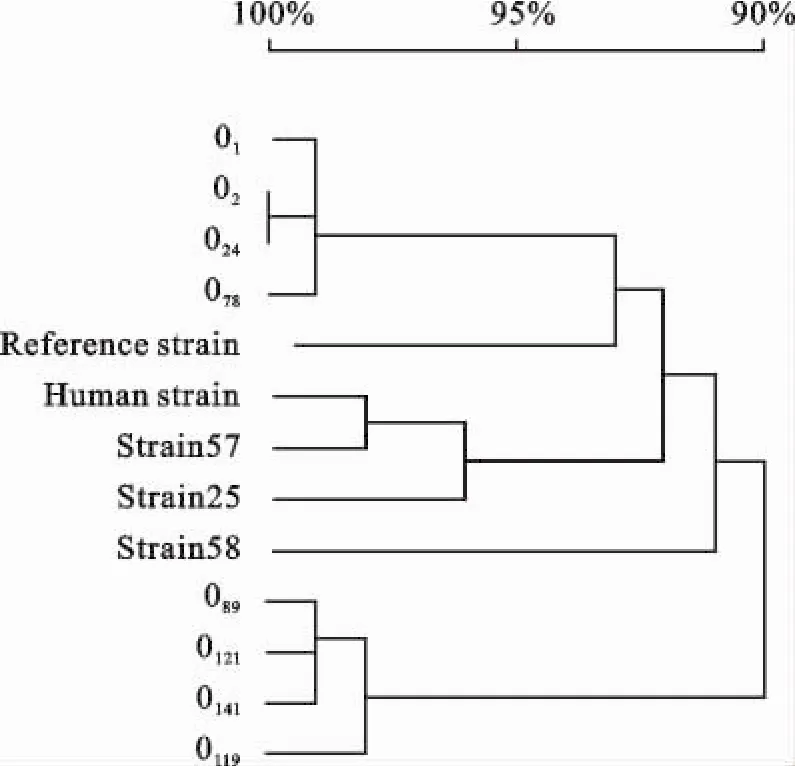
图5 鸡大肠埃希菌pilA基因系统进化树Fig.5 The phylogenetic tree of avian E.coli pilAgene

表1 鸡大肠埃希菌菌毛蛋白抗原位点分析Table1 The analysis of antigenic sites of type I pili proteins from avian E.coli

图6 鸡大肠埃希菌菌毛蛋白抗原表位分析Fig.6 The epitope analysis of type I pili protein from avian E.coli
3 讨论
大肠埃希菌I型菌毛的编码基因位于染色体上,由pil及相关基因簇编码,其中pilA基因是编码I型菌毛主要结构亚单位(FimA)的基因[5]。分析已发表的鸡大肠埃希菌I型菌毛pilA基因,在保守区设计引物,对3株鸡大肠埃希菌分离株pilA基因进行PCR扩增、回收、连接、转化等,将pilA基因连接到PMD18-T克隆载体上;通过PCR鉴定和酶切鉴定,得到574bp的克隆片段,其中包括I型菌毛pilA基因全序列及完整的开放性阅读框架(ORF),片段大小为549bp,编码信号肽和结构蛋白;基因序列分析表明,3株鸡大肠埃希菌分离菌株pilA基因与其他菌株的核苷酸同源性为87.25%~98.36%,氨基酸同源性为87.36%~98.35%,说明本试验成功克隆3株不同血清型鸡大肠埃希菌的I型菌毛pilA基因。
将13株不同来源的大肠埃希菌pilA基因序列进行聚类分析,绘制系统进化树,研究结果显示,虽然菌株的宿主来源不同,但亲缘关系可以相距较近,如鸡大肠埃希菌57号菌株与人源大肠埃希菌位于相同的分支,试验结果证实了Suwanichkul A等[9]关于“人大肠埃希菌与鸡大肠埃希菌I型菌毛源于同一祖先”的假说,与高崧等[10-11]报道相似。虽然菌株的血清型不同,但亲缘关系却较近,如O1、O2、O24、O78位于同一分支;菌株的血清型相同,但亲缘关系却较远,如57号菌株(血清型为O78)与O78位于不同分支,说明大肠埃希菌I型菌毛pilA基因的遗传相似性与菌株的宿主来源及血清型没有显著的相关性,与于小娜等[12-13]报道相似。
对克隆的3株鸡大肠埃希菌分离菌株I型菌毛pilA基因进行序列测定和分析,结果表明,3株鸡大肠埃希菌分离菌株pilA基因之间的核苷酸序列同源性为91.44%~96.72%,氨基酸序列同源性为92.86%~97.80%,说明3株鸡大肠埃希菌分离菌株I型菌毛pilA基因序列和氨基酸序列有较高的同源性。应用DNA Star生物软件,预测3株鸡大肠埃希菌分离菌株菌毛蛋白的抗原位点和抗原表位,结果显示,3株鸡大肠埃希菌I型菌毛间具有一定的结构相似性,并存在一定的共同抗原位点,如25号菌株和57号菌株的菌毛蛋白主要抗原位点都位于50~60,65~75,80~90,115~120,125~130,140~150位氨基酸;57号菌株和58号菌株的7个主要抗原位点基本相同或相似。本实验室已完成鸡大肠埃希菌天然I型菌毛亚单位疫苗的交叉保护性试验,证实鸡大肠埃希菌25号(O15)、57号(O78)和58号(O18)菌株之间存在一定的交叉保护作用,与隋兆峰等[14-15]报道相似。本研究从分子水平为不同血清型鸡大肠埃希菌I型菌毛间存在交叉保护作用的现象提供理论依据。
[1]卡尔尼克B W.禽病学[M].9版.高 福,苏敬良,译.北京:北京农业大学出版社,1991:126-132.
[2]Dozois C M,Fairbrother J M,Harel J,et al.Expression of pandtype I(FI)fimbriae in pathogenic Escherichia coil from poultry[J].Vet Microbiol,1995,45:297-309.
[3]Mellata M,Dho-Moulin M,Dozois C M.Role of avian pathogenic Escherichia coli virulence factors in bacterial interaction with chicken heterophils and macrophages[J].Infect Immun,2003,71(1):494-503.
[4]Gyimah J E,Panigrahy B.Immunogenicity of an oil-emulsified Escherichia coli(serorype O1)pili vaccine in chickens[J].Avian Dis,1985,29:1078-1083.
[5]Khmm P.The fimA gene encoding the type 1fimbrial subunit of Escherichia coli nucleotide sequence and primary structure of the protein[J].Eur J Biochem,1984,143(2):395-399.
[6]张燕飞,王 东,王玉炯,等.宁夏部分地区鸡大肠埃希菌的分离与血清型鉴定[J].动物医学进展,2012,33(5):119-121.
[7]戴鼎震,崔生玲,蒋加进,等.鸡大肠杆菌I型菌毛fimH蛋白结构基因克隆及序列测定[J].金陵科技学院学报,2011,27(4):69-74.
[8]薛茂云,蒋加进,陈钟鸣,等.鸡大肠杆菌I型菌毛基因簇E基因的克隆与序列测定[J].金陵科技学院学报,2010,26(4):67-72.
[9]Suwanichkul A,Panigraphy B.Antigenic relatedness and partial amino acid sequences of pili of Escherichia coli serotype O1,O2and O78pathogenic to poultry[J].Avian Dis,1987,31:809-813.
[10]高 崧,彭大新,吴晓东,等.禽源和猪源大肠杆菌I型菌毛主要亚单位抗原多样性分子基础的初步研究[J].动物医学进展,2003,24(1):69-73.
[11]戴鼎震,汤厚宽,郑明球,等.一株鸡大肠杆菌I型及P型菌毛蛋白结构基因的克隆[J].中国预防兽医学报,2000,22(4):281-284.
[12]于小娜,汪铭书,程安春,等.鸭源致病性大肠杆菌I型菌毛pilA基因序列测定及生物信息学分析[J].四川农业大学学报,2006,24(3):325-330.
[13]叶如俊,王红宁,谭炳乾.鸡源致病性大肠杆菌I型菌毛pilA基因的PCR扩增、克隆及序列分析[J].畜牧兽医学报,2004,35(1):83-88.
[14]隋兆峰,刘文强,范伟兴,等.鸡致病性大肠杆菌I型菌毛交叉保护性研究及其结构基因FimA的序列分析[J].中国预防兽医学报,2003,25(6):440-444.
[15]戴鼎震,郑明球,恽时锋.鸡大肠杆菌I型菌毛亚单位苗交叉保护的初步研究[J].畜牧与兽医,1999,31(5):1-2.

