猪瘟病毒E2基因在毕赤酵母中的表达
王启宇,兰邹然,姜 平,张 月,刘 娟
(1.南京农业大学动物医学院,江苏 南京 210095;2.山东省动物疫病预防与控制中心,山东 济南 250022;3.山东师范大学体育学院,山东 济南 250014)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒引起的猪的一种急性或慢性、热性和高度接触性传染病[1],临床主要以稽留高热、皮肤和黏膜出现大量出血点为特征。猪瘟病毒有C、Erns(E0)、E1和E2四种结构蛋白,其中E2蛋白是最主要的保护性抗原,能够刺激机体产生保护性抗体,并使机体抵抗致死量强毒的攻击;其基因总长度为1119bp,编码约370个氨基酸,始于猪瘟病毒多聚蛋白690位氨基酸残基,终止于1060位氨基酸残基,约为370个氨基酸,其N端上游有一段信号肽序列,C端有一段疏水性的跨膜区(TMR),并且E2蛋白具有两个相对独立的抗原结构单位,一个由B和C区组成,另一个由高度保守的A和D区组成,是产生中和抗体的主要区域[2]。猪瘟兔化弱毒疫苗株曾经有效地控制了猪瘟的发生和流行,但是近年来猪瘟免疫失败的现象很多,而且研究表明,许多地区猪瘟病毒流行毒株已向远离疫苗株的方向演变[3-6],尽管猪瘟疫苗的有效性未被质疑,但是针对现阶段流行毒株研制相应的猪瘟疫苗作为技术储备已成为科技工作者的选择方向,其中亚单位疫苗以其特有的安全性倍受关注,并成为猪瘟新型疫苗研究的热点。
本研究构建了去跨膜区E2基因的毕赤酵母真核表达质粒,电转化整合到酵母X-33细胞基因组中,经过甲醇诱导表达,SDS-PAGE和 Western Blot鉴定,证明在酵母培养上清中,E2蛋白获得成功表达,为猪瘟亚单位疫苗和抗E2蛋白抗体诊断试剂的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 酵母表达载体pPICZαA、毕赤酵母X-33菌株、重组质粒pMD18-T-E2由山东省动物疫病预防与控制中心提供。
1.1.2 试剂 pGEM-T克隆载体购自Promega公司;感受态细胞DH5α、胶回收试剂盒、质粒小提试剂盒、Zeocin(新霉素)购自TIANGEN公司;限制性内切酶、Taq聚合酶购自宝生物工程(大连)有限公司;辣根过氧化物酶(HRP)标记的兔抗猪IgG、HRP-DAB底物显色试剂盒、三氯乙酸(TCA)购自上海生工生物工程技术服务有限公司;YPD、YPDS、BMMY、BMGY培养基均按Easy selectTMpichia expression kit方法配制。
1.1.3 猪瘟阳性血清 猪瘟阳性血清由山东省动物疫病预防与控制中心提供。
1.1.4 引物 参照已发表的Shimen毒株(AF092448)的序列,设计一对特异性引物P1、P2,用于E2基因的扩增,P1:5′-CCGGAATTCCGGCTAGCCTGTAAGGAAG-3′;P25′-ATTTGCGGCCGCGTCAGTCACGTCCAGGTCAA-3′,其中加下划线的序列分别是限制性内切酶EcoRⅠ、NotⅠ的识别序列;并合成用于测序和鉴定外源基因整合至酵母基因组的引物5′AOX1:5′-GACTGGTTCCAATTGACAAGC-3′;3′ AOX1:5′-GGCAAATGGCATTCTGACATCCT-3′;引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 去跨膜区E2基因的扩增 以重组质粒pMD18-T-E2为模板进行PCR扩增,反应体系为:无菌去离子水14.88μL,10×PCR buffer 2.0μL,dNTPmix 1.6μL,P10.2μL,P20.2μL,ExTaq DNA聚合酶0.12μL,质粒模板1.0μL;扩增程序为:94℃预变性7min;94℃30s,62℃30s,72℃1 min,共34个循环;72℃最终延伸7min。之后将PCR产物在10g/L的琼脂糖凝胶电泳中观察结果,用胶回收试剂盒回收。
1.2.2 重组质粒的构建 参照文献[7]方法将PCR产物连入pGEM-T载体,转化到DH5α中,提取重组质粒pGEM-T-E2,经EcoRⅠ和NotⅠ双酶切定向插入P.pichia表达载体pPICZαA中,得到重组表达质粒pPICZαA-E2。
1.2.3 pPICZαA-E2质粒转化酵母菌及高拷贝整合菌株的筛选 参照Easy selectTMpichia expression kit的说明用SacⅠ单酶切线化pPICZαA-E2表达质粒10μL转入80μL酵母X-33感受态细胞中,充分混匀,在0.2cm的石英电转杯中,以1.5kV、20μF、200Ω的条件进行电击转化,涂Zeo-YPDS平板,后将阳性转化子依次接种至含高浓度的ZeocinTM素的YPDS选择平板,以在高浓度ZeocinTM素上正常生长的菌落为高拷贝整合菌株。
1.2.4 酵母基因组PCR鉴定 在高浓度ZeocinTM素下培养72h的酵母培养物的基因组提取参照文献[8],用煮沸-冻融-煮沸法进行。取上清为模板,用引物5′AOX1、3′AOX1进行PCR扩增,鉴定整合至酵母基因组中的目的基因。
1.2.5 阳性转化子的诱导表达 参照Easy selectTMpichia expression kit的说明选3个~5个PCR阳性菌株在30℃条件下进行甲醇诱导表达,分别于24、48、72、96h取培养物1.5mL于离心管中12000r/min离心10min,分别收集上清,置-20℃保存备用。
1.2.6 表达产物的SDS-PAGE和 Western blot鉴定 取上清1mL,以1∶10比例加入100%TCA进行浓缩,上样进行SDS-PAGE,随后进行半干转印,用猪瘟阳性血清进行辣根过氧化物酶标记的兔抗猪IgG进行Western blot分析。
2 结果
2.1 目的基因的扩增和克隆质粒pGEM-T-E2的酶切鉴定
PCR产物在10g/L的琼脂糖凝胶电泳中出现999bp的特异性条带,与预期分子质量一致(图1),经过测序证明所扩增的序列为猪瘟病毒E2基因;克隆质粒pGEM-T-E2在经EcoRⅠ、NotⅠ双酶切后,经琼脂糖凝胶电泳,出现3000bp和999bp的特异性条带(图2),与预期结果一致。

图1 目的基因的PCR扩增Fig.1 Amplifying the E2gene by PCR
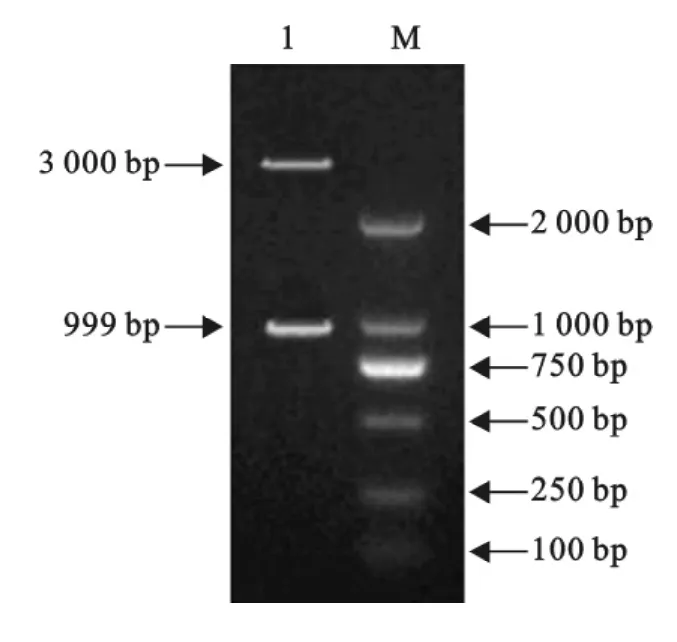
图2 重组质粒pGEM-T-E2的双酶切鉴定结果Fig.2 The identification result of recombinant plasmid pGEM-T-E2 digested by restricted enzymes
2.2 重组表达载体pPICZαA-E2双酶切鉴定结果
重组表达质粒pPICZαA-E2经EcoRⅠ、NotⅠ双酶切后,经琼脂糖凝胶电泳,出现3600bp和999 bp的特异性条带(图3),与预期结果一致。

图3 重组质粒pPICZαA-E2的双酶切鉴定结果Fig.3 The identification results of recombinant plasmid pPICZαA-E2 digested by restricted enzymes
2.3 酵母基因组PCR鉴定目的基因的整合结果
重组表达质粒经SacⅠ线性化后电转入酵母X-33,涂布含Zeocin的YPDS平板,28℃~30℃培养3 d~5d出现菌落,并在1000μg/mL Zeocin的YPDS板上共获得3个阳性高拷贝转化子。提取其基因组,以5′AOX1、3′AOX1为引物进行PCR扩增鉴定,出现2200bp和1500bp的条带,证明筛选的转化子是高拷贝阳性转化子(图4)。
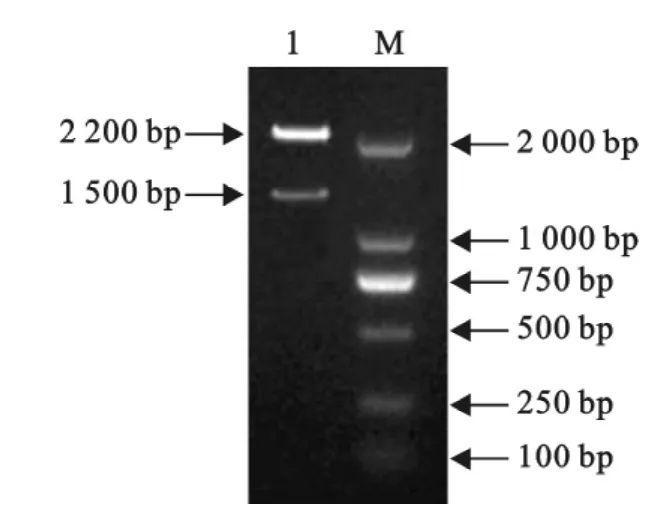
图4 重组酵母转化子的PCR扩增Fig.4 Amplification of Pichia yeast transformant by PCR
2.4 表达产物SDS-PAGE和Western blot鉴定
诱导24h、48h样品经SDS-PAGE电泳不见条带,而诱导72h后样品经SDS-PAGE出现特异性电泳条带(图5),大小为52ku,与预期推导分子质量相符,在Western blot结果中有明显的杂交带而对照组杂交呈阴性(图6),说明酵母培养上清中E2蛋白成功获得表达,且与猪瘟抗血清有良好的特异性反应能力。

图5 SDS-PAGE鉴定 X-33-pPICZαA-E2蛋白表达结果Fig.5 Identification of expressed protein of pPICZαA-E2 in X-33by SDS-PAGE

图6 表达产物的Western blot分析Fig.6 Western blot analysis of recombinant protein
3 讨论
原核生物作为基因工程表达系统有其自身特有的优点,即产量高、生长速度快、操作容易、成本低,但也存在着一些缺陷,比如不能对所表达的蛋白进行糖基化等翻译后修饰,特别是对真核基因的表达,可能导致产物失去生物活性,而酵母作为一种简单的单细胞真核生物,兼有原核生物和真核生物的某些优点,它可对异源蛋白进行修饰,选用带有信号肽的质粒时,蛋白能被正确折叠和加工,然后分泌到培养基中;与哺乳动物表达系统相比,酵母可以在简单培养基中生长,加之酵母本身分泌的背景蛋白少、易进行大规模的发酵培养,扩大产量,因此我们选用毕赤酵母表达系统对E2蛋白进行表达,有利于后续亚单位疫苗的研究和诊断试剂的研制。
本研究使用的载体pPICZαA含有α信号肽,可以引导目的蛋白通过核糖体-内质网-高尔基体途径分泌进入培养基,在分泌过程中,会进行糖基化修饰,而E2蛋白具有5个潜在的糖基化位点[9],此表达系统使表达出的E2蛋白具有天然的构象,同时在引物设计时去除了E2基因C端的TMR,这样更有利于E2蛋白进行分泌表达。
巴斯德毕赤酵母表达载体能够通过电转化的形式将质粒整合到酵母基因组的特定位点,此研究利用SacⅠ作用于AOX1,电转化入酵母基因组中,以单交换的方式整合到X-33的基因组中,产生Mut+型表型,同时由于目的基因的高拷贝数与抗性有一定的正相关性[10],所以我们利用高抗性的Zeocin进行筛选,选择出具有高拷贝数的重组子,而拷贝数的多少与蛋白表达的数量也呈一定的正相关性[11];当然表达量的多少还与很多其他因素有关,比如温度、pH、甲醇的添加量以及密码子偏好性等等[12]。
毕赤酵母表达系统因其表达外源基因的优越性而得到广泛应用,它已高效分泌表达了乙型肝炎表面抗原(HBsAg)、肿瘤坏死因子(TNF)、表皮生长因子(EGF)、人血清白蛋白、水蛭素、蛋白酶抑制剂、膜蛋白、基因工程抗体等,但此系统还需进一步完善,比如与大肠埃希菌表达系统相比,其耗时时间长,存在蛋白质的降解等等一些不可避免的问题,但我们相信随着该系统基础研究的深入和应用研究的推广,其在病原生物学领域将得到越来越广泛的应用。
总之,猪瘟E2蛋白在毕赤酵母中的成功表达,为开展猪瘟亚单位疫苗研究做了必要的准备。
[1]蔡宝祥.家畜传染病学[M].4版.北京:中国农业出版社,2001:147-153.
[2]Risatti G R,Borca M V,Kutish G F,et al.The E2glycoprotein of classical swine fever virus is a virulence determinant in swine[J].J Virol,2005,79(6):3787-3796.
[3]胡 慧,陈丽颖,金 越.猪瘟病毒河南野毒株E2基因的克隆及序列分析[J].中国农学通报,2008,10(24):13-16.
[4]薛青红,刘湘涛,杜守山.河南省猪瘟流行毒的E2基因序列分析和基因分型[J].西北农林科技大学学报,2002,30(2):37-42.
[5]韦正吉,严斯刚,黄小武.广西柳州猪瘟流行毒株E2基因的扩增及序列分析[J].兽医科技,2011(3):99-101.
[6]孙世琪,靳 野,郭慧琛,等.我国近期猪瘟分子流行病学动态[J].动物医学进展,2004,25(6):69-71.
[7]金冬雁,黎孟枫.分子克隆实验指南[M].2版.北京:科学出版社,1998:237-325.
[8]剧 海,梁东春,郭 刚,等.用于PCR实验的毕赤酵母基因组DNA制备方法的比较[J].天津医药,2003,31(5):270-272.
[9]徐学清,张素芳,郑其升.猪瘟病毒E2蛋白A/D抗原区基因在酵母中的分泌表达与鉴定[J].中国病毒学,2004,29(6):598-601.
[10]Romanos M A,Scorer C A,Clare J J.Foreign gene expression in yeast:a review[J].Yeast,1992,8:423-488.
[11]欧阳立明,张惠展,张嗣同.巴斯德毕赤酵母的基因表达系统研究进展[J].生物化学与生物物理进展,2000,27(2):151-154.
[12]韩雪清,刘湘涛,谢庆阁.猪瘟病毒流行毒株E2基因密码子优化及在酵母中的高效表达[J].微生物学报,2003,43(5):560-566.

