扎龙湿地浮游植物群落结构特征与水质评价1)
于洪贤 赵 菲
(东北林业大学,哈尔滨,150040)
扎龙湿地位于黑龙江省西部松嫩平原、乌裕尔河下游,地理坐标为东经 123°51'30″~124°37'30″,北纬46°48'00″~47°31'30″,总面积达 21 万 hm2,是我国同纬度地区保存最完整的湿地生态系统。扎龙自然保护区始建于1979年,1987年被批准为国家级自然保护区,1992年被列入国际重要湿地名录[1]。扎龙湿地地质构造古老、植被类型多样,是我国温带湿地生态学、生物学研究的良好基地。浮游植物是湿地生态系统中重要组成部分,是湿地食物链的基础环节、水环境有机物的生产者,一方面对水环境的变化反应极为敏感,另一方面又会对生态系统产生直接或间接的影响[2]。因此,对扎龙湿地浮游植物的群落结构特征和生物多样性等进行调查,可以为该区域的渔业生产和环境保护等提供有效的科学依据。本文通过对扎龙湿地浮游植物的测定和鉴别,从水生生物学的角度对该地区水体的污染程度进行监测和评价。
1 研究方法
1.1 样品采集与布点
在扎龙湿地共设置7个采样点,分别在2011年夏季的7月和秋季的9月进行采样。每个采样点都采用Garmin公司生产的GPSl2型全球卫星定位系统定位。采样点具体位置见表1和图1。

图1 采样点分布
1.2 样品处理
浮游植物定性样品使用25号浮游生物网,在水中作“∞”形拖动提取。浮游植物定量样本使用有机玻璃采水器,采水样1 L后,立即加入鲁哥氏液固定,沉淀24 h后利用虹吸法浓缩至30 mL。在实验室内,吸出0.1 mL水样置于0.1 mL的计数框内,在40倍的显微镜下对浮游植物进行物种的鉴定和计数[3-4]。在定量的过程中,同一样品分别取两次样品计数,取其平均值为计算结果。

表1 采样点布置
1.3 数据处理
1.3.1 浮游植物的丰度
每升水样中浮游植物数量(N)可用公式(1)计算[5]:
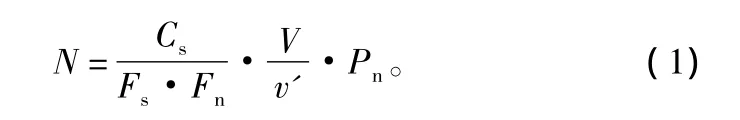
式中:N为1 L水样中浮游植物的个体数(ind.);Cs为计数框面积(mm2);Fs为一个视野的面积(mm2);Fn为计数过的视野数V为1 L水样浓缩后的体积(mL);v'为计数框的容积(mL);Pn为Fn个视野中所计数到的浮游植物个体数(ind.)。
评价标准:浮游植物数量小于3×105ind.L-1为贫营养型;数量范围在(3 ~10)×105ind.L-1为中营养型;数量大于 10 ×105ind.L-1为富营养型[6]。
1.3.2 浮游植物的生物量
生物量随浮游植物的大小、体积变化而有所差别,因此将丰度和生物量一起评价水质会更客观。依据《水生生物学》[5]和《中国淡水藻类》[3],用浮游植物的丰度乘以其湿重,计算得出生物量。
评价标准:生物量的范围在1~1.5 mg·L-1为贫营养型;生物量为1.5~5 mg·L-1为中营养型;生物量大于5 mg·L-1的水质为富营养型[6]。
1.3.3 浮游植物多样性指数
香农—威纳指数(shannon - weave:index)H'[7]:
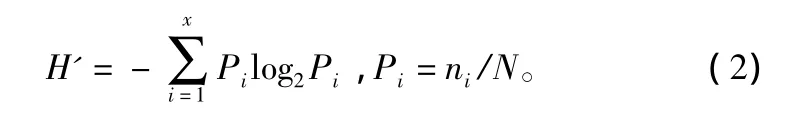
式中:ni为该采集样本中第i种浮游植物的数量;N为样本中出现浮游植物的总个体数。
评价标准:H'>3.0为水质轻度污染或无污染;H'在1.0~3.0间为水质中度污染(其中1~2为α-中污,2~3为β-中污);H'<1.0为水质重度污染[8]136。
均匀度指数(Pielou)J'[9]:

式中:S为采集样本中浮游植物的种类总数;H为Shannon-Wiener指数。
评价标准:J'在0.5~0.8间为水质轻度污染或无污染;J'在0.3~0.5为水质中度污染;J'在0~0.3 为水质重度污染[8]136。
物种丰富度指数 d(Margalef’s index)[10]:

评价标准:d>3.0为水质轻度污染或无污染;d在1.0~3.0间为水质中度污染(其中:1~2为α-中度污染;2~3为β-中度污染);d<1.0为水质重度污染[8]136。
物种优势度指数 y(Mcnaughton index)[11]:

式中:fi为该物种在所有地点中出现的频率。
评价标准:频率>65%的浮游植物认定为该地区浮游植物的常见种[12]16;y>0.02为该地区的优势种[12]12。
2 结果与分析
2.1 浮游植物的群落组成及季节变化
夏季7月份和秋季9月份,在扎龙湿地采样中共鉴定浮游植物7门60属112种。其中:绿藻门的种类最多,27属47种,占42%;硅藻门次之,19属45种,占40%;蓝藻门9属11种,占9.8%;裸藻门3 属3 种,占2.8%;隐藻门2 属2 种,占1.8%;金藻门2属2种,占1.8%;甲藻门1属2种,占1.8%。
扎龙湿地浮游植物群落结构随季节交替有明显变化,秋季(9月份)浮游植物的数量相对夏季(7月份)明显减少,丰度从夏季的1 099.2 ×104ind./L-1下降至秋季的674.4 ×104ind./L-1,减少了38.6%。在两个季节中,硅藻门的数量最多,分别达到631.2×104ind./L-1和 487.2 ×104ind./L-1,各占总数量的57.4%和44.3%;其次是绿藻门,分别达到 238.8 ×104ind./L-1和 135.6 ×104ind./L-1,各占总数量的21.7%和 12.3%。见表 2。
2.2 常见种和优势种的变化
根据频率>65%为原则确定常见种[12]16。扎龙湿地夏季常见种有:硅藻门的短小舟形藻(Navicula exigua),放射舟形藻(Navicula radiosa),双头舟形藻(Navicula dicephala),变绿脆杆藻(Fragilaria virescens),短线脆杆藻(Fragilaria brevistriata),尖针杆藻(Synedra acus),尖针杆藻(极狭变种)(Synedra acus var.Angustissima),肘状针杆藻(Synedra ulna),梅尼小环藻(Cyclotella meneghiniana);绿藻门的狭形纤维藻(Ankistrodesmus angustus),杆裂丝藻(Stichococcus bacillaris),湖沼四胞藻(Tetraspora limnetica);蓝藻门的阿氏席藻(Phormidium allorgei),细小平裂藻(Merismopedia minima);裸藻门的梭形裸藻(Euglena acus)。秋季常见种有硅藻门的短线脆杆藻,尖针杆藻(极狭变种),梅尼小环藻,绿藻门的狭形纤维藻和金藻门的分歧锥囊藻(Dinobryon bavaricum)。

表2 扎龙湿地浮游植物丰度和生物量组成
根据 y >0.02 为原则确定优势种[12]12。扎龙湿地夏季优势种类有:硅藻门的短线脆杆藻、尖针杆藻、梅尼小环藻;蓝藻门的阿氏席藻;绿藻门的狭形纤维藻。秋季的优势种略有不同,除了硅藻门的短线脆杆藻、梅尼小环藻,绿藻门的狭形纤维藻相同外,还出现了硅藻门的尖针杆藻(极狭变种)。
2.3 浮游植物多样性
两个季节中,扎龙湿地浮游植物多样性指数因采样点的不同出现一定程度的差别(表3):Shannon-weave指数(H')在 2.581 5 ~5.061 8 之间,最高值出现在夏季的3#样点,最低值出现在夏季的2#样点;Pielou均匀度指数(J')在0.607 7~0.971 3之间,最高值出现在秋季的3#样点,最低值也出现在夏季的2#样点;物种丰富度Margalef指数(d)在2.276 7~6.039 5之间,最高值出现在夏季的3#样点,最低值出现在秋季的2#样点。浮游植物的各个指数平均值在季节不同时变化趋势不尽相同,并呈现一定程度的波动。Shannon-weave指数(H')的平均值是夏季高于秋季,与Margalef指数(d)相同,而Pielou指数(J')的平均值却是夏季低于秋季。总体而言,扎龙湿地夏季和秋季都属于轻度污染。
在不同的样点,浮游植物多样性指数的平均值也不同。Shannon-weave指数(H')、Pielou指数(J')和Margalef指数(d)的平均值在不同样点的波动基本趋于一致。Pielou指数(J')显示:7个样点未发现严重污染,水质均为轻度污染。Shannonweave指数(H')的评价结果和Margalef指数(d)的评价结果一致,除了2#样点水质为中度污染(β-中污)外,其余6个样点水质均为轻度污染。2#样点为克钦湖度假村,水体碱度大,老百姓俗称“碱泡子”,地势低洼,四周分布水产养殖厂,养殖场废水直接进入克钦湖。浮游植物处于食物链的最低端,在营养物质丰富的地区首先迅速繁殖,同时排斥其它生物种类的生长,使水环境恶化,表现为各项生物多样性指数偏低。
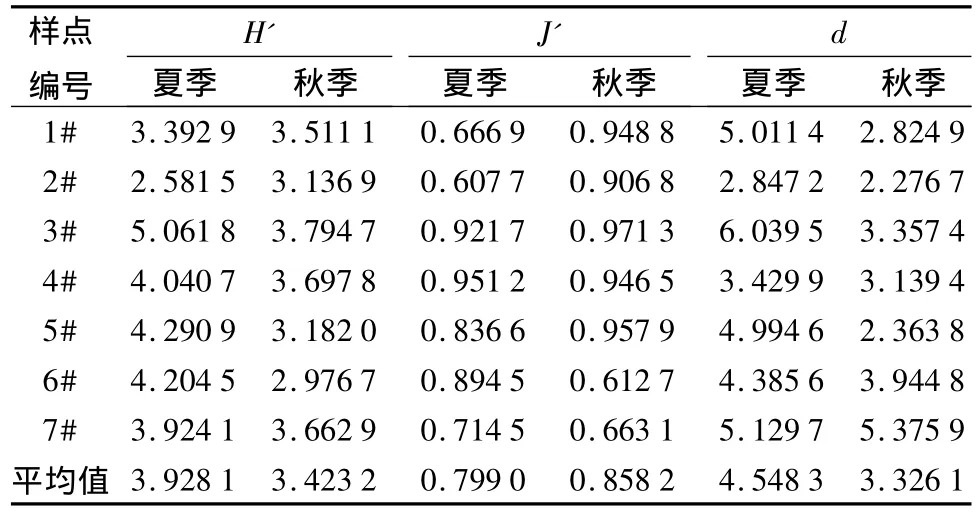
表3 各样点的扎龙湿地浮游植物多样性指数的季节分布
3 结论与讨论
通过研究发现,由于受人为调控等因素的干扰,扎龙湿地水体透明度、营养盐和水流流速频繁地波动,比较适合对光强变化快速适应的硅藻等种类的生长[13]。扎龙湿地浮游植物呈现典型的硅藻—绿藻型,这与其他高纬度、高寒度地区的水体极易出现以硅藻为优势类群的浮游植物群落特征基本一致[14]。
从夏秋两季浮游植物丰度变化中可以明显看出,浮游植物的数量随夏、秋季节的变化而相应减少。这是由于夏季的水温较高(30℃),降水集中,水层温度稳定;秋季水温降低(15℃),气候变化较快,水层温度逐渐下降,藻类数量趋于减少,尤其以喜温性的蓝藻门为代表,秋季数量直接降低至夏季的10.8%。但是,也有在秋季藻类数量增多的现象。如金藻等较耐低温的藻类,仅出现在秋季,可见藻类对水温的适应性差异明显。
浮游植物是生态系统中的初级生产者,也是水域生态系统食物网的最基本的环节,因其对有机质和其他污染物的敏感性不同,因此,通过浮游植物的群落结构可以很好地判断水质的污染状况。本研究采用了Shannon-weave(H')、Margalef(d)和 Pielou(J')3项多样性指数评价扎龙湿地的水质营养状况。从季节分布来观察,Shannon-weave指数(H')的变化趋势与Margalef指数(d)大致相同,夏季的指数平均值稍高于秋季。Pielou(J')指数变化相反,显示秋季各个种个体数的变化程度较大。浮游植物群落之间的组成因季节的变化,存在着明显的差异性。
从空间分布来观察,Shannon-weave指数(H')、Pielou均匀度指数(J')和物种丰富度Margalef指数(d)的波动基本一致,Shannon-weave指数(H')与Margalef指数(d)的评价结果都显示:除2#样点水质为中度污染(β-中度污染)外,其它6个样点的水质均为轻度污染。2#样点是克钦湖度假村,水体碱度大,游客数量逐年上升,以及周边的水产养殖厂等都对克钦湖水环境产生了不利影响。目前,扎龙湿地保护区虽然未出现严重污染现象,但已经有部分地区从最初的轻污染型发展到中污染型,并且有逐步向重污染发展的趋势[15]。因此为了保护扎龙湿地,必须加强对污染源的控制,避免水体富营养化的发生。
[1]Mitsch W J,Mitsch W J,Gosselink J G.Wetlands[M].New York:Van Nostrand Reinhold,1993:1 -722.
[2]Büsing N.Seasonality of phytoplankton as an indicator of trophic status of the large perialpine‘Lago di Garda’[J].Hydrobiologia,1998,369 -370:153 -162.
[3]胡鸿钧,魏印心.中国淡水藻类:系统、分类及生态[M].北京:科学出版社,2006:1-475.
[4]齐雨藻,李家英,谢淑琦,等.中国淡水藻志:第十卷硅藻门羽纹纲[M].北京:科学出版社,2004:1-161.
[5]赵文.水生生物学[M].北京:中国农业出版社,2005:499-507.
[6]王明翠,刘雪芹,张明辉.湖泊富营养化评价方法及分级标准[J].中国环境监测,2002,18(5):47 -49.
[7]Shannon C,Weaver W.The mathematical theory of communication[M].London:University Illionis Press,1949:1 -117.
[8]沈韫芬,章宗涉,龚循矩,等.微型生物监测新技术[M].北京:中国建筑工业出版社,1990:1-273.
[9]Pielou E C.An introduction to mathematical ecology[M].New York:Wiley-Interscience,1969:1 -286.
[10]Margalef R.Information theory in ecology[J].Gensyst,1958,3:36-71.
[11]Lampitt S,Wishner E,Turley M,et al.Marine Snow studies in the northeast atlantic ocean:distribution,composition and roles as a food source for migrating plankton[J].Marine Biology,1993,116(4):680 -702.
[12]张丽娜.海浪河浮游植物群落结构特征和水质营养状态评价[D].哈尔滨:东北林业大学野生动物资源学院,2010:16-17.
[13]Reynolds C,Descy J P,Padisak J.Are phytoplankton dynamics in rivers so different from those in shallow lakes?[J].Hydrobiologia,1994,289(1):1 -7.
[14]李喆,姜作发,马波,等.新疆乌伦古湖春、秋季浮游植物群落结构的聚类和多维分析[J].中国水产科学,2008,15(6):984-991.
[15]周晏敏,朱桂香,韩梅,等.应用浮游植物对扎龙自然保护区水质的初步评价[J].干旱环境监测,1993,7(2):80 -82.

