越橘查耳酮合酶基因的克隆及表达分析1)
李晓艳 裴嘉博 张志东 吴 林 刘海广 李亚东
(吉林农业大学,长春,130118)
李海燕
(教育部生物反应器与药物开发工程研究中心(吉林农业大学))
花色素苷和类黄酮化合物广泛存在于高等植物中,是植物花和果实等几乎所有色泽形成的物质基础,并起到保护植物免受紫外线和病原体损伤的功能[1]。查耳酮合酶(CHS,EC2.3.1.74)是类黄酮生物合成途径的第一个关键酶,它催化1分子4-香豆酰CoA与3分子丙二酰CoA缩合形成含15个碳原子的查耳酮,为类黄酮提供了基本的碳骨架,是一个重要的中间产物。自1983年克隆第一个查耳酮合酶基因(CHS)[2]以来,CHS就成为科学家感兴趣的一个模式基因,用于研究基因表达和基因家族的进化,并且已经在许多植物中相继分离克隆出来[3-9]。由于查耳酮合酶在花色素苷合成途径中的重要作用,科学家利用正抑制和反抑制等方法抑制CHS基因的表达,从而减少花色素苷的合成和累积,达到改变植物花的颜色,培育新品种的目的[10]。
越橘(Vaccinium spp.)俗称蓝莓,由于果实富含花色素苷等对人体健康有益的抗氧化物质而备受关注。花色素苷的生物合成途径是越橘果实成熟过程中最主要的次生代谢途径之一,通过分离和鉴定越橘花色素苷合成途径的关键酶及相关基因,是深入了解和调控越橘果实花色素苷合成的重要方法。但是目前越橘基因组数据的缺乏给越橘花色素苷等次生代谢途径的研究带来了困难,用新一代测序技术(Illumina/Solexa sequencing)对越橘果实的转录组进行测序,并以测序文库中高表达的Unigene23486片段为基础,利用RT-PCR和RACE技术对越橘CHS基因的全长cDNA序列进行克隆,分析该基因的表达与其酶活性和花色素苷累积的关系,从功能基因组水平上研究越橘花色素苷合成途径中重要基因的表达,为进一步研究越橘花色素苷形成的分子机制和培育越橘新品种奠定基础。
1 材料与方法
以越橘品种‘北陆’(V.corymbosum L.)为试材,试验材料来源于吉林农业大学小浆果试验基地。材料分别于花期(2010年5月25日)、绿果期(花后25 d)、粉果期(花后45 d)、蓝果期(花后50 d)采集。取蓝果期(成熟期)的果实,将果肉和果皮迅速分离,各组织液氮速冻处理后,-80℃保存备用。
越橘VcCHS基因cDNA全长序列的获得:果皮RNA提取采用北京奥莱博生物技术有限责任公司生产的植物总RNA提取试剂盒。根据Illumina测序(数据已上传至NCBI Short Read Archive数据库,登录号:SRA046311)产生的在果皮文库中高表达的序列Unigene23486(440 bp)设计1对特异引物CHSF和 CHS-R(表 1),以 DNaseⅠ酶(RNase free)消化处理后的RNA反转录产物cDNA第一链为模板进行PCR扩增。扩增条件为:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸40 s,共30个循环;最后72℃延伸7 min。切胶回收与预期片段大小一致的泳带,连接克隆载体并转化感受态细胞,通过蓝白斑筛选及质粒酶切鉴定阳性克隆后测序。根据所得的cDNA片段的中间序列,分别设计特异引物 VcCHS 3'GSP和 VcCHS 5'GSP(表 1),按照RACE试剂盒SMARTTMRACE cDNA Amplification Kit说明书进行cDNA末端快速扩增。凝胶回收、产物克隆及序列测定如上所述。为获得越橘VcCHS基因全长,根据由中间序列和末端序列拼接而得到的cDNA全长序列,设计1对特异引物VcCHS F和VcCHS R(表1),以 DNaseⅠ酶(RNase free)消化处理后的越橘果皮总RNA反转录产物为模板进行PCR扩增。测序结果在 GenBank中进行 Blast分析。利用在线软件ProtParam预测所编码蛋白的相对分子质量、理论等电点及保守结构域等。采用DNAMAN和MEGA软件进行多序列比对及系统进化分析。
相对荧光定量PCR表达分析:用北京百泰克生物技术有限公司生产的适合多糖多酚植物RNA提取试剂盒分别对‘北陆’的花、绿果、粉果、蓝果、果肉和果皮的总RNA进行提取,用DNaseⅠ酶(RNase free)消化基因组DNA后,各取1 μg为模板,用MMuLV First cDNA Synthesis Kit(Promega)反转录合成cDNA第一链备用。根据VcCHS cDNA全长序列,按照荧光定量PCR引物设计原则在VcCHS的3'非翻译区附近设计1对特异引物P1和P2(表1),获得的扩增片段为92 bp。以 GAPDH(GenBank AY123769)为内参,设计其特异引物GAPDH-F和GAPDH-R(表1),获得的扩增片段为116 bp,对照样品是以绿果提取的RNA为模板,根据GAPDH设计引物C1和C2。对反转录所得的cDNA分别进行5倍梯度稀释(1、1∶10、1∶100、1∶1 000、1∶10 000),实施荧光定量反应,然后绘制相对标准曲线。荧光定量PCR扩增的反应体系20 μL:cDNA模板 1 μL,2 × SYBR PremixEx TaqTM10 μL,上下游特异引物(10 μmol·L-1)各 0.4 μL,水 8.2 μL。扩增采用两步法标准程序:95℃预变性2 min;95℃变性15 s,60 ℃复性15 s,72 ℃延伸30 s,40 个循环,每个循环第3步进行荧光采集;最后95℃变性1 min,退火至55℃,保温1 min后以0.2℃·s-1的速度逐渐升温至95℃ ,在此过程中连续检测其荧光值,绘制熔点曲线。每个试验设3次重复。
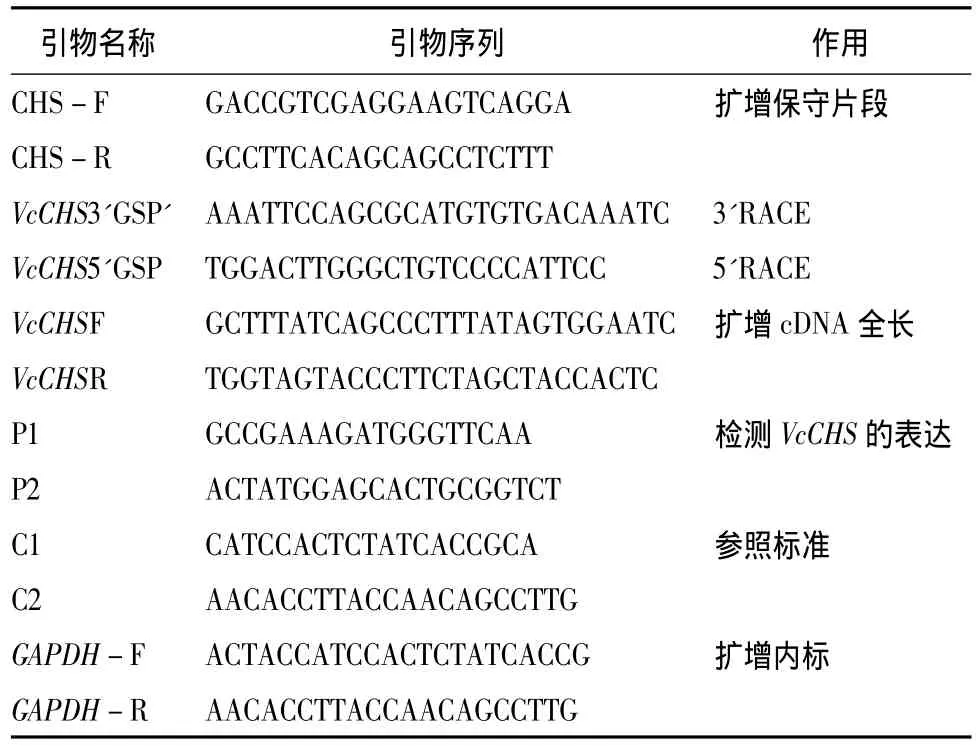
表1 越橘VcCHS基因克隆及表达分析所用引物
花色素苷相对含量测定:花色素苷相对含量测定参照 Pirie[11]及王惠聪等[12]的方法并加以优化,将材料切碎充分混合,取1.0 g鲜样放入20 mL 1%HCl甲醇溶液室温浸提2 h。取2 mL浸提液,用1%HCl/甲醇溶液稀释6倍,以1%HCl/甲醇溶液作为空白,用分光光度计测定提取液在553、600 nm处的吸光值,两者之差即为花色素苷的相对含量。差值每增加0.01定义为1个单位。设3次取样重复。
2 结果与分析
2.1 越橘VcCHS基因cDNA全长的获得及序列分析
以果皮RNA反转录的cDNA为模板,CHS-F和CHS-R为引物,扩增出一条440 bp的单一特异性条带(图1,A),阴性对照未加模板。回收纯化产物后经测序与预期结果一致。以VcCHS3'GSP和VcCHS5'GSP为引物,经RACE-PCR扩增和产物克隆、测序后,分别得到长度为1 169 bp的3'端和474 bp的5'末端(图1B)。根据3'RACE和5'RACE测序结果拼读出越橘查耳酮合酶基因,并将其与全长引物VcCHS F和VcCHS R扩增所得的序列(图1C)进行比较,最终获得一条长为1 438 bp的cDNA全长序列,命名该基因为VcCHS(GenBank登录号为JN654702)。利用NCBI提供的ORF Finder进行分析发现,VcCHS包含一个长度为1 260 bp的开放读码框(open reading frame,ORF)和一个 poly(A)尾巴,5'非翻译区长 107 bp,3'非翻译区长 71 bp(图2)。其ORF编码一个含419个氨基酸的蛋白质,包括起始密码子和终止密码子。利用在线软件Prot-Param预测所编码蛋白的相对分子质量为45.7 kD,理论等电点(pI)为8.21。

图1 越橘VcCHS基因的PCR扩增电泳图
2.2 VcCHS基因编码产物的功能分析与同源性比较
为进一步分析越橘CHS与其他物种CHS的同源性,利用DNAMAN5.2.2软件对包括越橘在内的15个物种的CHS的氨基酸序列进行了多重比对。结果如图3,越橘VcCHS基因编码的氨基酸序列与其他已知植物的氨基酸序列有很高的同源性,平均达到86.76%;与葡萄(AEP17004)相似性高达90.2%;与同是杜鹃花目的植物山茶(BAA05641)、杜鹃花(CAC88858)相似性较高,分别达到86.4%和84.8%;而与番茄(AEK99072)相似性相对较低,为81.0%。利用NCBI Conserved Domain Search进行保守域分析表明,越橘CHS的ORF十分保守,编码的蛋白具有的两个保守域,即cd00831(CHS_like,Chalcone and stilbene synthases,type IIIplantspecificpolyketide synthases,Ⅲ型聚酮合成酶)和PLN03173(chalcone synthase;Provisional)。进一步的功能位点分析发现,越橘CHS含有多个查耳酮合酶起功能作用所必需的活性位点,这些活性位点使底物能够和查耳酮合酶结合发生催化反应,其位点是:Cys(C)164、His(H)303和 Asn(N)336;CoA 结合位点:Lys(K)55、Arg(R)58、Met(M)59、Phe(F)265、Gly(G)306、Pro(P)307和 Ala(A)308。这些位点几乎在所有CHS中都高度保守,且各位点的相对位置保持不变(图3)。另外,利用 prosite软件对越橘CHS序列的功能位点分析表明,VcCHS基因编码的氨基酸序列还具有查耳酮合酶基因家族的特征多肽序列:RLMMYQQGCFAGGTVLR(图3)。
在多重比对的基础上,为进一步分析越橘CHS与其他植物CHS之间的进化关系,利用MEGA 4.0软件,对越橘和上述14种已知植物CHS结构域蛋白进行进化树分析,结果(图4)表明,越橘CHS的进化基本符合植物分类学分类,并具有明显的种属特性,除了紫花苜蓿(AAA02827)外,同属于蔷薇科的几个物种聚为一类,茄科植物聚为一类。越橘VcCHS(JN654702)基因编码的氨基酸序列越橘CHS与同是杜鹃花目的山茶(BAA05641)和杜鹃花(CAC88858)聚为一类。
2.3 VcCHS基因的组织特异性表达
采用荧光定量PCR的方法对VcCHS基因在越橘不同组织中的表达量进行了检测,以绿果作为对照,表达量定为“1”,按照⊿⊿Ct作图,⊿⊿ Ct=()处理组-()未处理组,Ct值:表示扩增产物的荧光信号达到设定的阈值时所经过 的扩增循环数。

图2 越橘VcCHS基因cDNA全长及推导的氨基酸序列
结果(图5)表明,从越橘开花到果实成熟的整个发育过程中都能检测到VcCHS的表达。在果实发育不同时期,VcCHS的相对表达量和花色素苷相对含量在蓝果期显著高于其他时期(p<0.05),二者均是在果皮组织中达到最大值。VcCHS相对表达量与花色素苷相对含量之间具有正对应关系。
3 结论与讨论
本研究以Illumina测序产生的片段为基础,通过RT-PCR和RACE方法从越橘果皮中成功分离出CHS的同源基因VcCHS,该基因编码的蛋白质具有CHS家族保守存在的活性位点和特征多肽序列,进行基因序列同源性分析发现,CHS基因编码区保守性很强,不同科植物间氨基酸水平上的同源性达86.76%。这与之前的研究结果相一致,即认为CHS编码区有很高的保守性,不同科植物间,在DNA水平上的同源性大于60%,在氨基酸水平上的同源性达80%[13]。系统进化分析表明越橘CHS的进化具有明显的种属特性,与同是杜鹃花目的植物山茶和杜鹃花亲缘关系最近,与茄科植物亲缘关系较远。利用实时荧光定量PCR对VcCHS基因在越橘不同组织中的表达量进行了检测,在整个果实发育的过程中都能检测到VcCHS基因的表达,花期和果实成熟期表达量较高,这与 Jaakola et al.[14]用 Northern-blotting方法检测CHS基因在欧洲越橘(Vaccinium myrtillus L.)果实发育不同时期的检测结果一致。

图3 越橘VcCHS基因主要ORF推导的氨基酸序列与其他物种CHS多重比对分析
CHS是花色素苷代谢途径中的第一个限速酶,在类黄酮的代谢途径上查耳酮分子的异构化和功能基团的进一步取代都能导致黄酮、异黄酮和花色素苷的合成,从而使花色、叶色和果实色泽发生变化[15]。越橘VcCHS基因的表达量与花色素苷的蓄积量都是在果皮组织中达到最高,这与荔枝[16]的研究结果相似,说明CHS基因相对表达量变化与花色素苷相对含量的变化趋势具有一致性,并具有一定的组织特异性。从而推测CHS可能是越橘花色素苷合成途径的主要限速酶之一,在转录水平上对越橘果实花色素苷的形成起调控作用。
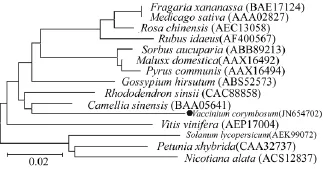
图4 越橘VcCHS与其他物种CHS氨基酸序列的系统进化树分析

图5 越橘果实发育的不同阶段和VcCHS的组织特异性表达
不同植物的CHS基因序列同源性很高,但功能上存在明显差异,CHS几乎在所有植物中都是以多基因家族存在,研究表明被子植物中至少有两个基因,在茄科和豆科植物中甚至检测到8个以上的CHS基因[17-18]。如在矮牵牛中检测到的8个CHS,多数在花组织中表达,主要与花色素苷的累积有关[19];在苜蓿中,CHS 主要在花和叶中表达[20];在山茶的茎和叶中检测到CHS,并发现其参与儿茶素的合成[21]。通过Illlumia测序技术对越橘果实进行转录组测序,经过短序列拼接组装、比对和功能注释,研究发现多个序列比对到CHS,所以肯定越橘的CHS也是多基因家族,接下来将通过基因工程的手段构建植物正义和反义表达载体转化烟草和番茄,对越橘VcCHS基因的功能进行进一步的研究和探讨。
[1]Koes R E,Quattrocchio F,Mol J N.The flavonoid biosynthetic pathway in plants:function and evolution[J].BioEssays,1994,16:123-132.
[2]Reimold U,Kroeger M,Kreuzaler F,et al.Coding and 3’noncoding nucleotide sequence of chalcone synthase mRNA and assignment of amino acid sequence of the enzyme[J].EMBO J,1983,2:1801 -1805.
[3]Ursula N K,Barzen E,Bernhardardt J,et al.Chalcone synthase genes in plants:a tool to study evolutionary relationship[J].J Mol Evol,1987,26:213 - 225.
[4]Mo Y,Nagel C,Taylor L P.Biochemical complementation of chalcone synthase mutants defines a role for flavonols in functional pollen[J].Proc Natl Acad Sci USA,1992,89:7213 -7217.
[5]Dong X,Braun E L,Grotewold E.Functional conservation of plant secondary metabolic enzymes revealed by complementation of Arabidopsis flavonoidmutants withmaize genes[J].Plant Physiol,2001,127:46 -57.
[6]Yang Ji,Huang Jinxia,Gu Hongya,et al.Duplication and adaptive evolution of the chalcone synthase genes of Dendranthema(Asteraceae)[J].Mol Biol Evol,2002,19:1752 -1759.
[7]Huang Jinxia,Qu Lijia,Yang Ji,et al.A preliminary study on the origin and evolution of chalcone synthase(CHS)gene in angiosperms[J].Acta Botanica Sinica,2004,46(1):10 -19.
[8]Han Y Y,ming F,Wang J W,et al.Cloning and characterization of a novel chalcone synthase gene from Phalaenopsis hybrida orchid flowers[J].Russion Journal of Plant physiology,2006,53(2):223-230.
[9]Tanaka Y,Sasaki N,Ohmiya A.Biosynthesis of plant pigments:anthocyanins,betalains and carotenoids[J].Plant J,2008,54(4):733-749.
[10]Que Q,Wang H Y,English J J,et al.The frequency and degree of cosuppression by sense chalcone synthase transgenes are dependent on transgene promoter strength and are reduced by premature nonsense codons in the transgene coding sequence[J].Plant Cell,1997,9(8):1357 - 1368.
[11]Pirie A,Mullins M G.Changes in anthocyanin and phenolics content of grapevine leaf and fruit tissues treated with sucrose,nitrate,and abscisic Acid[J].Plant Physiol,1976,58(4):468 -472.
[12]王惠聪,黄旭明,黄辉白.‘妃子笑’荔枝果实着色不良原因的研究[J].园艺学报,2002,29(5):408 -412.
[13]王金玲,顾红雅.CHS基因的分子进化研究现状[C]//李承森.植物科学进展.北京:高等教育出版社,2000.
[14]Jaakola L,Maatta K,Pirttila A M,et al.Expression of genes involved in anthocyanin biosynthesis in relation to anthocyanin,proanthocyanidin,and flavonol levels during bilberry fruit development[J].Plant Physiology,2004,130:729 -739.
[15]He Fei,Mu Lin,Yan Guoliang,et al.Biosynthesis of anthocyanins and their regulation in colored grapes[J].Molecules,2010,15(12):9057-9091.
[16]Wei Yongzan,Hu Fuchu,Hu Guibing,et al.Differential expression of anthocyanin biosynthetic genes in relation to anthocyanin accumulation in the pericarp of Litchi chinensis Sonn[J].PLoS One,2011,6(4):e19455.
[17]Martin C R.Structure,function and regulation of the chalcone synthase[J].Int Rev Cytol,1993,147:233 -284.
[18]Ito M,Ichinose Y,Kato H,et al.Molecular evolution and functional relevance of the chalcone synthase genes of pea[J].Mol Gen Genet,1997,255:28 - 37.
[19]Koes R E,Spelt C E,Mol J N M.The chalcone synthase multigene family of Petunia hybrida(V30):differential light-regulated expression during flower development and UV light induction[J].Plant Mol Biol,1989,12:213 - 225.
[20]Junghans H,Dalkin K,Dixon R A.Stress responses in alfalfa(Medicago sativa L.).Characterization and expression patterns of members of a subset of the chalcone synthase multigene family[J].Plant Mol Bio,1993,122:239 -253.
[21]Takeuchi A,Matsumoto S,Hayatsu M.Chalcone synthase from Camellia sinensis:Isolation of the cDNAs and the organ-specific and sugar-responsive expression of the genes[J].Plant Cell Physiol,1994,37:1011 -1018.

