南太平洋东劳扩张中心表层沉积物氨基酸组成所揭示的生物地球化学意义
王丽玲, 杨群慧, 付少英, 胡建芳
南太平洋东劳扩张中心表层沉积物氨基酸组成所揭示的生物地球化学意义
王丽玲1,2, 杨群慧3, 付少英4, 胡建芳1*
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广东 广州 510640; 2. 中国科学院 研究生院, 北京 100049; 3. 同济大学 海洋地质国家重点实验室, 上海 200092; 4. 国土资源部 广州海洋地质调查局, 广东 广州 510630)
通过对南太平洋劳盆地东劳扩张中心(ELSC)表层沉积物进行水解氨基酸(THAA)分析、氨基酸对映异构体比值(D/L)分析及总有机碳(TOC)分析, 对沉积物中氨基酸含量和来源、有机质降解程度和采样区域生物活动性及温度特征等问题进行了探讨。结果表明, ELSC区域样品中有机质含量较低, TOC含量为0.70~2.15 mg/g(干重), THAA含量为30~511 μg/g (干重), 热液活动区域原位化能合成作用对沉积物中氨基酸的相对富集有较大的贡献。沉积物中THAA含量和生物群落活动状况与分布范围有关, 样品矿物组分对氨基酸的保存亦有一定的影响。由于各采样点热液活动、沉积物类型、生物群落的类型及分布均有所不同, 样品中个体氨基酸的组成分布特征有较大差异。以TOC中氨基酸态碳所占百分比TAAC%作为指标对样品有机质活性进行了判别, 热液喷口区域样品有机质新鲜程度要普遍高于非热液喷口区域样品, 高温热液环境对氨基酸降解途径有一定的影响。样品中个体氨基酸D/L比值变化范围较大, 天冬氨酸(Asp)为0.08~0.46, 谷氨酸(Glu)为0.06~0.19, 丝氨酸(Ser)为0.01~0.81, 丙氨酸(Ala)为0.10~0.30。根据样品中THAA含量、TAAC%及个体氨基酸的D/L比值可以粗略判断生物活动性的大小及细菌对THAA的相对贡献, 但并不能准确地区分热液活动活跃区域和非活跃区域在温度和生物活动性方面的差异。
热液; 沉积物; 氨基酸; 有机质活性; 生物活动性; 南太平洋
0 引 言
氨基酸是有机生命体组织细胞的基本组成成分, 也是海洋沉积物中有机物质的重要组成部分。海洋中生物死亡后, 由微生物分泌的胞外酶和生物细胞残留的蛋白酶能将蛋白质水解成氨基酸(其中以L型氨基酸居多), 部分氨基酸被微生物作为营养物质吸收利用[1], 残余蛋白质和氨基酸经过沉降作用进入沉积物, 经受生物及成岩改造作用。在成岩过程中, L型氨基酸在进行水解作用的同时发生外消旋反应, 逐渐转化成其对映异构体D型氨基酸[2]。氨基酸在海洋沉积物中的含量、组成分布与其生物来源、沉积环境、成岩作用等因素均密切相关, 作为生物标志化合物在海洋沉积环境研究中得到了广泛的应用, 包括提供沉积物成岩改造强度和有机质来源、降解程度的信息[3], 提供沉积区域气候条件变化和沉积环境信息等[2,4,5]。近年来, 海洋沉积物氨基酸生物地球化学研究取得了新的进展, 一些新的氨基酸指标被提出应用, 如利用氨基酸对映异构体比值(D/L)来判别沉积区域生物活动性[6], 利用水解氨基酸(THAA)在剖面上的变化趋势判断生物扰动带的范围和深度[7–8], 利用D、L型氨基酸的碳同位素组成判断沉积物中水解氨基酸的生物来源等[9]。
深海热液活动是目前国际地学界和生物学界关注的前沿研究热点之一, 其独特的地质活动及分布在喷口区域不依赖于光合作用存在的特殊生物群落对于生命起源的探讨、生物资源及矿产资源的开发等领域有着重要的研究价值。至今为止, 科学家们相继在地质学、地球物理学、地球化学和生物学等方面对深海热液活动区开展了大量的研究, 对热液活动成因、热液流体成分、矿产生成原理、生物群落研究以及热液区微生物分子生物学特征等问题有了一定的了解。然而, 在有机地球化学研究领域, 对深海热液活动区域沉积物中THAA的研究并不多。Andersson.[10]曾对太平洋东北Juan de Fuca洋脊7个位点的钻孔柱状沉积物样品进行了THAA含量分析和部分样品的氨基酸对映异构体比值分析, 阐述了温度对氨基酸含量及其分布的影响, 并判断了温度对氨基酸D/L比值的影响程度。Takano.[6]对太平洋伊豆-伯宁(Izu-Bonin)弧Suiyo 海山深海高温热液系统中采集的柱状沉积物样品THAA分布特征进行了研究, 探讨了氨基酸D/L比值作为指示氨基酸来源和反映生物活动性指标的可能性。已有的研究表明, 受极端热液环境的影响, 深海热液活动区域沉积物的氨基酸生物地球化学特征与正常海洋环境相比, 在含量、个体氨基酸分布特征和氨基酸的消旋化速率等指标上都有其独特性。
本研究拟对采集自南太平洋劳盆地东劳扩张中心(ELSC)的表层沉积物样品进行17种水解氨基酸的定性定量分析, 以及天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)和丙氨酸(Ala)的对映异构体比值分析, 结合样品总有机碳分析结果, 了解该区域沉积物中THAA含量及组成分布情况, 探讨不同类型的热液活动及热液生态系统对沉积物中氨基酸来源及组成特征的影响, 尝试利用氨基酸的D/L比值对采样区域的生物活动性及采样区域温度变化的影响做出相应解释。
1 材料与方法
1.1 样品采集
劳盆地(Lau Basin)位于热带南太平洋汤加岛以西, 发育于Coville-Lau洋脊和Tonga-Kermadec 洋脊之间, 是首个被认为属于弧后盆地(BABs)的半封闭型海底盆地。劳盆地地质环境变化表现异常明显, 岩浆源化学、流体化学、地形特征和岩性等均沿洋脊走向有显著变化[11]。盆地中发育有许多正在活动的低温和高温热液喷口, 存在大量与大洋中脊(MORs)明显不同的生物群落, 生物多样性指数极高。ELSC区域位于劳盆地内汤加俯冲带之后, 2003年以前, 对于ELSC的研究主要集中在其南端的Valu Fa 洋脊。2003~2008年期间, 在Valu Fa 洋脊以北的地区先后发现了7个活动的热液场, 并开展了一些科学研究工作, 但有机地球化学方面的研究极少。本研究使用的样品系由“大洋一号”在ELSC区域采用电视抓斗采集的部分表层沉积物, 其中TVG2、TVG14和TVG11均在ELSC现有已知的热液场区域外采集, 沉积物主要为基岩的风化剥蚀物, 无明显的热液喷口区样品特征。TVG9、TVG10采集自Mariner热液场喷口区域, 为热液沉淀物, TVG10中见有热液生物。TVG8采集自Vai Lili热液场喷口区域, 以热液硫化物为主要矿物成分。TVG5和TVG6采集于Vai Lili热液场以南区域, TVG5主要为热液沉淀物, 含有大量的蠕虫等热液生物, 具有较明显的热液喷口样品特征; TVG6采样点位于TVG5附近, 主要来自基岩的风化剥蚀物, 样品中含有少量含生物的热液硫化物和氧化物, 可能采集于热液喷口附近。具体采样位点见图1。
1.2 水解氨基酸的定性定量分析
样品中THAA的提取采用传统的酸水解方法。样品经冷冻干燥并研磨均匀后, 取0.3~0.5 g样品置于水解管中, 加入适量6 mol/L HCl, 充入氮气2 min后密封, 110 ℃下水解22 h。水解冷却后的样品经离心后将上清液在45 ℃下旋转蒸发干燥, 用0.02 mol/L HCl溶解并转移到样品瓶中以备过阳离子交换树脂柱(DOWEX 50WX8 200-400)。样品过柱前用2 mol/L HCl再生树脂, 用H2O将树脂洗至中性, 上样后先用H2O洗去阴离子和非极性有机组分, 再用浓度约2.6 mol/L的氨水洗脱氨基酸。洗脱液用旋转蒸发仪45 ℃下旋干后用0.02 mol/L HCl溶解样品并定容, –20 ℃冷冻保存待仪器分析。
氨基酸的分析采用高效液相色谱柱前衍生方法[12–14]。碱性条件下, 邻苯二甲醛(OPA)在3-巯基丙酸(3-MPA)存在下与氨基酸生成带有荧光信号的衍生产物, 利用反相C18柱进行分离, 荧光检测器检测。仪器条件如下: Waters2695系统, 2475荧光检测器, 色谱柱为C18柱, 250×4.6 mm, 5 μm, 备有2 cm保护柱。使用梯度流动相分离, 流动相A为0.05 mol/L 醋酸钠缓冲溶液(pH 7.2±0.02), 按体积比加入1%四氢呋喃(THF); 流动相B为0.1 mol/L醋酸钠缓冲溶液、乙腈、甲醇以体积比4﹕4﹕1混合后, 调节pH至7.2±0.02。洗脱程序: 初始流动相为95%A, 5%B, 0→5 min, 20%B; 5→18 min, 60%B; 18→22 min, 100%B; 流速: 1.2 mL/min; 荧光检测ex= 337 nm,em= 454 nm。
分析的氨基酸包括: 天冬氨酸(Asp)、谷氨酸(Glu)、丝氨酸(Ser)、组氨酸(His)、苏氨酸(Thr)、甘氨酸(Gly)、精氨酸(Arg)、丙氨酸(Ala)、酪氨酸(Tyr)、缬氨酸(Val)、苯丙氨酸(Phe)、蛋氨酸(Met)、亮氨酸(Leu)、异亮氨酸(Ileu)、赖氨酸(Lys)、β-丙氨酸(β-Ala)及γ-氨基丁酸(γ-Aba)。个体氨基酸利用标样的保留时间定性, 外标法定量, 氨基酸标准曲线相关系数均在0.996以上, 大部分在0.999以上。利用空白基质加标方法测定了样品前处理方法的回收率, 除了丝氨酸、β-丙氨酸平均回收率分别为74.4%和73.7%, 蛋氨酸回收率极低外, 其他氨基酸的平均回收率在80%~98%之间。大部分氨基酸的回收率相对标准偏差在4.5%以下, 丝氨酸为6.2%, 苏氨酸为5.2%, 赖氨酸为6.6%。此外, 蛋氨酸的回收受到基质的影响较大, 回收率很低, 且回收率相对标准偏差很大。因此, 该方法对蛋氨酸的定量有待商榷。
1.3 氨基酸对映异构体分析
氨基酸对映异构体分析采用高效液相色谱柱前衍生的分析方法, 利用OPA在N-异丁酰-L-半胱氨酸(IBLC)存在的情况下将D、L型氨基酸衍生为一对带有荧光信号的非对映异构体, 用C18柱进行分离, 荧光检测器检测[15–17]。本研究中所选择分析的目标氨基酸为Asp、Glu、Ser和Ala, D/L值的计算利用目标物峰面积数值直接计算。
仪器分析所用流动相A为0.023 mol/L 醋酸钠缓冲溶液(pH 6.0±0.02), 流动相B为甲醇, 流动相C为乙腈。荧光检测器ex= 230 nm,em= 445 nm, 梯度洗脱条件见表1。

图1 ELSC区域表层沉积物采样位点图

表1 氨基酸对映异构体梯度洗脱程序
2 结 果
2.1 沉积物中有机质含量
对样品TOC和THAA的含量分析表明, 有机质含量较低, 除了样品TVG8的TOC含量达到2.15 mg/g外, 大部分样品的TOC在0.70~1.07 mg/g之间。样品TVG8的THAA含量亦是所有样品中最高的, 达到511 μg/g, 其他样品中THAA的含量在30~157 μg/g之间, 平均为87 μg/g (表2)。
2.2 氨基酸相对摩尔百分含量
样品TVG2、TVG5、TVG9、TVG10和TVG11中, Asp和Ala的摩尔百分含量均较高, Asp的含量在13.7%~21.4%之间, Ala在14.0%~17.4%之间; 其次为Glu, Val和Gly, 所占的比例稍低。上述样品中均缺失Tyr和Phe, 而 Met、Arg 和His 在大部分样品中缺失。在其他采样点, 沉积物样品表现出不同的氨基酸含量分布模式。TVG8是ELSC所有样品中唯一能完整检测到17种水解氨基酸的样品, 其中Gly 的摩尔百分含量高达27.9%, Val的百分含量达到了10.9%, 其余个体氨基酸的摩尔百分含量在7.5%以下。样品TVG6中, Gly和Ala的百分含量最高, 分别为17.2%和17.0%, 其次为Val (12.1%), Lys (10.8%)及Thr (8.9%), 其余氨基酸含量均在7.0%以下, 其中His、Tyr和Phe未检出, Arg和Met为微量检出。样品TVG14中, Arg含量异常高, 达到了19.4% , 其次为Ala (16.7%), Gly (11.3%)和Val (10.2%)。各样品中氨基酸相对摩尔百分含量信息详见表3。
2.3 各族氨基酸含量
根据侧链基团将蛋白质氨基酸分成以下几类: 酸性氨基酸(Asp, Glu), 碱性氨基酸(His, Arg, Lys), 中性氨基酸(Gly, Ala, Val, Leu, Ileu, Ser, Thr), 芳香族氨基酸(Tyr, Phe)和含硫氨基酸(Met)。图2为样品中各族氨基酸的摩尔百分含量组成图, 由图上看, 样品中中性氨基酸占主要优势, 摩尔百分含量达到50%以上, 其中样品TVG6高达71.2%。样品TVG2、TVG5、TVG9、TVG10及TVG11中, 酸性氨基酸的含量均要高于碱性氨基酸。样品TVG6和TVG8中, 酸性氨基酸的含量与碱性氨基酸相当。样品TVG14中, 碱性氨基酸含量高于酸性氨基酸。含硫氨基酸在所有样品中含量均很低, 除样品TVG8外, 其余样品的芳香族氨基酸均未检测出。

表2 样品中TOC、THAA含量分析结果及氨基酸态碳占TOC百分比(TAAC%)

表3 ELSC区域样品氨基酸摩尔百分含量(%)

图2 ELSC区域样品各族氨基酸摩尔百分含量图
2.4 氨基酸对映异构体比值(D/L)
部分样品的Asp、Glu、Ser和Ala的对映异构体比值分析结果如表4示。D/L比值较高的样品为TVG2、TVG14和TVG8。其中TVG8样品中Asp、Glu和Ser的D/L比值最高, 分别达0.46、0.19和0.81。

表4 ELSC区域样品中Asp、Glu、Ser及Ala的D/L比值分析结果
3 讨 论
3.1 有机质含量影响因素的探讨
海洋沉积物中有机质的含量与有机质的来源、输入量、沉积颗粒物的大小、降解途径和程度等多种因素有关。由于表层海域丰富的有机质在沉降过程中遭受了一系列的生物降解和利用过程, 对深海沉积物有机质的贡献有限。而深海环境中普遍低的生产力决定了来自于深海的有机质来源输入是较低的, 因此大部分深海沉积物样品中有机质含量明显偏低。
在深海热液喷口区域, 受热液活动支持而存在的、以化能合成微生物为初级生产者的生物群落形成了较为丰富的生产力, 是沉积物中有机质的重要来源之一。从TOC含量来看, ELSC样品含量与太平洋其他海域沉积物相比普遍较低[10,18,19], 样品中仅有在热液喷口区域采集的TVG8的TOC含量达到2.15 mg/g, 其余不论是热液喷口区样品还是非热液喷口区样品, TOC含量无太大的差别。TVG8样品是所有采集样品中唯一以热液硫化物成分为主的样品, 其上覆盖有白色的菌席, 抓斗样品中含有大量死亡的螺和贝类的外壳, 显示出曾经存在的强烈生物活动迹象。由于TVG8样品中硫化物成分可为化能自养微生物的大量生长和繁殖提供丰富的营养来源, 沉积物中微生物活动可能是该样品中TOC含量远高于其他样品的主要原因。杨伟芳[20]对样品中脂类生物标志物进行了分析, 在TVG8样品中检测到了藿烯类化合物, 此类化合物指示了细菌成因, 表明细菌对TVG8样品有机质具有重要贡献。虽然热液生物群落的贡献是沉积物中有机质的主要来源之一, 但热液生物群落一般围绕喷口呈环带状分布[21], 且分布范围和活动范围极其有限, 因此在同为喷口区域采集的样品有机质含量也有可能大不相同。从样品的TOC含量看, 除TVG8外, 热液喷口区样品中热液生物群落的存在对TOC含量的影响与非热液喷口区样品相比并没有明显差异。而Yamanaka.对西太平洋热液喷口沉积物的研究表明, 沉积物中低的TOC 含量可能与沉积物中矿物组成大部分为火山碎屑沉积、沉淀物中缺乏有机质有关[19]。因此, 除样品TVG8外, ELSC区域其他样品中低的有机质含量可能与它们均来源于贫有机质的火山岩风化剥蚀物和热液沉淀物有关。
3.2 沉积物中THAA含量及组分分布影响因素
热液活动区域沉积物中THAA的含量受到热液生物群落活动的显著影响。ELSC区域THAA含量较高的样品如TVG6、TVG8和TVG10等均在热液喷口或喷口附近区域采集, 样品中有不同程度生物存在。相比较之下, 采集于非热液喷口活动区域的样品TVG11和TVG14均未见生物样品, THAA含量相对偏低。ELSC区域中的Vai Lili热液场具有相对发育的生物群落, 采自该热液场的TVG8样品矿物成分以热液硫化物为主表面覆盖菌席, 其THAA含量和检测出的氨基酸种类都远高于其他样品, 推测其THAA主要来源于菌席的贡献。除样品TVG8外, 采集于热液喷口区域的大部分样品THAA的含量均较非热液喷口区样品高。由于氨基酸在沉积物中的降解速度要高于TOC, 沉积物中THAA含量上的变化要较TOC敏锐, 样品中THAA含量分析结果显示了热液生物群落对沉积物有机质中THAA含量的显著影响。
由于ELSC各个热液场在沉积环境、热液温度、热液流体成分以及生物群落分布等方面存在较大的差异, 各自构成了比较独特的热液环境。根据已有的资料, 劳盆地生物群落在不同热液场的数量和种类均表现出明显的变化[11], 这种变化势必导致生物对氨基酸的利用及对沉积物中氨基酸的贡献上的各种差异, 从而对沉积物中氨基酸含量及组成造成一定的影响。ELSC区域的范围从北部的19°20′S 向南延伸至22°45′S, 长度约400 km, 在这个不大的区域内, 所采集样品中个体氨基酸的分布模式存在多种类型(图3)。除样品TVG8外, 其他样品芳香族氨基酸均缺失, 大部分样品中Met含量极低。某些个体氨基酸在样品中丰度较高, 如样品TVG8中的Gly和样品TVG14中的Arg。由于氨基酸是热液环境中微生物碳源的主要来源之一, 可以作为微生物生长所需的重要底物被生物降解和吸收[22], 有机质的生物降解可以导致特定氨基酸的富集或亏损, 可能是由于这些氨基酸的食物价值, 或氨基酸与细胞壁、细胞质和矿物基质的结合程度不同造成的[23]。
沉积物中氨基酸的热力学降解、酸水解和非生物合成等因素同样会对样品中氨基酸含量和组成造成影响。在样品TVG8中, 检测到了极高的Gly含量, 但其来源还不能完全确定。Gly既是生物体中蛋白质水解的直接产物, 也是一些氨基酸降解的产物。Dauwe.[24]的研究认为沉积物中Gly的富集有可能是由于其对底栖生物的营养价值不高或动物对Gly大量合成有关。在深海热液环境中是否能合成氨基酸至今仍有较大的争论[25], 一些实验证明, 在模拟海底热液环境条件下, 可以合成Gly、Ala和Asp等一些氨基酸[22,26]。目前还没有一个好的标准来判定沉积物中氨基酸的生物或非生物来源。
样品TVG5 为热液沉淀物, 保存了良好的热液通道构造, 可见到大量蠕虫等活体生物, 但其THAA含量远低于样品TVG8。采集于TVG5附近的样品TVG6则主要为基岩的风化剥蚀物, 见有少量含生物的热液硫化物和氧化物, 其THAA的含量要高于样品TVG5。王将克等认为, 矿物若具有疏松多孔的结构, 将不利于氨基酸的保存[2]。样品TVG9、 TVG10 同样品TVG5一样均来自热液沉淀物, 主要矿物成分为蛋白石、水羟锰矿和水钠锰矿, 样品中具有相似氨基酸组成, 显示沉积物矿物组分对氨基酸的吸附作用亦可影响氨基酸的组分保存情况, 不同类型沉积物对氨基酸的吸附作用不同, 易于被吸附的氨基酸更容易被保存下来, 反之则易于被降解。
我国科学家在此次科考航次中, 在ABE热液场以北约4海里发现了新的热液喷口活动区域, 该区域发育有大量热液硫化物烟囱群, 生物群落分布较为繁茂。样品TVG14采集于这一区域附近, 样品中不含热液硫化物及生物样品, 推测为非喷口区域采集的样品。样品有较高的TOC含量, 但THAA含量很低, 热液环境下较高的地热温度可能导致了氨基酸的快速降解。样品TVG2、TVG11和TVG14的矿物组分近似一致, 但TVG14氨基酸组分与TVG2、TVG11相比差距甚大, 氨基酸组分的分布很特别, 碱性氨基酸的含量远远高于酸性氨基酸, 且Arg为摩尔百分含量最高的氨基酸, 由于TVG14采样点所临近的热液场发育有大量热液烟囱, 在高温高压下, 沉积物中酸性氨基酸的稳定性不及碱性氨基酸, 而且多肽的水解也可能首先在含酸性氨基酸的位置进行[2], 这可能是造成这一现象的主要原因。但由于样品采集时未对原位热液温度或沉积物温度进行准确测定, 无法对这一推测进行进一步的验证。

图3 ELSC区域样品氨基酸摩尔百分含量组成分布图
3.3 沉积物中有机质降解程度判别
一些氨基酸指标常用来指示海洋沉积物中有机质的降解程度, 如Asp/β-Ala、Glu/γ-Aba、(Phe+Tyr)/ (β-Ala+γ-Aba)以及氨基酸态碳在沉积物中占TOC含量的百分比(TAAC%)等。从图4看, Asp/β-Ala和Glu/γ-Aba两个指标在指示样品有机质降解程度上显示出较为一致的信息, 仅在样品TVG10中存在差别, 有机质降解程度依次为TVG14 > TVG6 > TVG2≈TVG11 > TVG8 > TVG5 > TVG9。对于TVG10样品, Asp/β-Ala显示其为所有样品中新鲜程度最高的, 但Glu/γ-Aba显示它的新鲜程度要略低于TVG9。
然而, 由于有机体中的Asp和Glu的含量是变化的, 并且在很多情况下, Asp和Glu并不仅是通过部分脱羧反应分别降解为β-Ala和γ-Aba, 还可能通过其他降解途径生成其他最终产物[27], 因此, Asp/β-Ala和Glu/γ-Aba这两个指标在复杂沉积环境中的应用有其局限性。一些模拟实验亦表明在高温高压流体条件下进行的Streeker类型反应中检测到了独特的ω-氨基酸产物, 如β-Ala和γ-Aba等, 表明在海底热液环境中存在的部分ω-氨基酸可能是非生物合成的[6], 这种高温条件下非蛋白质氨基酸来源的多重性使得这类指标的应用具有一定的局限性。
TAAC一般随着有机质降解程度的增加而降低, 因此TAAC%可以作为衡量有机质降解程度的参考指标。在极端环境下, 用氨基酸整体指标去降低由于个体氨基酸差异降解引起的判别误差更符合实际。从Asp/β-Ala、Glu/γ-Aba及TAAC%三者表征的样品有机质降解程度看(图4), 结果很不一致。TAAC%显示的有机质降解程度为: TVG11 > TVG14 > TVG9 > TVG5≈TVG2 > TVG6 > TVG10 > TVG8。总的来看, 采集于热液区的 TVG6、TVG8和TVG10样品的有机质均较新鲜, 其他样品经历了较高程度的降解。
从TAAC%提供的有机质降解信息结合样品采集信息来看, 样品中有机质降解程度与采样区域的生物活动性密切相关, 有机质新鲜的样品TVG6、TVG8和TVG10中均见有生物样品或残骸, 热液生物活动的存在使得热液喷口或附近沉积物中氨基酸能得到持续的补充。而在非热液喷口区域采集的样品如TVG11和TVG14, 生物活动匮乏, 在成岩改造作用下, 沉积物有机质降解程度较高。TVG2采样点位于ELSC区域北部, 不在现有已知的热液场区域范围内, 样品未见肉眼可见的热液生物样品, 但有机质含量较高且有机质相对新鲜, 原因有待进一步研究。
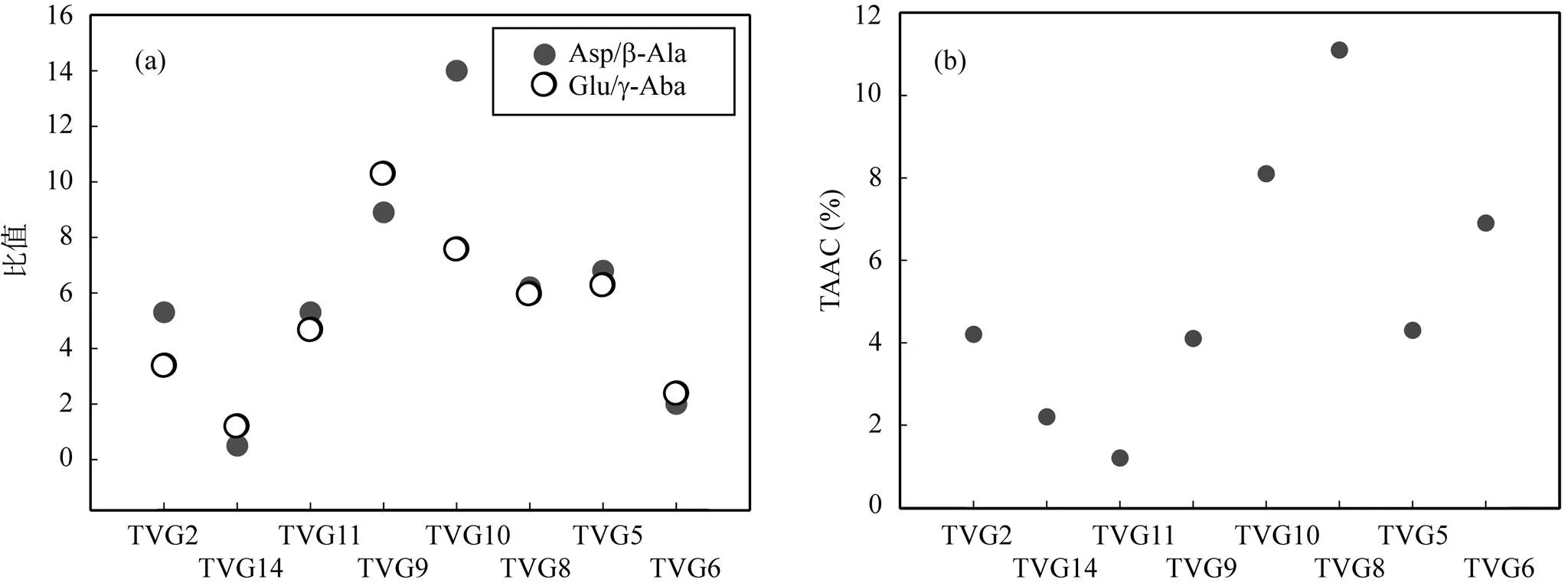
图4 ELSC区域样品中有机质降解程度判别
从ELSC区域样品的研究结果看, 在深海热液环境中, 常规氨基酸有机质降解指标的应用受到了极大的挑战。首先, 深海沉积物的贫有机质、高度降解特征及生物对个别氨基酸的强选择性吸收使得许多样品中个别氨基酸仅为痕量检出或缺失。其次, 深海热液环境高温、高压的极端条件下, 氨基酸的降解可能有多种途径, 如Asp和Glu的降解可能不再以单一的通过酶在α-碳上的脱羧基作用的方式进行。Cox.[28]在模拟的热液环境下进行了Asp动力学反应实验, 结果发现在较低温度下, Asp降解有几种反应途径, 包括去碳酸基反应和聚合反应; 在高温条件下(170℃)Asp发生了更为复杂的反应, 可以同时发生二聚物、环化作用、脱氨基作用和脱羧基作用。这样看来, 依靠个体氨基酸去作为判别有机质降解程度的指标具有不准确性, 即使是利用主成分分析的方法去做统计学上的分析, 也可能因为某些个体氨基酸的缺失而在统计结果上出现偏差。因此, 氨基酸常规指标在热液极端环境中的应用需谨慎。
3.4 氨基酸对映异构体比值
生物体中绝大部分蛋白质氨基酸都是L型氨基酸, 但也存在部分D型氨基酸, 主要作为细菌细胞壁肽聚糖的组成成分, 或某些细菌的代谢产物存在[29]。随着生物体的死亡和分解, L型氨基酸会逐渐向D型氨基酸转化, 这种转化受时间和温度的影响。Hare.在1968年发表的文章中指出, 在地质体中存在着生物体残留的光学活性氨基酸, 这些氨基酸随着地质年龄的增大而趋于完全外消旋化。地质体中氨基酸的D/L比值除了受温度和时间影响外, 其他因素的影响也是不可忽视的[2]。由于生物体中绝大多数蛋白质氨基酸是以L型氨基酸存在的, 样品中低氨基酸D/L值可能指示了较高的生物活动性[6]。在细菌大量繁殖区域可以检测到较高含量的D型氨基酸, 因此氨基酸的D/L比值能够指示热液环境中微生物活动的强弱[30]。
在ELSC区域样品中, 除TVG8外, 热液喷口区域和非热液喷口区样品D/L比值没有显著的区别(图5)。样品TVG8采集于高温热液区域, Asp、Glu和Ser的D/L比值在所有样品中最高, 分别达0.46、0.19和0.81, 其较高的D型氨基酸含量推测主要来自于样品表面覆盖的微生物菌席的贡献。热液活动对TVG8样品中D/L值可能亦有一定的影响, 热液活动区域高的温度加快了氨基酸的消旋化速率使得氨基酸的D/L值增加。

图5 ELSC区域样品中个体氨基酸D/L比值对比
样品TVG5、TVG6和TVG10中THAA含量较高而D/L值相对较低, 指示该区域可能有较强的浮游或底栖生物活动。由于样品TVG5和TVG6采样站点为低温热液区, 温度对氨基酸消旋化造成的影响并不大。样品TVG5中见有大量的蠕虫, 样品TVG6中也见有少量热液生物样品, 对沉积物中氨基酸的贡献以L型氨基酸为主, 是造成样品中相对低的D/L比值的原因之一。但Silfer.对位于南极半岛弧后洋中脊系统边缘盆地的Bransfield Strait热液活动区柱状沉积样品进行的氨基酸分析结果显示在深部的柱状沉积物可能遭遇了热液活动的影响,沉积物中氨基酸混入了热液流体中的游离氨基酸, 这种混合可能会导致沉积物中D/L比值的降低[31]。鉴于TVG5样品中见有良好的热液通道结构, 热液流体中游离氨基酸的影响也可能是造成该样品中D/L值偏低的原因。
TVG2是一个特殊的样品, 其THAA含量和D/L值均较高, 有机质亦比较新鲜, 推测采样点或其附近区域可能存在较强的微生物活动和温度异常。样品TVG14的THAA含量很低, 从TAAC值来看, 有机质降解程度比较高, 但该样品Ala的D/L值是所有样品中最高的, 其他氨基酸对映体比值也在一个较高的水平, 反映了该采样点生物活动性很低, 缺乏底栖动物群落分布, 热液活动环境下的温度因素可能是造成TVG14样点D/L值相对偏高的主要原因。
从ELSC区域样品分析结果来看, 氨基酸D/L比值受生物因素的影响较大, 但由于缺乏各种温度下氨基酸消旋化程度的模拟实验, 缺乏采样点原位温度数据以及热液区生物群落分布情况的相关基础数据, 目前无法准确判定在氨基酸消旋化过程中, D/L值的变化究竟是生物因素还是温度因素为主导, 使得利用D/L值对热液沉积环境中温度和生物活动性的指示意义不确定。
4 结 论
东劳扩张中心表层沉积物样品中有机质含量普遍较低, 热液活动区域原位化能合成作用对沉积物中氨基酸的相对富集有较大的贡献。沉积物中THAA含量的不同与采样点生物群落活动状况和生物群落分布范围有关, 样品矿物组分对氨基酸的保留有一定的影响。
ELSC区域各个热液场表层样品中个体氨基酸的分布均有各自的特征, 采样点不同的热液活动变化、沉积环境温度、生物群落的分布以及样品的矿物组成等因素对氨基酸的组成分布有着重要的影响。
热液极端环境下, 个别常规的判别沉积物中有机质活性的氨基酸指标不再适用, 对此选择TAAC%作为衡量热液沉积物中有机质活性的指标。热液喷口区域沉积物样品有机质新鲜程度普遍高于非热液喷口区域样品, 温度是影响热液环境中氨基酸降解途径的重要因素, 生物群落的活动性对有机质的新鲜程度亦有重要影响。
根据样品中THAA含量、TAAC%及个体氨基酸的D/L比值可以粗略判断生物活动性的大小及细菌对THAA的相对贡献。从ELSC区域的研究结果来看, 仅根据氨基酸的D/L值并不能准确地区分热液喷口活动区域和非热液活动区域在温度和生物活动性上的差异。由于热液环境的极端复杂性, 沉积环境温度变化、生物活动性的大小和生物扰动因素等都可能对D/L值造成很大的影响, 对这一指标在温度和生物活动性的指示意义方面的应用尚不够成熟。
[1] 梁小兵, 万国江, 黄荣贵, 吴沿友. 湖泊沉积物中蛋白质和氨基酸的动态变化[J]. 矿物学报, 2001, 21(1): 59-63. Liang Xiao-bing, Wan Guo-jiang, Huang Rong-gui, Wu Yan-you. Dynamic study of protein and amino acids in lake sediments[J]. Acta Mineral Sinica, 2001, 21(1): 59-63 (in Chinese with English abstract).
[2] 王将克, 陈水挟, 钟月明. 氨基酸生物地球化学[M]. 北京: 科学出版社, 1991: 1-308. Wang Jiang-ke, Chen Shui-xie, Zhong Yue-ming. Amino Acid Biogeochemica[M]. Beijing: Science Press, 1991: 1-308 (in Chinese).
[3] Alfred N N M, Claude H M. Burial rates of organic matter along the eastern Canadian margin and stable isotope constraints on its origin and digenetic evolution[J]. Mar Geol, 1999, 160(3/4): 251-271.
[4] 马兰花, 段毅, 宋之光. 南沙海域柱状沉积物中氨基酸组成和含量特征与古环境[J]. 沉积学报, 1999, 17(增刊): 794-797. Ma Lan-hua, Duan Yi, Song Zhi-guang. Compositions and contents of amino acids in core sediments from Chinese Nansha Sea Area and paleoenvironment[J]. Acta Sedimentol Sinica, 1999, 17(suppl): 794-797 (in Chinese with English abstract).
[5] 郑士龙, 唐运千, 龚敏. 南海中部和冲绳海槽沉积物中的氨基酸物质[J]. 东海海洋, 1993, 11(2): 34-42. Zheng Shi-long, Tang Yun-qian, Gong Min. The amino acids in the sediment from central South China Sea and Okinawa Trough[J]. Donghai Mar Sci, 1993, 11(2): 34-42 (in Chinese with English abstract).
[6] Takano Y, Horiuchi T, Marumo K, Nakashima M, Urabe T, Kobayashi K. Vertical distribution of amino acids and chiral ratios in deep sea hydrothermal sub-vents of the Suiyo Seamount, Izu-Bonin Arc Pacific Ocean[J]. Org Geochem, 2004, 35(10): 1105-1120.
[7] Horsfall I M, Wolff G A. Hydrolysable amino acids in sediments from the Porcupine Abyssal Plain, northeast Atlantic Ocean[J]. Org Geochem, 1997, 26(5/6): 311-320.
[8] Lomstein B A, Jørgensen B B, Schubert C J, Niggemann J. Amino acid biogeo- and stereochemistry in coastal Chilean sediments[J]. Geochim Cosmochim Acta, 2006, 70(12): 2970-2989.
[9] Uhle M E, Sikes E L, Nodder S D, Pilditch C A. Sources and digenetic status of organic matter in the Hauraki Gulf, New Zealand: Evidence from the carbon isotopic composition of d- and l-amino acids[J]. Org Geochem, 2007, 38(3): 440-457.
[10] Andersson E, Simoneit B R T, Holm N G. Amino acid abundances and stereochemistry in hydrothermally altered sediments from the Juan de Fuca Ridge, northeastern Pacific Ocean[J]. Appl Geochem, 2000, 15(8): 1169-1190.
[11] Michael P, Seewald J. Focus On: Studies at the Lau Basin[J]. Ridge 2000 Events, 2007, 2(1): 11-21.
[12] Vasanits A, Kutlán D, Sass P, Molnar-Perl I. Retention/quantization properties of the o-phthaldialdehyde-3- mercaptopropionic acid and the o-phthaldialdehyde-N-acetyl- L-cysteine amino acid derivatives in reversed-phase high- performance liquid chromatography[J]. J Chrom A, 2000, 870(1/2): 271-287.
[13] Molnár P I, Bozor I. Comparison of the staility and UV and fluorescence characteristics of the o-phthaldialdehyde/ 3-mercaptopropionic acid and o-phthaldialdehyde/N-acetyl- L-cysteine reagents and those of their amino acid derivatives[J]. J Chrom A, 1998, 798(1/2): 37-46.
[14] 杨桂朋, 李静, 高先池, 陆小兰. 高效液相色谱法测定海水中溶解态游离氨基酸[J]. 中国海洋大学学报, 2007, 37(1): 125-128. Yang Gui-peng, Li Jing, Gao Xian-chi, Lu Xiao-lan. High performanceliquidchromatographicdeterminationofdissolved free amino acids in seawater [J]. Period Ocean Univ China, 2007, 37(1): 125-128 (in Chinese with English abstract).
[15] Brückner H, Westhauser T, Godel H. Liquid chromatographic determination of D- and L-amino acids by derivatization with o-phthaldialdehyde and N-isobutyryl-L-cysteine applications with reference to the analysis of peptidic antibiotics, toxins, drugs and pharmaceutically used amino acids[J]. J Chrom A, 1995, 711(1): 201-215.
[16] Kaufman D S, Manley W F. A new procedure for determining DL amino acid ratios in fossils using reverse phase liquid chromatography[J]. Quatern Geochronol, 1998, 17(11): 987-1000.
[17] Fitznar H P, Lobbes J M, Kattner G. Determination of enantiomeric amino acids with high-performance liquid chromatography and pre-column derivatisation with o-phthaldialdehyde and N-isobutyrylcysteine in seawater and fossil samples (mollusks) [J]. J Chrom A, 1999, 832(1/2): 123-132.
[18] Rushdi1 A I, Simoneit B R T. Hydrothermal alteration of organic matter in sediments of the Northeastern Pacific Ocean: Part 2. Escanaba Trough, Gorda Ridge [J]. Appl Geochem, 2002, 17(11): 1467-1494.
[19] Yamanaka T, Sakata S. Abundance and distribution of fatty acids in hydrothermal vent sediments of the western Pacific Ocean[J].Org Geochem, 2004, 35(5): 573-582.
[20] 杨伟芳. 不同海洋环境中沉积物脂类生物标志物的对比研究[D].广州: 中国科学院广州地球化学研究所, 2009. Yang Wei-fang. Compositions of lipid biomarkers in sediments from different marine environments[D]. Guangzhou: Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, 2009 (in Chinese with English abstract).
[21] 李日辉, 侯贵卿. 深海热液喷口群落的研究进展[J]. 海洋地质与第四纪地质, 1999, 19(4): 103-108. Li Ri-hui, Hou Gui-qing. Research advances in deep-sea hydrothermal vent communities[J]. Mar Geol Quatern Geol, 1999, 19(4): 103-108 (in Chinese with English abstract).
[22] Svensson E, Skoog A, Amend J P. Concentration and distribution of dissolved amino acids in a shallow hydrothermal system, Vulcano Island (Italy)[J]. Org Geochem, 2004, 35(9): 1001-1014.
[23] Pantoja S, Lee C. Amino acid remineralization and organic matter lability in Chilean coastal sediments[J]. Org Geochem, 2003, 34(8): 1047-1056.
[24] Dauwe B, Middelburg J J. Amino acids and hexosamines as indicators of organic matter degradation state in North Sea sediments[J]. Limnol Oceanogr, 1998, 43(5): 782-798.
[25] Miho I, Lallan P G, Harue M, Hodaka K.Thermal stability of amino acids in seafloor sediment in aqueous solution at high temperature[J]. Org Geochem, 2006, 37(2): 177-188.
[26] Bernd R T S. Prebiotic organic synthesis under hydrothermal conditions: An overview[J]. Adv Space Res, 2004, 33(1): 88-94.
[27] Cowie G L, Hedges J I. Biochemical indicators of diagenetic alteration in natural organic matter mixtures[J]. Nature, 1994, 369(26): 304-307.
[28] Cox J S, Seward T M. The hydrothermal reaction kinetics of aspartic acid[J]. Geochim Cosmochim Acta, 2007, 71(4): 797-820.
[29] 王镜岩, 朱圣庚, 徐长法. 生物化学(第三版)[M]. 北京: 高等教育出版社, 2002: 123-156. Wang Jing-yan, Zhu Sheng-geng, Xu Chang-fa. Biochemica (3rd ed) [M]. Beijing: Higer Education Press, 2002: 123-156 (in Chinese).
[30] HoriuchiT, Takano Y, Ishibashi J I, Marumo K, Urabe T, Kobayashi K. Amino acids in water samples from deep sea hydrothermal vents at Suiyo Seamount, Izu-Bonin Arc, Pacific Ocean[J]. Org Geochem, 2004, 35(10): 1121-1128.
[31] Silfer J A, Engel M H, Macko S A. The effect of hydrothermal processes on the distribution and stereochemistry of amino acids in Recent Antarctic sediments[J]. Appl Geochem, 1990, 5(1/2): 159-167.
Amino acid composition and its biogeochemical significance in sedimentsfrom the Eastern Lau Spreading Center, South Pacific Ocean
WANG Li-ling1,2, YANG Qun-hui3, FU Shao-ying4and HU Jian-fang1*
1. State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China; 2. Graduate University of Chinese Academy of Sciences, Beijing 100049, China; 3. State Key Laboratory of Marine Geology, Tongji University, Shanghai 200092, China; 4. Guangzhou Marine Geological Survey, the Ministry of Land and Resources of China, Guangzhou 510630, China
The total hydrolysable amino acid (THAA), the ratios between D and L of amino acids (D/L) and the total organic carbon (TOC) were analyzed in surface sediments taken from the Eastern Lau Spreading Center (ELSC), South Pacific Ocean. The contents, sources and degree of decomposition of the organic matter (OM) in sediments have been investigated. The D/L ratios of amino acids were used to indicate the biological activity and temperature variation in hydrothermal field. The results showed that the contents of TOC and THAA in sediments were in the range of 0.70 – 2.15 mg/g (dry weight) and 30 – 511 μg/g (dry weight), respectively. The chemosynthetic-based in-suit community’s productivity in the hydrothermal systems contributed significant composition to the relative enrichment of THAA. The contents of THAA of the sediments were related to the in-suit community’s activity and composition, and the mineral composition of the sediments. The compositions of amino acids in sediments were different from each site for different hydrothermal system, because different hydrothermal system exhibits different hydrothermal activity, mineral composition of the sediments, and biological community. The percentage of organic carbon normalized to amino acid carbon (TAAC%) could be used to indicate the degree of degradation of sedimentary OM. The TAAC% showed that activity of OM in the hydrothermal vent fields was higher than those in non-hydrothermal vent fields. Relatively high temperature in the hydrothermal fields might influence the degradation path way of amino acids. The D/L ratios of aspartic acid (Asp), glutamic acid (Glu), serine (Ser) and alanine (Ala) in sediments showed a wide range, for example, the D/L ratios of Asp, Glu, Ser and Ala were 0.08 – 0.46, 0.06 – 0.19, 0.01 – 0.81 and 0.10 – 0.30, respectively. According to the contents of THAA, TAAC% and the D/L ratio of individual amino acid, the biological activity of biomass and the relative contribution of the THAA of bacteria could be assessed. However, it cannot be accurately distinguished between the hydrothermal active fields and non-hydrothermal active fields on the temperature and biological activities just by the composition of the amino acid.
hydrothermal; sediment; amino acid; degree of degradation; biological activity; South Pacific Ocean
P593
A
0379-1726(2012)01-0023-12
2011-01-26;
2011-07-20;
2011-09-19
中国科学院知识创新工程重要方向项目(KZCX2-YW-JC103); 中国科学院广州地球化学研究所人才基金项目(GIGRC-09-02); 国家自然科学基金(40976025); 国际海底区域研究开发“十一五”项目(DYXM-115-02 -4-04)
王丽玲(1983–), 女, 硕士, 环境科学专业。E-mail: wangliling24@163.com
HU Jian-fang, E-mail: hujf@gig.ac.cn, Tel: +86-20-85290163

