单增李斯特菌多克隆抗体制备及其在乳胶凝集试验中的应用
鞠 文,宋秀玲,原 野,张士尧,方 珍,徐 坤,李 娟,孟日增,3
(1.吉林大学公共卫生学院卫生检验教研室,吉林 长春 130021;2.吉林大学军需科技学院食品质量与安全教研室,吉林 长春 130012;3.吉林出入境检验检疫局检验检疫技术中心,吉林 长春 130062)
单增李斯特菌多克隆抗体制备及其在乳胶凝集试验中的应用
鞠 文1,宋秀玲1,原 野1,张士尧1,方 珍2,徐 坤1,李 娟1,孟日增1,3
(1.吉林大学公共卫生学院卫生检验教研室,吉林 长春 130021;2.吉林大学军需科技学院食品质量与安全教研室,吉林 长春 130012;3.吉林出入境检验检疫局检验检疫技术中心,吉林 长春 130062)
目的:制备高效价高纯度兔抗单增李斯特菌(LM)多克隆抗体,并初步探讨其在乳胶凝集试验(LAT)中的应用。方法:复苏并扩大培养LM标准菌株,制备灭活疫苗免疫家兔,采用ELISA法测定耳缘静脉血抗体效价。4次免疫后,颈动脉采血分离血清,采用辛酸-饱和硫酸铵法粗分离,经蛋白亲和层析柱HiTrap Protein G HP进行IgG纯化,采用SDS-PAGE电泳、紫外分光光度法、间接ELISA法分别测定蛋白纯度、蛋白含量及抗体效价。得到的高效价提纯IgG与乳胶微球进行共价偶联,并选择偶联乳胶的IgG含量及偶联时间等条件,建立快速检测模拟样品中LM的方法。结果:制备并纯化的兔抗LM IgG蛋白浓度为23.364g·L-1,效价为1∶12 800~1∶25 600,与霍乱弧菌、沙门氏菌、志贺菌等多种菌均无交叉反应,与斯氏李斯特菌有弱交叉反应;致敏时IgG与乳胶微球偶联比率为1∶40;利用LAT方法检测246份样品,阳性检出率为87.5%,最低检出抗原含量为0.039 8g·L-1。结论:制备了高效价、高纯度的兔抗LM多克隆抗体;建立的LAT方法特异性强,敏感性较高,重复性好,便于基层推广使用,为LM的现场检测提供了一种新手段。
单增李斯特菌;多克隆抗体;乳胶凝集试验
单核细胞增生性李斯特菌(Lislefia monocylogenes,LM)是对人致病性最强的李斯特菌种,由此引起的食源性疾病也越来越多见,已成为重要的食源性病原菌之一[1],主要引起脑膜炎、败血症、流产、中枢神经系统感染等严重的疾病,其中孕妇感染后经胎盘或产道感染胎儿或新生儿是该病的重要特点之一,病死率高,达30%~40%[2-3],特别是在孕妇、老年人、幼儿及机体免疫力低下的人群,死亡率可以达到70%[4],已成为仅次于沙门氏菌感染的第2号致命性食源性病原菌[5],是目前国际上公认的卫生监测指示菌,也是世界卫生组织列入的四大食品致病菌之一。有数字显示:美国每年约有1600人感染李斯特菌,255人死亡[6]。2011年9月底美国发生的毒甜瓜事件就是由于哈密瓜中感染了单增李斯特菌而引起,导致133人被感染,23人死亡,对孕妇的危害还尚难以估量[7]。自1993年以来,我国也不断有该菌的检出报道,涉及北京、辽宁、云南、江苏、河南、重庆、福建、湖南、浙江、四川等多个省份[8-10]。近年来,进口肉类食品中不断有该菌的检出[11],国家质检总局警示禁止进口欧美等地不合格肉类食品。LM的高抵抗力、高检出性、高病死率、高危害性已成为危害公民健康的巨大威胁,检测食品中的LM显得尤为必要和重要,因此建立一种快速准确的检测技术已成为公共卫生检测领域的一个重点课题。本研究拟制备高效价高纯度的兔抗LM多克隆抗体,并与乳胶微球进行偶联,初步探讨其在乳胶凝集试验快速检测病原菌方面的应用。
1 材料与方法
1.1 菌株
LM标准菌株(ATCC19111)及霍乱弧菌、沙门氏菌、志贺菌等菌株,由吉林出入境检验检疫局技术中心微生物实验室提供。
1.2 实验动物
健康新西兰大白兔,雌性,1~2月龄,体质量(2.0±0.2)kg,购自吉林大学动物实验中心。
1.3 主要试剂
胰酪胨大豆酵母浸膏琼脂培养基和营养琼脂培养基购自北京陆桥公司,弗氏完全佐剂、弗氏不完全佐剂和10%聚苯乙烯乳胶购自美国Sigma公司,HiTrap Protein G HP蛋白纯化柱购自GE公司。
1.4 LM灭活抗原制备
按 GB/T 4789.30-2010中方法培养[12],以全自动细菌生化鉴定系统(vitek-2)进行鉴定后,用生理盐水洗下菌苔制成菌悬液,取1mL 10倍倍比稀释平板倾注法计数并调节菌悬液浓度为1×109cfu·mL-1,用 0.3% 的甲 醛 4℃ 下灭活24h,再用超声裂解法进一步灭活细菌,平板倾注法进行活菌计数检验是否灭活完全。核酸蛋白检测仪检测两菌悬液蛋白含量。灭活抗原存于4℃低温冰箱中备用。
1.5 动物免疫
购置的健康雌性新西兰大白兔于动物室适应性饲养7d,无异常。首次免疫以浓度为2×108cfu·mL-1菌体与等量弗氏完全佐剂乳化完全,每只取1mL背部皮下五点注射,间隔2周后用等剂量的弗氏不完全佐剂疫苗采用同样方法加强免疫2次,免疫剂量1×108cfu·mL-1×1mL,取血前1周用1×109cfu·mL-1灭活菌苗1mL加强免疫1次。颈动脉采血,分离血清,测定效价。
1.6 多克隆抗体IgG的提纯与鉴定
采用辛酸-饱和硫酸铵法粗提取IgG[13]。将粗提的IgG浓缩后加入到蛋白亲和层析柱HiTrap Protein G HP,用AKTA蛋白纯化仪进行纯化。通过对洗脱条件的优化进行特异IgG蛋白的收集。获得的目的蛋白采用超滤离心进行浓缩,用紫外分光光度法测定蛋白含量,用SDS-PAGE电泳进行纯度鉴定,间接ELISA法测定其效价,并选择志贺菌、沙门氏菌、空肠弯曲菌、粪肠球菌、绿脓杆菌、霍乱弧菌、坂崎肠杆菌及李斯特菌种中的6个属抗原包被酶标板,进行特异性测定。
1.7 兔抗LM IgG与乳胶颗粒的偶联
取10%的聚苯乙烯乳胶0.5mL,加入硼酸缓冲液(pH8.2)4.5mL,混匀制备成1%的乳胶悬液。向上述制备好的乳胶悬液中加入1∶40稀释的兔抗LM多克隆抗体,当出现凝集现象后继续加入,直至凝集现象消失,悬液呈均一稳定的状态,5 000r·min-1离心30min,硼酸盐缓冲液洗涤3次后稀释成原来体积混匀备用,同时制备阴性血清的致敏微球作为对照。
2 结 果
2.1 LM的复苏活化及鉴定
培养的目的菌经全自动生化鉴定系统VITEK-2鉴 定 结 果:AMY、NOVO、OPTO、PIPLC、TyrA、NC6.5、SAL、NAG、dMNE 、dMAL、MBdG、dTRE、AGLU、BACI 为 阳 性 (+),APPA、LeuA、AlaA、dRIB、dRAF、CDEX、ProA、ILATk、dXYL、AspA、BGURr、dSOR、LAC、dMAN、ADH1、BGAR、AGAL、NRE、SAC、BGAL、AMAN、PyrA、POLYB、PHOS、BGUR、dGAL、PUL、ADH2s 为 阴 性 (-),O129R为疑似阴性(-),LM符合率为94%。
2.2 兔抗LM血清分离及效价测定
以采血时间间隔为横坐标,血清抗体效价吸光度值比值P/N为纵坐标绘制曲线,可见随着免疫次数的增加,抗体效价逐渐升高(图1)。最终抗体效价≥1∶6 400(表1)。

图1 兔免疫血清抗体消长Fig.1 The growth progress of the antibody titer of rabbit serum
表1 兔血清抗体效价测定Tab.1 The detection of antibody titer of rabbit serum (±s)

表1 兔血清抗体效价测定Tab.1 The detection of antibody titer of rabbit serum (±s)
Antibody Rabbit No.One week after the 4th immunization 1<titer of rabbit serum Pre-immunization Before the 2nd immunization Before the 3rd immunization Before the 4th immunization 1∶100 1∶200 1∶1 600 1∶6 400 1∶6 400 2<1∶100 1∶200 1∶1 600 1∶6 400 1∶6 400 3<1∶100 1∶200 1∶3 200 1∶6 400 1∶12 800
2.3 兔抗LM IgG的纯化结果
利用蛋白亲和层析柱HiTrap Protein G HP在AKTA蛋白纯化仪中对粗提IgG进行分离提纯,通过对洗脱条件的优化,最终采用35%洗脱液洗脱峰1洗脱下来,当洗回基线时改用100%的洗脱液将洗脱峰2洗脱下来 (图2)。两峰蛋白经ELISA及SDS-PAGE电泳检测,最终确定100%洗脱液的洗脱峰为目的蛋白峰。
2.4 兔抗LM IgG鉴定
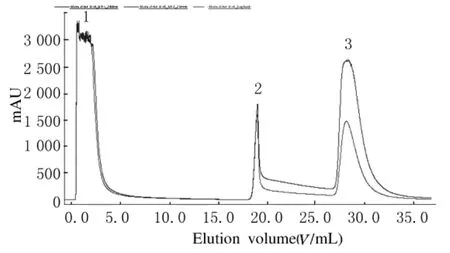
图2 兔抗LM IgG的分离提纯结果Fig.2 The results of isolation and purification of anti-LM rabbit IgG
2.4.1 IgG纯度鉴定 分别将粗提前、粗提后与纯化后兔抗LM IgG经SDS-PAGE电泳纯度测定:经蛋白纯化仪纯化后,蛋白条带清晰,纯度较高,含有IgG的2条目的条带 (图3)。目的条带分别为重链(46 000~58 000)和轻链(17 000~25 000),相对分子质量约为150 000,与文献报道相符[13]。
2.4.2 IgG蛋白含量测定 采用紫外分光光度法分别测定吸光度 A280与 A260,利用公式1.45×A280-0.74×A260计算蛋白含量。兔抗LM多克隆抗体纯化前蛋白浓度为79.915g·L-1,粗提蛋白浓度为50.778g·L-1,蛋白回收率为63.54%。粗提后的血清经蛋白纯化仪进行纯化,上样量每次2mL,经5次经超滤浓缩得浓缩样,蛋白回收率为2.92%。结果见表2。
2.4.3 效价测定 采用间接ELISA法对纯化前后IgG效价进行测定,阳性血清A值/阴性血清A值(P/N)大于2.1的血清最高稀释倍数为效价。未纯化血清、粗提后和纯化后抗体效价分别为:1∶12 800、1∶12 800和1∶25 600。见表3。
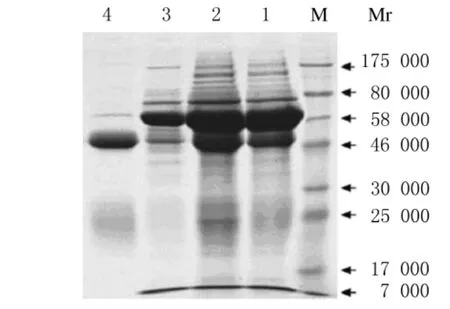
图3 兔抗LM血清纯化前后SDS-PAGE电泳图Fig.3 SDS-PAGE of anti-LM rabbit serum before and after purification
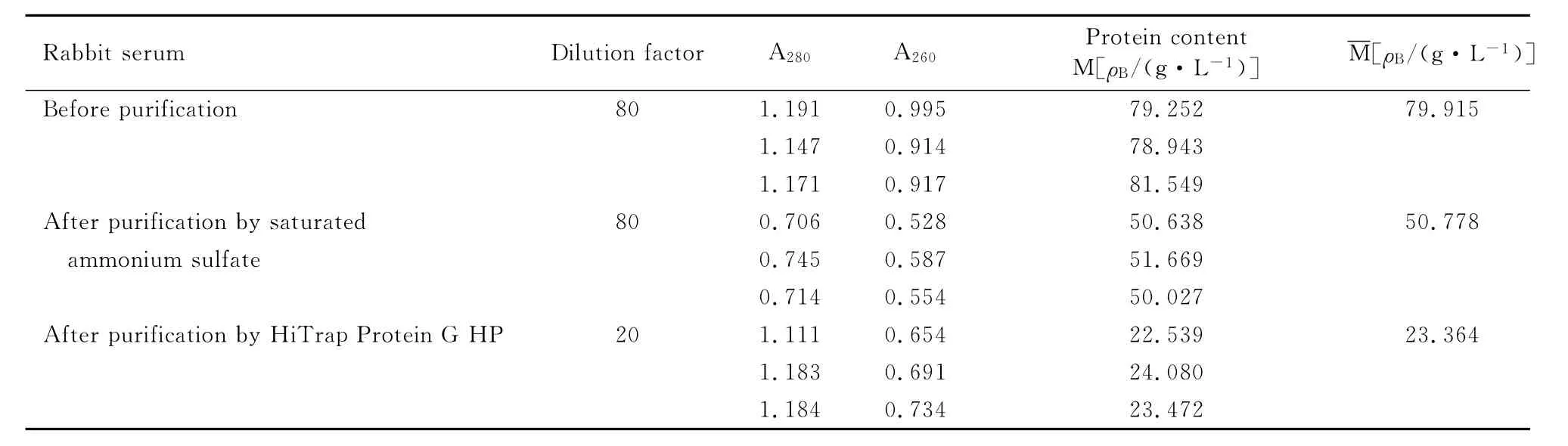
表2 兔血清纯化前后蛋白含量测定结果Tab.2 The results of protein content of rabbit serum before and after purification
2.4.4 特异性测定 选择实验室保存的13株菌株分别包被ELISA板,测定纯化后的IgG与其反应,仅李斯特菌种中的威尔斯氏菌属呈阳性,其他为阴性,而LM呈明显的阳性反应。结果见表4。
2.5 乳胶凝集试验测定结果
2.5.1 自凝试验结果 用纯化后的IgG致敏乳胶后,进行乳胶凝集试验,阳性及阴性血清致敏微球在生理盐水中均不发生自凝,说明致敏乳胶在生理盐水中稳定性良好。
2.5.2 敏感性试验结果 当抗原稀释64倍时阳性血清致敏微球凝集试验阳性,即乳胶凝集试验的灵敏性达0.039 8g·L-1,而当抗原稀释倍数为8时,普通的平板凝集试验即为阴性,灵敏性仅为0.637g·L-1,表明乳胶凝集试验的灵敏性高于普通凝集试验。结果见表5。

表3 ELISA测定纯化前后兔抗LM血清抗体效价Tab.3 Titers of rabbit anti-LM serum before and after purification by ELISA
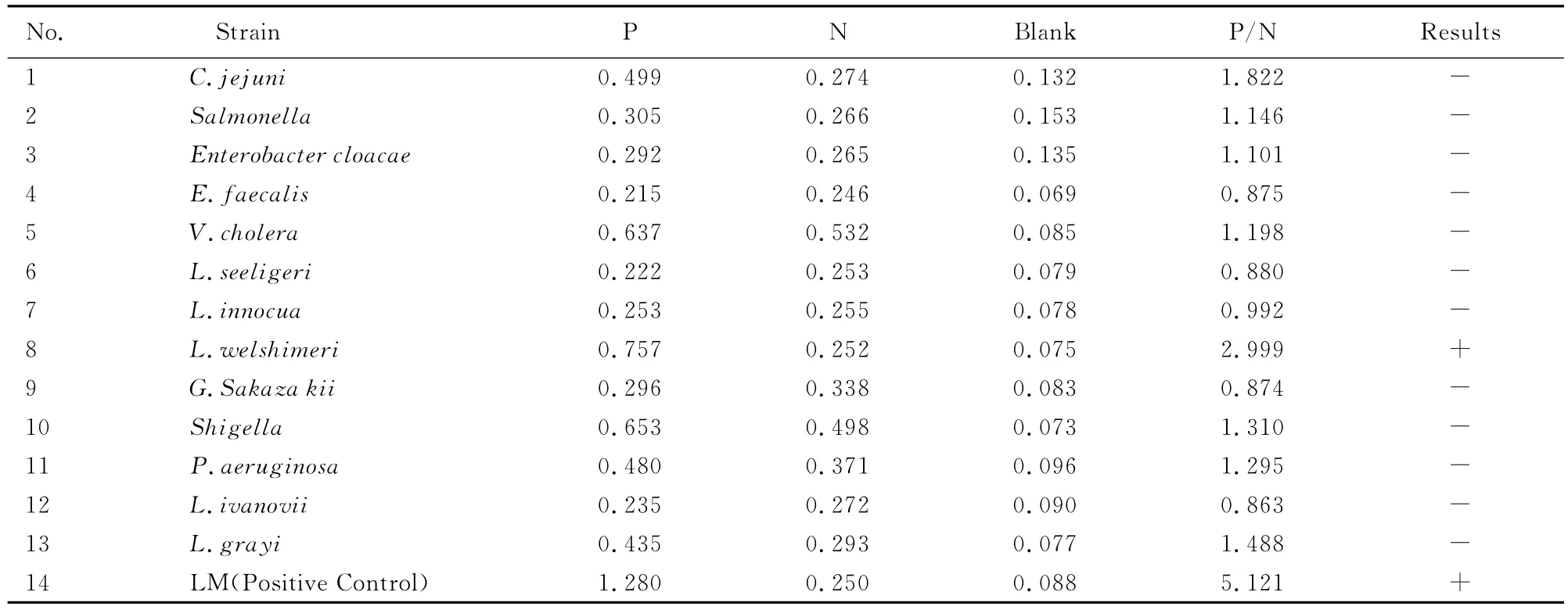
表4 兔抗LM IgG特异性鉴定结果Tab.4 Specific identification results of rabbit anti-LM IgG

表5 LAT的敏感性试验Tab.5 The sensitivity test of LAT
2.5.3 特异性测定 实验制备的LM抗体致敏乳胶微球不与空肠弯曲菌、沙门氏菌、阴沟杆菌、粪肠球菌、霍乱弧菌、西尔李斯特菌 (L.seeligeri)、英诺克李斯特菌 (L.innocua)、威尔斯李斯特菌(L.welshimeri)、坂崎肠杆菌、志贺菌属、绿脓杆菌、绵羊李斯特菌 (L.ivanovii)、无害李斯特菌13种菌株抗原发生乳胶凝集反应,而与LM呈明显的凝集反应,表明特异性良好。
2.5.4 稳定性测定 对同一时间致敏乳胶微球在4℃保存半年过程中,多次进行乳胶凝集试验,与LM抗原反应结果均阳性,且灵敏性变化不大,与非LM抗原不发生凝集,表明批内稳定性良好;不同时间制备的致敏乳胶同时进行乳胶凝集试验,与LM抗原反应结果均为阳性,与非LM抗原不发生凝集,表明批间稳定性良好。
2.6 实际样品检测结果
用LAT对246份已知样品进行检测,并与GB/T 4789.30-2010检测方法进行比较,阳性符合率为87.5%。见表6。

表6 LAT和GB两种方法检测实际样品结果Tab.6 The detection results of the samples by two methods of LAT and GB
3 讨 论
到目前为止,由LM引起的食物中毒事件在世界各地均有发生,给国家和社会带来了巨大的财产和精神损失。WHO曾在LM食品中毒事件报道[14]中指出:4%~8%的水产品、5%~10%的奶及其产品、30%以上的肉制品及15%以上的家禽均有该菌的污染。因此建立快速、准确、灵敏的检测技术对于加强出入境食品安全,保证人类健康具有重要意义。本文作者采用背部五点注射法免疫新西兰兔,每次免疫前收集耳缘静脉血测定效价,经4次免疫后效价达到最高。颈动脉采血收集兔血清,采用不同的纯化方法,最终确定辛酸-饱和硫酸铵法粗提取的兔血清纯度低,用蛋白亲和层析柱HiTrap Protein G HP联合AKTA蛋白纯化仪对粗提IgG进行进一步分离提纯,通过ELISA及SDS-PAGE电泳证实抗体的高效价及高纯度。将制备的抗体与乳胶颗粒进行偶联,并对偶联条件进行了摸索,初步用于乳胶凝集试验。本研究结果为单克隆抗体标记乳胶微球的制备及应用奠定了基础,有望替代国家标准中的玻片凝集试验用于食品中LM的快速检测。
[1]张子平.李斯氏菌-一种适冷性食物中毒细菌 [J].肉类工业,2000,226 (4):34.
[2]Birte FV,Hans HH,Bente O,et al.Elucidation of Listeria monocytongenes contramination routes in cold-smoked salmon processing plants detected by DNA-based typing methods [J].Appl Environ Microbiol,2001,67 (6):2586-2595.
[3]Laemynck GV,Lafarge V,scotter S.Improvement of the detection of Listeria monocytogenes by the application of ALOA adiag-nostic chromogenic isolation medium [J].J Appl Microbiol,2000,88 (3):430-441.
[4]Klinger G,Beyene I,Shah P,et al.Do hyperoxaem in and hypocapnia add to the risk of brain injury after intrapartum asphyxia [J].Arch Dis Child,2005,90 (1):49-52.
[5]周晓辉,焦耨安.单核细胞增生症李斯特杆菌分子亚分型及其应用 [J].动物医学进展,2003,24 (3):44-47.
[6]Scallan E,Hoekstra RM,Angulo FJ,et al.Foodborne illness acquired in the United States-major pathogens [J].Emerg Infect Dis,2011,17 (7):7-15.
[7]秦少青.近年国外发生的几起食源性传染病 [J].兽医卫生,2011,27 (12):16-17.
[8]邵美丽,杨 帆,刘 娣.食品中单核细胞增生性李斯特菌的污染及耐药现状 [J].黑龙江畜牧兽医:科技版,2009,52 (11):21-22.
[9]周良君,陈 果,江智辉,等.2010年绵阳市食品中单增李斯特菌的污染状况及耐药性监测 [J].职业与健康,2011,27 (20):2330-2332.
[10]荆红波,杨 杰,张彦春.2009年顺义区食品中单增李斯特菌污染及耐药状况调查 [J].中国卫生检验杂志,2010,20 (7):1775-1777.
[11]梁启平,陈健舜,陈巧妙,等.进口水产品中单增李斯特菌的分子流行病学特点 [J].微生物学报,2009,49(6):766-772.
[12]中华人民共和国卫生部.GB/T4789.30-2010.食品卫生微生物学检验单核细胞增生李斯特氏菌检验 [S].北京:中国标准出版社,2010.
[13]武 薇,韩克光.两种方法纯化兔抗绵羊肺炎支原体IgG的比较 [J].中国动物检疫,2010,27 (2):31-32.
[14]刘生杰,余为一.免疫球蛋白IgG和IgM分离纯化技术现状与展望 [J].阜阳师范学院学报:自然科学版,2006,23 (3):27-31.
Preparation of anti-Listeria monocytogenes polyclonal antibody and its application in latex agglutination test
JU Wen1,SONG Xiu-ling1,YUAN Ye1,ZHANG Shi-yao1,FANG Zhen2,XU Kun1,LI Juan1,MENG Ri-zeng1,3
(1.Department of Health Laboratory,School of Public Health,Jilin University,Changchun 130021,China;2.Department of Food Quality and Safety,School of Quartermaster Technology,Jilin University,Changchun 130012,China;3.Inspection and Quarantine Technical Center,Jilin Entry-Exit Inspection and Quarantine Bureau,Changchun 130062,China)
Objective To prepare the anti-Listeria monocytogenes(LM)polyclonal antibody derived from rabbit and to study the application of LM in latex agglutination test(LAT).Methods Standard LM strain were cultured and multiplied using selective agents and enrichment procedures.Freund’s complete inactivated vaccine and Freund’s incomplete inactivated vaccine were made for immunizing rabbits.Blood samples were collected from the marginal ear vein and the antibody titers were measured by ELISA.Four times after immunization,blood serum was separated from the carotid artery and crude IgG was purified by using the method of caprylic acid-sulfide saturated soution precipitation.IgG molecules were purified by using the HiTrap Protein G chromatography column on AKTA Protein purification device and identified using the methods of SDS-PAGE electrophoresis, UV spectrophotometry,and indirect ELISA.Purified IgG were covalent conjuncted with latex microspheres and the content of latex and interaction time were optimized.The method was established for rapid detection of LM in simulated samples.Results The protein content of the purified anti-LM IgG was 23.364g·L-1and its antibody titer was 1∶12 800-1∶256 00,no cross-reaction occured with a variety of bacteria such asVibriocholerae,Salmonella,Shigella,but a weak cross-reaction withSteinmannListeriamonocytogenes.The covalent conjuncted ratio of IgG on the latex microspheres was 1∶40and the positive rate was 87.5%for detetion in 246samples by the method of LAT.The minimum detectable content of the antigen was 0.039 8g·L-1.Conclusion LAT is a promising method to facilitate the grassroots level for field testing LM with its specificity,high sensitivity and good reproducibility.
Lislefia monocylogenes;polyclonal antibody;latex agglutination test
R155
A
1671-587Ⅹ(2012)05-0821-06
2011-04-11
国家自然科学基金资助课题 (81072337);国家质检总局科技基金资助课题 (2010IK018);吉林省科技厅科研基金资助课题 (YYZX201123-2);“2012年吉林大学研究生创新研究计划”资助课题 (20121120)
鞠 文 (1986-),女,山东省临沂市人,在读医学硕士,主要从事卫生检验方面的研究。
李 娟 (Tel:0431-85619419,E-mail:li_juan@jlu.edu.cn);
孟日增 (Tel:0431-87607284,E-mail:mrz1975@163.com)
时间:2012-08-31 10:50
网络出版地址:http://www.cnki.net/kcms/detail/22.1342.R.20120831.1050.001.html

