PDCD4在非小细胞肺癌中的表达及临床意义
刘启明
(江苏省睢宁县人民医院呼吸内科 江苏 睢宁 221200)
程序性细胞死亡因子4(PDCD4)是1995年Shibahara等在小鼠体内发现的与细胞凋亡有关的基因,不仅对细胞的程序性死亡进行重要调节,而且通过抑制蛋白转录和翻译过程抑制肿瘤细胞的生长。PDCD4与多种肿瘤的发生与发展有关,Jansen AP等[1]检测了60种来自肾脏、肺脏、结肠、乳腺以及神经胶质细胞的肿瘤细胞系中PDCD4的表达情况,结果显示,PDCD4在mRNA水平和蛋白水平上均有表达降低或缺失。有研究资料[2]显示,在肺癌组织中PDCD4缺失率高达83%,而且与肿瘤的恶性程度、TNM分期以及预后不良密切相关。本实验采用免疫组织化学技术检测NSCLC组织中PDCD4蛋白表达情况,并探讨蛋白的表达与患者临床特征的关系。为探讨PDCD4在NSCLC中的发病机制、病理诊断、预后价值以及选择治疗的靶点提供一定的理论依据。
1 资料与方法
1.1 一般资料 选择潍坊市人民医院胸外科2006年8月~2010年3月手术切除的NSCLC标本54例,其中男33例,女21例;<60岁的28例;≥60岁26例;有长期吸烟史22例,无吸烟史32例;鳞癌25例,腺癌29例;高分化11例,中分化31例,低分化12例;Ⅰ期 22例,Ⅱ期10例,Ⅲ ~Ⅳ期22例(依据2002UICC肺癌TNM分期标准)。并分别取癌旁组织(远离癌灶5CM以上)24例。所有组织标本使用中性甲醛固定,石蜡包埋备用。
1.2 方法
1.2.1 主要仪器及来源。YB-6LF智能型生物组织包埋机(湖北省孝感市亚光医用电子技术有限公司)、PHY-Ⅱ病理组织凉烘仪(常州市中威电子仪器公司)、BX41光学显微镜(日本OLYMPUS公司)、BX-51型生物光学显微镜及照相系统(日本OLYMPUS公司)。
1.2.2 药品与试剂。鼠抗人PDCD4一抗(北京博奥森生物工程有限公司)、鼠抗人DNMT1一抗(北京博奥森生物工程有限公司)、sABC免疫组织化学染色试剂盒(北京博奥森生物工程有限公司)、DAB显色试剂盒(武汉博士德生物工程有限公司)。
1.2.3 实验用溶液配制。①中性甲醛固定液配制:甲醛10mL、0.01MPBS 90mL。②苏木素染液的配制:苏木素1.0g、无水乙醇10mL、硫酸铝钾 20g、蒸馏水 200mL、氧化汞 0.5g。
1.2.4 试验方法。将手术标本使用中性甲醛固定,石蜡包埋,然后切成5μm厚的连续石蜡切片。两种染色方法的具体步骤分别如下。
1.2.4.1 HE染色。①切片常规脱蜡入水;②苏木素染色,自来水冲洗;1%盐酸酒精分色,自来水冲洗;伊红染色,自来水冲洗;梯度酒精脱水、二甲苯透明;③中性树胶封片。
1.2.4.2 免疫组织化学染色。①石蜡切片置于60℃烤箱中烤片2h,常规脱蜡入水;②置于枸橼酸缓冲液中微波炉抗原修复;③0.01PBS冲洗3min×3次;④3%过氧化氢37℃温箱孵育10min;⑤0.01PBS冲洗3min×3次;⑥滴加PDCD4,并用PBS取代一抗做空白对照,4℃冰箱过夜;⑦0.01PBS冲洗3min×3次;⑧滴加试剂1,37℃温箱孵育20min;⑨0.01PBS冲洗3min×3次;⑩滴加试剂 2,37℃温箱孵育 20min;⑪0.01PBS 冲洗 3min ×3次;⑫DAB室温显色2min,蒸馏水冲洗终止反应;⑬苏木素轻度复染细胞核,自来水冲洗;⑭梯度酒精脱水、二甲苯透明;⑮中性树胶封片,显微镜下观察免疫反应阳性结构的着色及分布情况。
1.3 实验结果判定 用PBS代替一抗作阴性对照,以已知阳性片作为阳性对照。细胞质内出现淡黄色至棕褐色颗粒为阳性染色。参考Monica等的半定量计数方法,根据肿瘤细胞的染色率进行判定。在400倍镜下选取5个视野,计数至少100个肿瘤细胞中PDCD4蛋白阳性表达细胞所占百分率。细胞阳性率<5%为0分,5% ~25%为1分,26% ~50%为2分,51% ~75%为3分,>75%为4分;最终得分取5个视野的平均值。规定0~4分为阴性,5~8分为阳性表达,9~12分为高表达。
1.4 统计学处理 应用SPSS 16.0软件,P值取双侧,P<0.05为具有统计学意义。PDCD4在NSCLC、癌旁组织中的表达及与NSCLC患者的临床病理特征的关系采用χ2检验。
2 结果
2.1 PDCD4在 NSCLC组织、癌旁组织中的表达 PDCD4在NSCLC、癌旁组织中的表达阳性率分别为33.3%、75.0%,癌及癌旁组织表达之间的差异具有统计学意义(P<0.01),见表1。癌较癌旁组织出现低表达和缺失(见图1~4)。
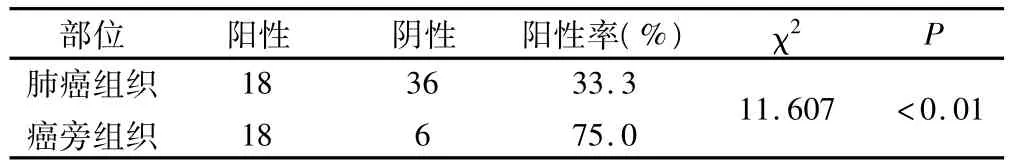
表1 PDCD4在肺癌组织、癌旁及正常组织中的表达(例)
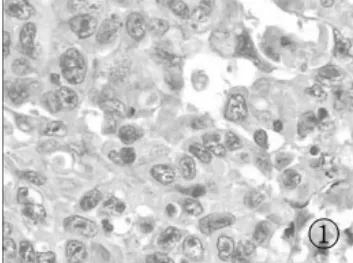
图1 鳞癌PDCD4的低表达(×400)
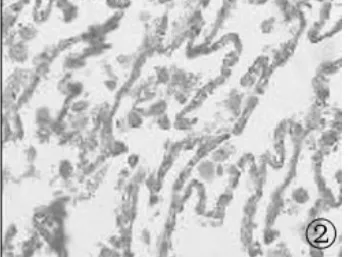
图2 正常组织PDCD4的表达(×400)

图3 腺癌PDCD4的表达缺失(×400)
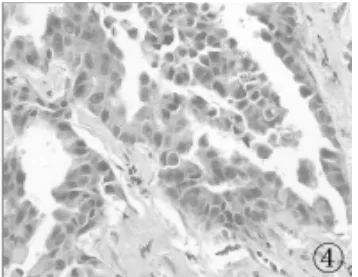
图4 腺癌DNMT1的高表达(×400)
2.2 PDCD4在NSCLC组织中的表达与TNM分期的关系情况见表2。
2.3 PDCD4的表达与NSCLC组织分化轻度的关系 PDCD4的表达与NSCLC组织分化程度有关,差异有统计学意义(P<0.05),低、中分化较高分化表达下降。见表3。
2.4 PDCD4的表达与NSCLC患者的性别、年龄、吸烟史、病理类型等临床特征的关系 除PDCD4表达在吸烟和不吸烟的患者之间差异有统计学意义外,其余差别均无统计学意义(P>0.05)。见表 4。

表2 PDCD4在肺癌组织中表达与TNM分期的关系(例)

表3 PDCD4表达与NSCLC组织分化程度的关系(例)
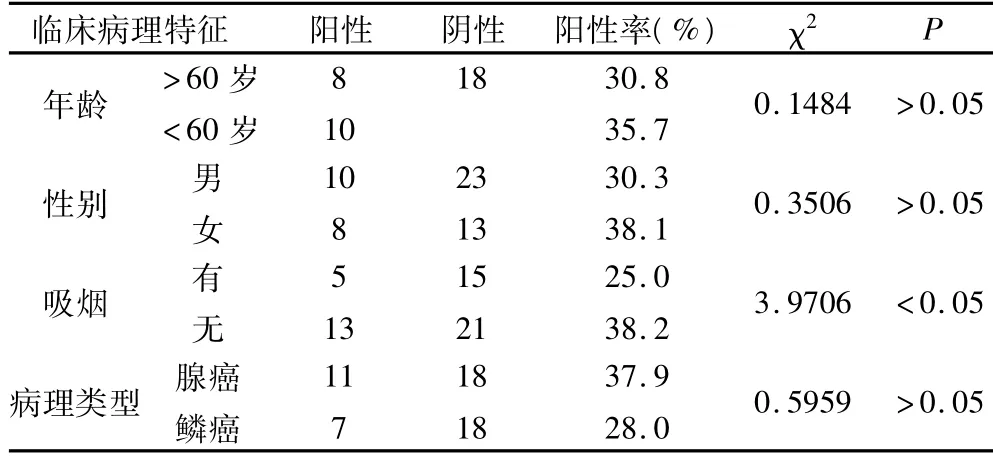
表4 PDCD4表达与NSCLC临床病理特征的关系(例)
3 讨论
PDCD4是新发现的与细胞凋亡有关的基因,通过一个保守的a螺旋MA-3结构与真核细胞翻译起始因子eIF4A发生结合,从而抑制核糖体复合物的形成和蛋白质的合成,促进细胞凋亡。PDCD4在人类组织中,例如:肝、肺、脑、食道等组织中都有表达。在大多数正常组织细胞中,PDCD4蛋白主要位于细胞核中,当细胞发生恶性增殖时,它可以通过NES转移到细胞浆中[3]。
在人类的多种恶性肿瘤如乳腺癌、肺癌、消化道肿瘤、脑胶质瘤、卵巢癌、皮肤癌、淋巴瘤、鼻咽癌等肿瘤组织中均发现PDCD4表达下降或缺失。Goke R等[4]研究证实了PDCD4作为CDK1/cdc2的间接抑制因子,在肺癌、乳腺癌、结肠癌和前列腺癌中的表达缺失。Jiang Y等[5]研究人体的肝癌细胞中的PDCD4的表达情况,并和周围正常组织进行对照,发现肝癌组织中呈现显著的低表达。Gao等[6]对手术切除的胶质瘤患者标本30例进行分析,结果提示,PDCD4mRNA、蛋白质相比癌旁组织表达频率均有不同程度缺失。
目前研究认为,PDCD4主要通过抑制肿瘤细胞转录和翻译过程抑制肿瘤的生长,但详细机制尚不清楚。核转录因子AP-1参与细胞的增殖、分化与转化过程[7],在肿瘤的形成、侵袭和转移中具有重要作用。PDCD4可能通过抑制AP-1的表达抑制肿瘤细胞的生长。其次PDCD4通过与翻译起始因子elF4A结合抑制蛋白质的翻译过程。突变分析表明,PDCD4MA-3区氨基或羧基末端发生突变后,与elF4A结合率降低约90%,从而不能竞争性抑制elF4G的结合,不能抑制翻译起始过程的进行,导致细胞过度增殖[8]。近来研究发现,微小RNA(miRNA)的异常表达与肿瘤的发生密切相关。在PDCD4mRNA的3'端非编码区存在着miR-21的结合位点,这个位点的功能能够调节PDCD4的水平[9]。Lund等[10]研究发现,在乳腺癌中,miR -21 下调靶基因PDCD4,促进了肿瘤细胞的转化。另外,PDCD4可能还通过影响细胞周期的进程[4],激活 PI3K-Akt-mTOR-p70S6K信号途径[11]等途径影响肿瘤的发生、发展。
本研究发现,PDCD4在NSCLC组织、癌旁组织中表达不同,分别为33.3%、75.0%,PDCD4在NSCLC中和正常肺组织相比存在着低表达和缺失,且两者相比差异有显著性。PDCD4表达缺失可能参与了NSCLC的发生和发展,可作为NSCLC的病理诊断的指标。Kalinichenko SV等[12]研究发现,在鳞癌标本中,PDCD4蛋白通常没有改变,甚至上调。本组研究结果与之不同,鳞癌患者PDCD4蛋白表达亦较正常组织有显著的减低。本组在有吸烟史的患者中PDCD4蛋白的表达阳性率为25.0%,无吸烟史的患者为38.2%,差异有统计学意义。是否与烟草中的毒性物质长期吸入影响肺癌组织中PDCD4的表达,从而促使细胞的恶性增殖,有待进一步研究。Chen Y等[2]研究认为,PDCD4表达丢失的患者肿瘤恶性程度较高,一般为Ⅲ期的患者。本组资料也提示PDCD4Ⅲ~Ⅳ期的患者PDCD4缺失率更高,与Ⅰ期、Ⅱ期相比差异有统计学意义,提示随着肿瘤的进展,PDCD4表达缺失率提高。而Ⅰ期和Ⅱ期相比差异无统计学意义。另外,分化差的癌组织PDCD4的缺失显著,本组病例中低、中和高分化的癌组织中PDCD4的表达分别为16.7%、29.0%、63.6%,低、中分化组较高分化组差异均有统计学意义。Chen Y等[2]通过对124例原发型肺癌的所有亚型进行免疫组化检测,得出结果:PDCD4表达丢失的患者肿瘤恶性程度较高,PDCD4表达丢失的患者术后随访病死率高于表达正常的患者。因此,PDCD4可作为NSCLC的一个预后指标。本组资料研究表明,在年龄≥60岁组和<60岁组、性别、组织类型之间PDCD4表达没有差异。
张霞等[13]在神经胶质瘤研究中成功地将重组PDCD4基因转染至U251细胞,细胞表达PDCD4后,其细胞增殖明显受到抑制。Gao F等[14]发现,在神经胶质瘤组织中恢复PDCD4基因的表达,能够抑制细胞增殖和复制能力,提示PDCD4基因的重新激活可以作为胶质瘤治疗的一种新的有效措施。因此,提高肿瘤PDCD4的表达,有可能成为NSCLC靶向治疗途径。
[1]Jansen AP,Camalier CE,Stark C,et a1.Characterization of programmed cell death 4 in multiple human cancers reveals a novel enhancer of drug sensitivity[J].Cancer Ther,2004,3(2):103
[2]Chen Y,Kn?sel T,Kristiansen G,et al.Loss of PDCD4 expression in human lung cancer correlates with tumour progression and prognosis[J].Patho,2003,200(5):640
[3]Bohm M,Sawicka K,Siebrasse JP,et a1.The transformation suppressor protein PDCD4 shuttles between nucleus and cytoplasm and binds RNA[J].Oncogene,2003,22(31):4905
[4]Goke R ,Barth P,Schmidt A,et al.Programmed cell death protein 4 suppresses CDK1/cdc2 via induction of p21(Waf1/Cip1)[J].Physiol Cell Physiol,2004,287(6):1541
[5]Jiang Y,Zhang SH,Han GQ,et al.Association of programmed cell death factor 4(PDCD4)with hepatocellular carcinoma and smoking in a Chinese male population[J].Int Med Res,2009,37(4):1179
[6]Gao F,Zhang P,Zhou C,et al.Frequent loss of PDCD4 expression in human Glioma:possible role in the tumorigenesis of glioma[J].Oncol Rep,2007,17(1):123
[7]Vogt PK.Jun the oncoprotein[J].Oncogene,2001,20(5):2365
[8]Goke A,Goke R,Knolle A,et a1.DUG is a novel homologue of translation initiation factor 4G that binds elF4A[J].Biochem Biophys Res Commun,2002,297(1):78
[9]Asangani IA,Rasheed SA,Nikolova DA,et al.MicroRNA -21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008,27:2128
[10]Lund E,Guffingers HJ,Calado A,et al.Nuclear export of precursors[J].Science,2004,303(5654):95
[11]陈晓林,姜志明.肿瘤发生过程中降解的靶分子-翻译抑制因子Pdcd4[J].中国现代实用医学杂志,2008,10(7):10
[12]Kalinichenko SV,Kopantzev EP,Korobko EV,et al.Pdcd4 protein and mRNA level alterations do not correlate in human lung tumors[J].Lung Cancer,2008,62(2):173
[13]张 霞,王晓燕,高 琦,等.PDCD4基因在胶质瘤细胞系的稳定表达及其对肿瘤细胞生长的影响[J].中国肿瘤生物治疗杂志,2008,15(4):347
[14]Gao F,Wang X,Zhu F,et al.PDCD4 gene silencing in gliomas is associated with 5'CpG island methylation and unfavorable prognosis[J].Cell.Mol,Med,2008,10(1111):1582

