纳米羟基磷灰石的镉离子吸附性能
石和彬,钟 宏,刘 羽,田 兴,顾金燕,鲁 斌
(1.中南大学化学化工学院,湖南 长沙 410081;2.武汉工程大学材料学院,湖北 武汉 430074;3 福州大学紫金矿业学院,福建 福州350108)
0 引 言
镉是生物毒性最强的重金属元素之一,主要表现为镉离子通过消化系统及呼吸道侵入人体后,可以在体内长期蓄积,对肾脏、肝脏、骨组织以及生殖系统等造成损伤,还可引发高血压及细胞癌变.镉离子在骨骼中会抑制成骨细胞的功能,引起骨骼软化与骨质疏松,导致骨痛病.20世纪中期日本神通川流域受到上游炼锌厂排放的含镉废水的污染,引发了导致数十人死亡的骨痛病,令世界为之震惊[1],而骨骼中的主要无机组分是发生了少量离子替换的羟基磷灰石[Ca10(PO4)6(OH)2, HA][2].
大量的研究表明,HA中的钙离子可以被多种二价金属离子取代,HA可以有效去除水溶液中的Cd2+、Pb2+等多种重金属离子,但是HA的Cd2+去除量远低于Pb2+,进一步改善HA的吸附性能具有较高的实用价值[2-4].现有研究表明,HA去除水溶液中Cd2+的过程包含多种固—液界面反应,一般用广义的吸附作用(sorption)来描述HA去除水溶液中Cd2+的机理,其基本特征是以离子交换为主,同时还包括表面络合、表面吸附以及溶解—沉淀等多种机制[2-4].由于Cd2+主要通过离子扩散与离子交换的形式被固化在HA的晶格中,避免了造成二次污染.HA可用于处理含Cd2+废水,以及Cd2+污染水体与土壤的原位修复,显示了良好的应用前景.
HA吸附水溶性Cd2+的性能主要取决于样品的结构特征与晶体化学性质,其Cd2+吸附量还与水溶液的成分、反应时间、温度、固液比等实验条件有关,其中pH的影响比较复杂[2-4].大量的研究表明HA的Cd2+吸附量主要受样品表面积的控制[2-5],因此,结晶粒度细、分散性好的纳米羟基磷灰石(n-HA)粉体具有较高的Cd2+吸附性能.本研究中采用经过了工艺优化的共沉淀法制备n-HA粉体,并对其Cd2+吸附性能进行表征,主要探讨溶液pH值、反应时间以及Cd2+初始浓度等因素对n-HA 样品Cd2+吸附量的影响,并对相关的动力学与热力学特征进行了讨论.
1 实验方法
1.1 样品的制备
以Ca(NO3)2·4H2O(AR)、H3PO4(AR)与氨水(AR)为主要原料,采用共沉淀法纳米HA[6].经过优化之后的工艺条件为,先将Ca(NO3)2与H3PO4配制成均匀的Ca-P溶液,其中[Ca2+] = 1 mol/L、n(Ca)/n(P)(mol/mol)为1.67,然后向Ca-P溶液中快速加入氨水至pH=10,所得悬浊液在60 ℃下陈化12 h.陈化过的悬浊液过滤、用蒸馏水洗涤至中性,再用无水乙醇(AR)洗涤后真空干燥24 h.样品经过研磨分散后过筛,取74 μm以下(-200目)备用.
1.2 样品的表征
采用粉晶X射线衍射(XRD)分析样品的物相组成特征,所用仪器为日本岛津公司生产的XRD-5A型X射线衍射仪(Cu靶Kα、Ni滤波).用美国产Pye Unicam SP3-300 IR型红外光谱仪(KBr压片)测定样品的红外谱.用日本电子公司产JSM-5510型扫描电镜(SEM)、荷兰FEI公司生产的Tecnai G2 20型透射电子显微镜(TEM)检测HA的粒度、形貌及分散性.
借助于瑞士研究委员会与战略性环境研究基金会支持开发的Visual MINTEQ(V2.61)软件,对Cd(NO3)2水溶液的化学特征进行了模拟计算.采用间歇法测试n-HA的Cd2+吸附性能.在实验过程中先把n-HA样品放入盛有10 mL三次蒸馏水的烧杯中,然后超声振荡至少3次,每次0.5 min,直到形成均匀的悬浊液,最后一次超声分散后马上把悬浊液倒入200 mL配制好的Cd(NO3)2溶液中进行Cd2+吸附实验.
实验在持续搅拌的条件下进行,基准实验条件是在200 mL Cd2+质量浓度为100 mg/L的水溶液中加入0.2 gHA,定时分析溶液中Cd2+的浓度,采用差减法计算磷灰石的Cd2+吸附量.采用双硫腙分光光度法测定滤液中Cd2+的含量[7],其精度可以达到0.001 mg.
1.3 Cd2+吸附反应过程的动力学与热力学分析
已有多种反应模型被用来描述吸附过程的动力学特征,在研究以离子交换为主的吸附反应过程时,准二级反应模型得到了比较广泛的应用,该模型的基础是吸附质与吸附剂之间产生了离子交换、化学键合或电子共用等化学吸附现象[8].由于HA去除水溶液中Cd2+的机理以离子交换为主,在本文中将主要应用该模型来分析磷灰石去除水溶液中Cd2+的动力学特征.HA吸附水溶液中的Cd2+的主要参数见表1.
在准二级反应模型中[8-10],Qe-qt被视为吸附反应的驱动力,其基本吸附反应动力学方程表示为:

(1)
对(1)式进行移项、积分变换、整理后可得到以下线性方程:
(2)
初期吸附速率表示为:
(3)
根据(2)式,t/qt与t为线性关系,因此可将实验得到的磷灰石的Cd2+吸附量随时间变化的数据按t/qt与t进行线性拟合,所得直线的斜率的倒数即为反应平衡时的吸附量Qe,截距的倒数即为初期吸附速率v0,再根据(3)式即可求出准二级动力学反应的吸附速率常数k2s.

表1 HA吸附水溶液中Cd2+的主要参数
在以往的研究中,Langmuir与Freundlich吸附等温式常被用来分析HA吸附Cd2+的行为[11-12],Langmuir等温吸附的线性方程表示为:
(4)
Freundlich等温吸附的线性方程为:
lnQe=lnKf+nlnCe
(5)
2 结果与讨论
2.1 纳米羟基磷灰石样品的基本特征
XRD及红外光谱分析的结果(图略)均证实所制备的样品为结晶粒度细小的HA,电子显微分析的结果表明所制备的样品为纳米级HA(图1),但是在采用SEM观察时表现为亚微米级的球形颗粒(图1a),说明在高浓度制备HA时,由于纳米粒子表面活性很高,HA粒子会产生自发的团聚.在制备TEM样时,对HA粉体进行了超声分散,在TEM中显示为分散性较好的纳米粒子,表现出比较典型的HA短柱状晶形(图1b).HA微球颗粒经过超声处理后明显解离,说明样品中的n-HA粒子以软团聚为主,因而在进行吸附试验时也对样品进行了超声分散预处理.

图1 羟基磷灰石样品的SEM(a)与TEM(b)照片Fig.1 SEM(a) and TEM(b) micrographs of hydroxyapatite sample
2.2 Cd2+在水溶液中的状态分析
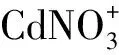

图2 Cd(NO3)2水溶液中各种成分的分布与pH的关系(C0=100 mg·L-1)Fig.2 Distribution of ionic species in Cd(NO3)2 solutions at different pH value
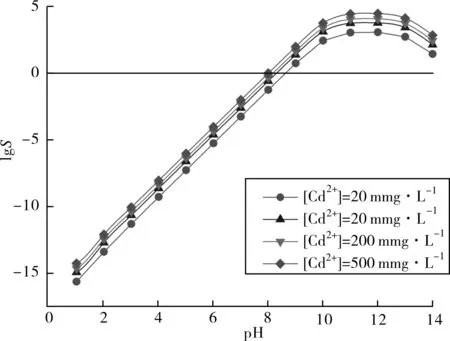
图3 Cd(NO3)2水溶液中Cd(OH)2的过饱和度(S)与pH值的关系Fig.3 Supersaturation(S) of Cd(OH)2 as a function of pH value
2.3 纳米羟基磷灰石的Cd2+吸附性能
2.3.1 溶液pH值的影响 在Cs=1 g·L-1,C0=100 mg·L-1,t=4 h时,实验结果(图4)表明,随着初始pH值的上升,HA的Cd2+吸附量总体呈上升趋势.当pH低于4时,由于HA溶解度增加,溶解出来的Ca2+抑制了HA对Cd2+的吸附,Cd2+吸附量明显下降.当pH介于5~8之间时,Cd2+吸附量随pH值呈非常缓慢的上升趋势,主要与HA表面的阴离子吸附活性位有关,随着pH值的上升,HA表面吸附的羟基相应增加[13],较高的表面负电荷促进了HA对Cd2+的吸附.当pH上升到10时,HA的Cd2+吸附量出现了比较明显的上升,除了与碱性条件下HA表面负电荷的增加有关以外,形成的Cd(OH)2沉淀也有贡献.因此,初始pH = 4~9时可以较好地反应HA的本征Cd2+吸附性能,在更强的酸性条件下不适宜直接使用HA处理含Cd2+废水,而在更强的碱性条件下,HA的Cd2+吸附量虽然增加,但介质条件的影响是一个重要因素.
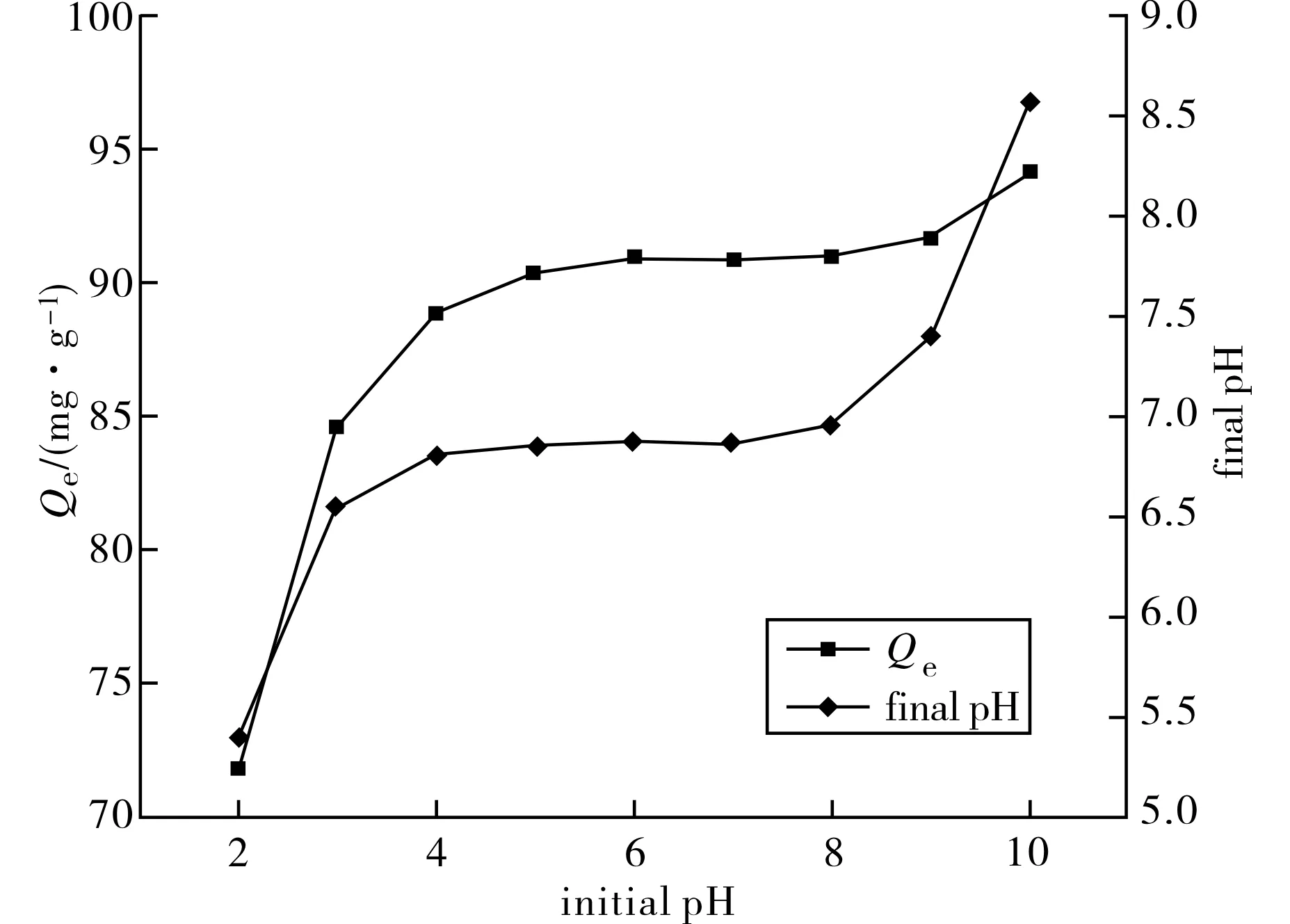
图4 pH值对n-HA Cd2+吸附量的影响 Fig.4 Effect of pH on the Cd2+ sorption capacity by n-HA
在n-HA处理含Cd2+废水的反应完成之后,溶液的pH值与初始值相比都有一定的变化(图4).HA本身为碱式盐、且具有两性吸附位,在pH值较低的酸性环境下,HA的溶解度提高,溶解出来的羟基可中和溶液中的质子,使溶液的pH值上升;而在pH较高的碱性环境下,HA中的阴离子吸附位可通过吸附羟基降低溶液的pH值,HA在酸性条件下释放羟基、在碱性条件下则吸附羟基,起到了一种类似缓冲剂的作用[14-15].在初始pH值为3~10时,反应完成后的最终pH值都介于6~9之间,符合我国污水排放标准(GB8978-1996)的规定[16],说明HA在处理含Cd2+废水时具有较广泛的适应性.
2.3.2 反应时间的影响 在Cs= 1 g·L-1,C0= 100 mg·L-1的条件下,测试n-HA的Cd2+吸附量随反应时间的变化特征.实验结果(图5)表明,在反应2 h之后HA的Cd2+吸附量已趋于稳定,n-HA去除水溶液中Cd2+的过程可以分为较为清晰的两个阶段.在第一阶段n-HA的Cd2+吸附量快速上升,而在第二个阶段HA的Cd2+吸附量上升变缓、直到趋于平衡,具有二级反应的基本特征.

图5 n-HA的Cd2+吸附量与反应时间的关系Fig.5 The amount of sorbed Cd2+ by n-HA as a function of time
根据(2)式所示的准二级动力学反应线性方程,对实验结果进行线性拟合(图6),得到的结果为R2=0.999、RSS=0.001 78,截距为0.031 0±0.004 17,斜率为0.011 0±8.81×10-6.这种极高的拟合程度与相关报导的结果是一致的[11-12],说明了HA去除水溶液中Cd2+的反应过程符合准二级反应动力学模型具有一定的普遍性.根据线性拟合所得到的截距及斜率,可以算出k2s=0.003 88 g·mg-1·min-1,反应平衡时HA的Cd2+吸附量Qe=91.2 mg·g-1,初始吸附速率V0=34.3 mg·g-1·min-1.由此可以看出,采用n-HA去除水溶液中的Cd2+时,不仅吸附量较高、而且初期的吸附反应很快,说明由于n-HA的粒度极细,有利于Cd2+快速扩散到HA晶格中,并与Ca2+发生离子交换.

图6 n-HA吸附Cd2+的准二级反应动力学模型的线性拟合Fig.6 Linear fit of pseudo-second-order kinetic model for Cd2+ sorbed by n-HA
2.3.3 初始Cd2+浓度的影响 在n-HA的用量为1 g·L-1、室温下反应4 h,随着Cd2+初始质量浓度从1 mg·L-1提高到1 000 mg·L-1,样品的Cd2+吸附量也逐渐增加,同时残留Cd2+的质量浓度也不断上升(图7).n-HA的Cd2+吸附量最高为262.9 mg·g-1,当Cd2+初始质量浓度小于10 mg·L-1时,残留的Cd2+质量浓度低于0.1 mg·L-1,达到了我国污水排放综合标准[16]的要求.
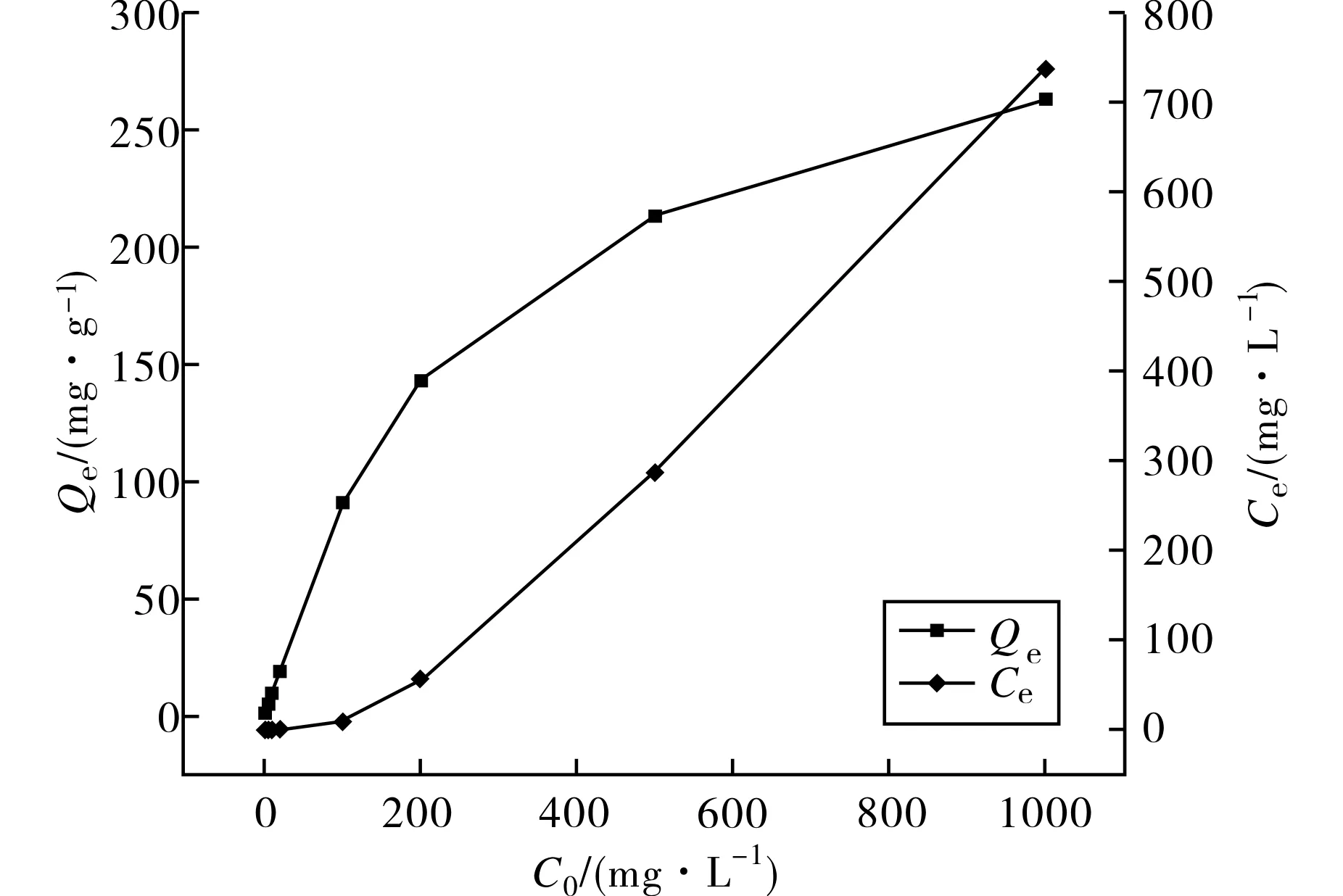
图7 Cd2+初始质量浓度对n-HA的Cd2+吸附性能的影响Fig.7 Effect of the initial concentration of Cd2+ on the Cd2+ sorption properties by n-HA
根据(4)式与(5)式,分别用Ce/Qe对Ce、lnQe对lnCe作图(图8、图9),然后进行线性拟合.根据线性拟合的结果(表2),可计算出Langmuir等温吸附模型中n-HA的最大Cd2+吸附量Xm=261.8 mg·g-1,Langmuir吸附常数K=0.056 3 L·g-1;Freundlich等温吸附常数Kf=20.4,n=0.458.

表2 等温吸附线性模拟结果
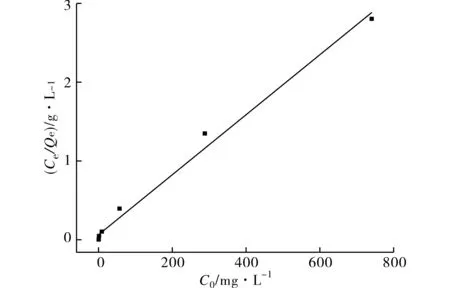
图8 n-HA吸附Cd2+的Langmuir吸附等温线Fig.8 Linear fit of Langmuir isotherm model for sorption of Cd2+ by n-HA
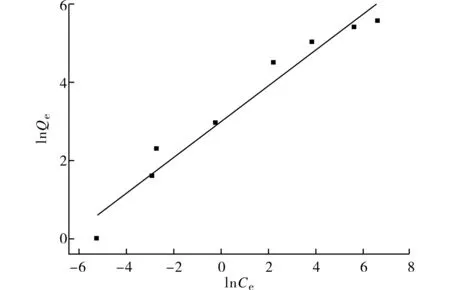
图9 n-HA吸附Cd2+的Freundlich吸附等温线Fig.9 Linear fit of Freundlich isotherm for sorption of Cd2+ by n-HA
HA去除水溶液中Cd2+的行为与Langmuir等温吸附模型表现出了高度的相关性,但是Langmuir吸附本来是用于描述单分子层吸附的[9-10],能否采用Langmuir等温吸附模型来研究HA去除水溶液中Cd2+的行为,引起了一些学者的讨论.由于HA吸附Cd2+的过程对水溶液pH值有明显的影响,在吸附实验中,一种方法是对溶液pH值不进行人为控制,溶液的pH值会随着反应的进行而发生一定的变化(图4),这其实不符合等温吸附的基本前提;另一种方法是在反应过程中通过滴加酸或碱的方式使溶液的pH值保持稳定,显然这又会对HA吸附Cd2+的行为产生影响[17-19].从严格意义上来讲,无法获得准确的HA去除水溶液中Cd2+的等温吸附模型[18].因此,可以把Langmuir方程仅仅当成一种实验数据拟合的工具,主要用于分析、比较吸附量以及吸附速率等反应吸附特征的指标,而不再与具体的吸附反应机理相关联[18].
长期以来,人们对HA去除水溶液中Cd2+的反应其机理已进行了大量的研究,通过实验观测、计算机模拟等方法,从晶体化学、HA-水溶液界面化学以及反应热力学等多种角度,阐明了水溶液中的Cd2+交换HA晶格中的Ca2+属于一种自发过程,而且Cd2+会优先替代处于HA结构通道周围的Ca2+.HA与水溶液中的Cd2+进行离子交换不仅在热力学上是有利的,而且在晶体结构上也是可行的[20-24].虽然吸附反应动态过程的一些细节仍然不是很清楚,但是以离子交换作用为主的观点已获得了比较充分的证据以及广泛的认可.因此,尽管HA去除水溶液中Cd2+的反应不是严格意义上的等温吸附过程,但是用准二级反应动力学模型以及Langmuir等温吸附模型来拟合HA吸附水溶液中Cd2+的过程有其内在的合理性,反映了以离子交换为主的特点.n-HA去除水溶液中Cd2+的过程与Freundlich等温吸附式也显示了较高的相关性,反映了吸附过程中离子交换、表面络合等化学吸附为主的特征.
由于Cd2+与Ca2+的半径极为相近,采用常规测试手段难以准确描述HA吸附Cd2+的动态过程.要获得HA吸附水溶液中Cd2+的确切机制,可能需要借助于高分辨力扫描探针显微术原位分析Cd2+在HA表面的吸附特性,并采用同步辐射高能XRD技术或者中子衍射技术揭示Cd2+在HA内的准确占位及其动态过程.
3 结 语
经过优化工艺条件之后,采用正滴共沉淀法制备出来的n-HA石粉体具有良好的Cd2+吸附性能.其Cd2+吸附量在溶液初始pH为4~9的范围内基本稳定,反应完全后溶液pH介于6~9之间.n-HA 去除水溶液中的Cd2+具有反应速度快、吸附量高等特点,是一种具有良好应用前景的环境功能材料.n-HA 吸附Cd2+的反应过程符合准二级动力学模型,与Langmuir等温吸附和Freundlich等温吸附均表现出良好的相关性,反映了吸附机理以离子交换为主的特点.
参考文献:
[1] 廖国礼,吴超. 资源开发环境重金属污染与控制[M]. 长沙:中南大学出版社,2005:21-23.
[2] 黄志良,刘羽,胥焕岩,等. 磷灰石矿物材料[M]. 北京:化学工业出版社,2008:180-242.
[3] 刘羽,彭明生. 磷灰石在废水治理中的应用[J]. 安全与环境学报,2001,1(1):9-12.
[4] Monteil-Rivera F, Fedoroff M. Sorption of inorganic species on apatites from aqueous solutions[C]//Somasundaran P and Hubbard A eds. Encyclopedia of Surface and Colloid Science. London: Taylor & Francis Group, 2006:5700-5725.
[5] Da Rocha N C C, De Campos R C, Rossi A M, et al. Cadmium uptake by hydroxyapatite synthesized in different conditions and submitted to thermal treatment[J]. Environmental Science and Technology, 2002, 36(7): 1630-1635.
[6] Shi HB, Zhong H, Liu Y, et al. Effect of precipitation method on stoichiometry and morphology of hydroxyapatite nanoparticles[J]. Key Engineering Materials, 2007, 330:271-274.
[7] 国家环境保护局.GB 7471-1987 水质镉的测定双硫腙分光光度法[S].北京:中国标准出版社,1987.
[8] Qiu H,Lv L,Pan B, et al. Critical review in adsorption kinetic models[J]. Journal of Zhejiang University Science A, 2009,10(5):716-724.
[9] Ho Y S, McKay G. Pseudo-second order model for sorption processes[J]. Process Biochemistry,1999,34:451-465.
[10] Ho Y S. Review of second-order models for adsorption systems[J]. Journal of Hazard Materials, 2006, 136(3): 103-111.
[11] Smiciklas I, Onjia A, Raicevic S, et al. Factors influencing the removal of divalent cations by hydroxyapatite[J]. Journal of Hazard Materials, 2008, 152(2): 876-884.
[12] Fernane F, Mecherri M O, Sharrock P, et al. Sorption of cadmium and copper ions on natural and synthetic hydroxylapatite particles[J]. Materials Characterization, 2008, 59(5): 554-559.
[13] Tanaka H. Surface structure and properties of synthetic and modified calcium hydroxyapatite[C]//Somasundaran P and Hubbard A eds. Encyclopedia of Surface and Colloid Science. London: Taylor & Francis Group, 2006:6005-6017.
[14] Mandjiny S, Zouboulis A I, Matis K A, et al. Removal of cadmium from dilute solutions by hydroxyapatite. I. Sorption studies[J]. Separation Science and Technology,1995,30(15):2963-2978.
[15] Jeanjean J,Fedoroff M,Faverjon F, et al. Influence of pH on the sorption of cadmium ions on calcium hydroxyapatite[J]. J Materials Science,1996,30:6156-6160.
[16] 国家环境保护局.GB8978-1996 污水综合排放标准[S].北京:中国标准出版社,1997.
[20] Zhu K, Yanagisawa K, Shimanouchi R, et al. Preferential occupancy of metal ions in the hydroxyapatite solid solutions synthesized by hydrothermal method[J]. Journal of European Ceramic Society, 2006, 26(4~5): 509-513
[21] Tamm T, Peld M. Computational study of cation substitutions in apatites[J]. J ournal of Solid State Chemistry, 2006, 179: 1580-1586
[22] Matsunaga K, Murata H, Shitara K. Theoretical calculations of the thermodynamic stability of ionic substitutions in hydroxyapatite under an aqueous solution environment[J]. J ournal of Physics: Condensed Matter, 2010, 22, 384210
[23] Terra J, Gonzalez GB, Rossi AM, et al. Theoretical and experimental studies of substitution of cadmium into hydroxyapatite[J]. Physical Chemistry and Chemical Physics, 2010, 12(47): 15490-15500
[24] Zhang Z, Li M, Chen W, et al. Immobilization of lead and cadmium from aqueous solution and contaminated sediment using nano-hydroxyapatite[J]. Environmental Pollution, 2010, 158: 514-519.

