环氧树脂改性聚氨酯羟基组分的合成及应用
张良均,王光于,刘 洋
(武汉工程大学绿色化工过程省部共建教育部重点实验室,湖北 武汉 430074)
0 引 言
水泥混凝土路面产生缺陷时会影响车辆的安全行驶,需要及时对道路进行修补.为了尽可能地节省成本,缩短道路维修时间,可以采用高聚物注浆技术进行维修[1],利用聚氨酯快速发泡固化和耐压强度大的优点,实现道路的快速修补.传统的硬泡聚氨酯道路修补材料和普通路基基材的抗压强度等力学性能大致相同,在国外已被用于道路修补[2].但是,纯聚氨酯材料对于路基的粘接作用较弱,仅仅通过物理挤压填充路基.环氧树脂固化体系中含有大量的环氧基、羟基、醚键等基团[3],具有优异的粘接性能和机械性能[4],而且其使用工艺十分灵活,因而被应用于浇注料、胶粘剂、模压材料、涂料、复合材料和注射成型材料,在国民经济的许多领域中发挥着重要的作用[5-7].
利用环氧树脂改性聚氨酯的方法主要包括物理共混法和化学共聚法[8].虽然物理共混法和化学共聚法可以成功地将环氧树脂引入聚氨酯体系中,但并不能直接提高聚氨酯材料的界面粘接性能.如果能够将粘接性能优良的环氧树脂链段分布于泡沫材料和基材的接触面之间,将有利于提高聚氨酯泡沫材料的界面粘接性能.
环氧基的化学性质活泼,在酸或碱的催化作用下,均容易发生开环反应生成加成产物.针对传统的聚氨酯泡沫材料存在的粘接性能问题,本实验利用二乙醇胺的仲胺活泼氢原子使环氧树脂的两端的环氧基开环,制备具有端羟基和叔胺结构的开环环氧树脂.然后将其涂敷于发泡模具的内表面,与聚氨酯白料和稍过量的聚氨酯黑料混合后发泡成型.从而提高改性材料的界面粘接性能.
1 实验部分
1.1 主要原料和仪器设备

表1 原料与试剂Table 1 Raw materials and reagents

表2 实验仪器及设备Table 2 Instruments and apparatus
1.2 实验原理及方法
1.2.1 开环反应 实验原理:在布伦斯特碱或路易斯碱的作用下,环氧乙烷会发生亲和取代反应,生成相应的开环产物[9].环氧树脂的端环氧基可以与二乙醇胺(路易斯碱)发生开环反应生成端羟基的环氧树脂:
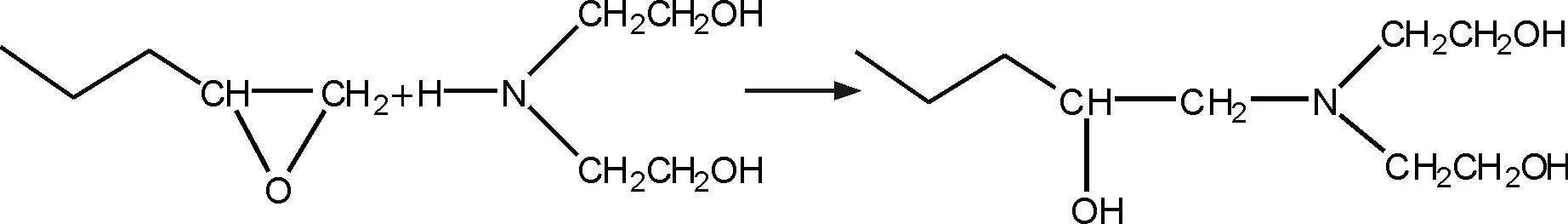
实验步骤:称取19.6 g环氧树脂(0.05 mol),将其搅拌溶解于10 g溶剂丁酮中,然后加入250 mL三口烧瓶中.再称取5.3 g二乙醇胺(0.05 mol),将其搅拌溶解于10 g溶剂丁酮后加入三口烧瓶,将反应混合物预热至40 ℃,搅拌使其混合均匀.利用反应放出的热量使体系的温度升高至70 ℃,通过调节油浴温度,使得体系的温度维持在70 ℃左右.搅拌反应4 h后, 再称取5.3 g二乙醇胺(0.05 mol)溶于3 g丁酮后加入三口烧瓶中,调节油浴温度,使体系温度维持在70 ℃左右.继续反应4 h后结束,收集制得的无色透明的产物.在反应过程中分别取2、3、4、6、7、8 h的产物,分别测定其环氧值(100 g树脂中所含环氧基的物质的量).
1.2.2 产物环氧值的测定 盐酸丙酮法是测定环氧树脂环氧值的常用方法之一,该法操作一般适用于测量分子量在1 500以下的环氧树脂的环氧值[10].
实验原理:在丙酮溶剂中,过量的盐酸会与环氧基反应生成氯醇.待盐酸与环氧基充分反应后,用标准氢氧化钠溶液滴定过量的盐酸.然后再进行不添加树脂的空白试验,通过两次试验消耗盐酸的差值以及环氧树脂的用量即可计算出该试样的环氧值.反应的化学方程式如下:

实验步骤:准确称取2.0 ~ 4.0 g(精确到0.01 g)开环反应产物并将其加入250 mL三口烧瓶中.用移液管从容量瓶中移取25 mL盐酸-丙酮溶液(1 mL密度为1.19 g/mL浓盐酸溶于25 mL丙酮中),然后加入三口烧瓶中.升温至35 ℃,搅拌,反应反应4 h后将产物转移至磨口塞的锥形瓶中.用0.2 mol/L NaOH溶液滴定(滴加3滴酚酞作为指示剂)至微红色,半分钟后不褪色即为滴定终点.同样操作不加树脂做一组空白实验.按照以下公式计算试样的环氧值:
式中:EV——试样的环氧值,mol(100 g);V0——空白实验消耗的NaOH标准溶液体积,mL;V1——试样消耗的NaOH标准溶液体积,mL;CNaOH——标定所得的NaOH标准溶液的摩尔浓度,mol/L;m——试样的质量,g.
1.2.3 发泡实验与性能测试a. 发泡实验:先将约2.5 g端羟基环氧树脂均匀地涂敷于发泡模具的内表面,再把经过预热的8.5 g聚氨酯白料倒入模具内中.然后加入10 g的聚氨酯黑料,搅拌混合均匀.静置数分钟,使其发泡并固化成型.
b. 凝胶时间与固化时间测试:发泡组分混合后泛白至泡沫高度不再上升经过的时间记为凝胶时间.分别测定纯聚氨酯和环氧树脂改性聚氨酯的凝胶时间.发泡完成至呈硬质泡沫经过的时间称为固化时间.分别测定纯聚氨酯和环氧树脂改性聚氨酯的固化时间.
c. 体积膨胀比测试:称取一定质量的聚氨酯黑料、白料,将两组份混合搅拌后倒入100 mL量筒,发泡完成后,记录泡沫体积,按下式计算体积膨胀比.

式中:m-聚氨酯总质量,V-聚氨酯泡沫体积.
d. 粘接强度测试:先将约2.5 g端羟基环氧树脂与先预热至60 ℃的8.5 g聚氨酯白料在模具内混合成均匀.然后加入10 g的聚氨酯黑料,搅拌混合均匀.趁热取少量发泡混合物,按GB/T 7124-1986胶粘剂拉伸剪切强度测定方法[11]测定改性发泡材料的粘接强度,各测定7组数据取其平均值.
2 结果与讨论
2.1 反应产物的红外表征
比较端羟基环氧树脂和环氧树脂的红外光谱图(见图1)可以发现,915 cm-1处的环氧基特征吸收峰消失,表明大量的环氧基参与了反应.羟基的红外吸收峰处于 3 650~3 200 cm-1之间,而产物的红外光谱图3 400 cm-1左右处的吸收峰增强变宽,说明环氧基的开环反应引入了羟基,而且其峰形宽而钝,说明新引入的端羟基可能发生了一定程度的缔合.综上,红外表征结果说明:在70 ℃,反应时间8 h等工艺条件下,端环氧基与二乙醇胺的活泼氢发生了反应,生成了端羟基环氧树脂.
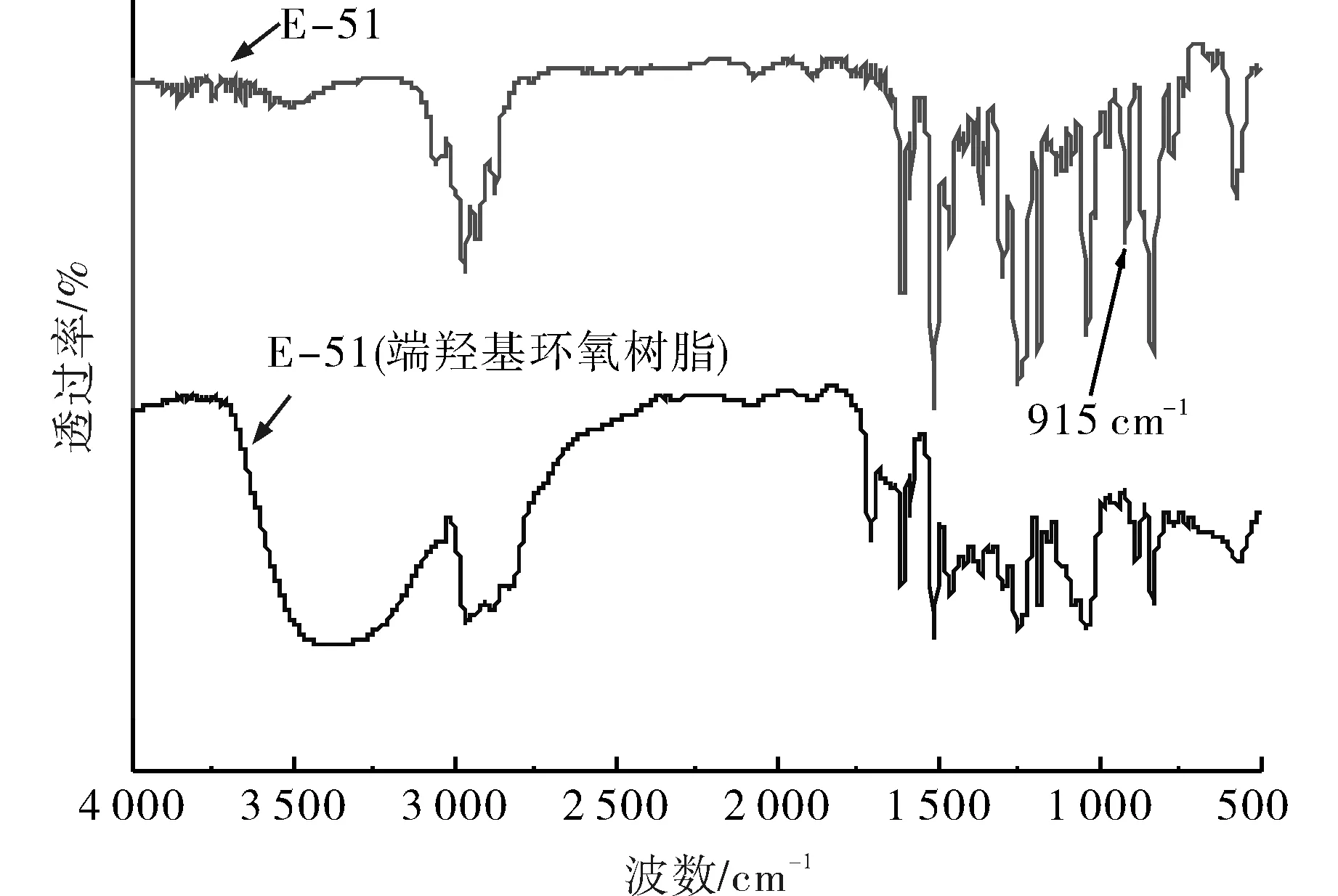
图1 环氧树脂与端羟基环氧树脂的红外光谱图Fig.1 FT-IR of epoxy resin and epoxy resin with terminal hydroxyl
2.2 反应动力学分析
由于在反应开始时和反应进行4 h时分别进行了二乙醇胺加料,所以在反应的0~4 h和4~8 h表现出了相似的环氧值变化趋势,如图2、表3所示.
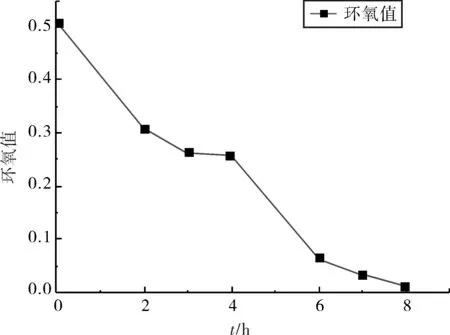
图2 环氧值-反应时间关系曲线Fig.2 Epoxy value-time graph
在反应时间为0和4 h时分别进行了二乙醇胺加料.为使反应物充分反应,在加料后的第一个小时,即1和5 h时未取样测定环氧值.

表3 实验结果汇总表Table 3 Summary table of experimental data
将0、2、3 h时的环氧基度取自然对数后与反应时间进行线性回归,回归系数为R2=0.999 92.
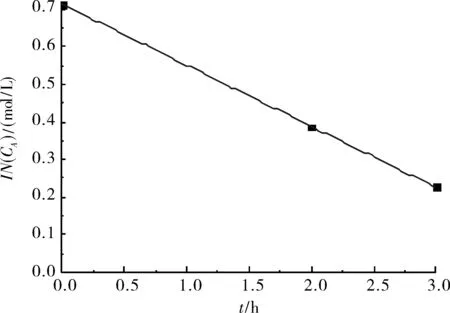
图3 Ln(CA)-T关系图Fig.3 Ln(CA)-time graph
Ln(CA)与时间T近乎呈直线关系,即:Ln(CA)= -0.162 21·T+0.712 74(见图3).
所得实验数据表明:在反应开始的前三小时内,环氧基与二乙醇胺的反应近似为一级反应.其速率常数k=0.162 21 h-1,半衰期t1/2= Ln2/k= 4.273 4 h.动力学理论分析表明:当二乙醇胺完全反应,过量反应物(环氧基团)消耗掉一半时,所需要的理论反应时间为4.273 4 h.
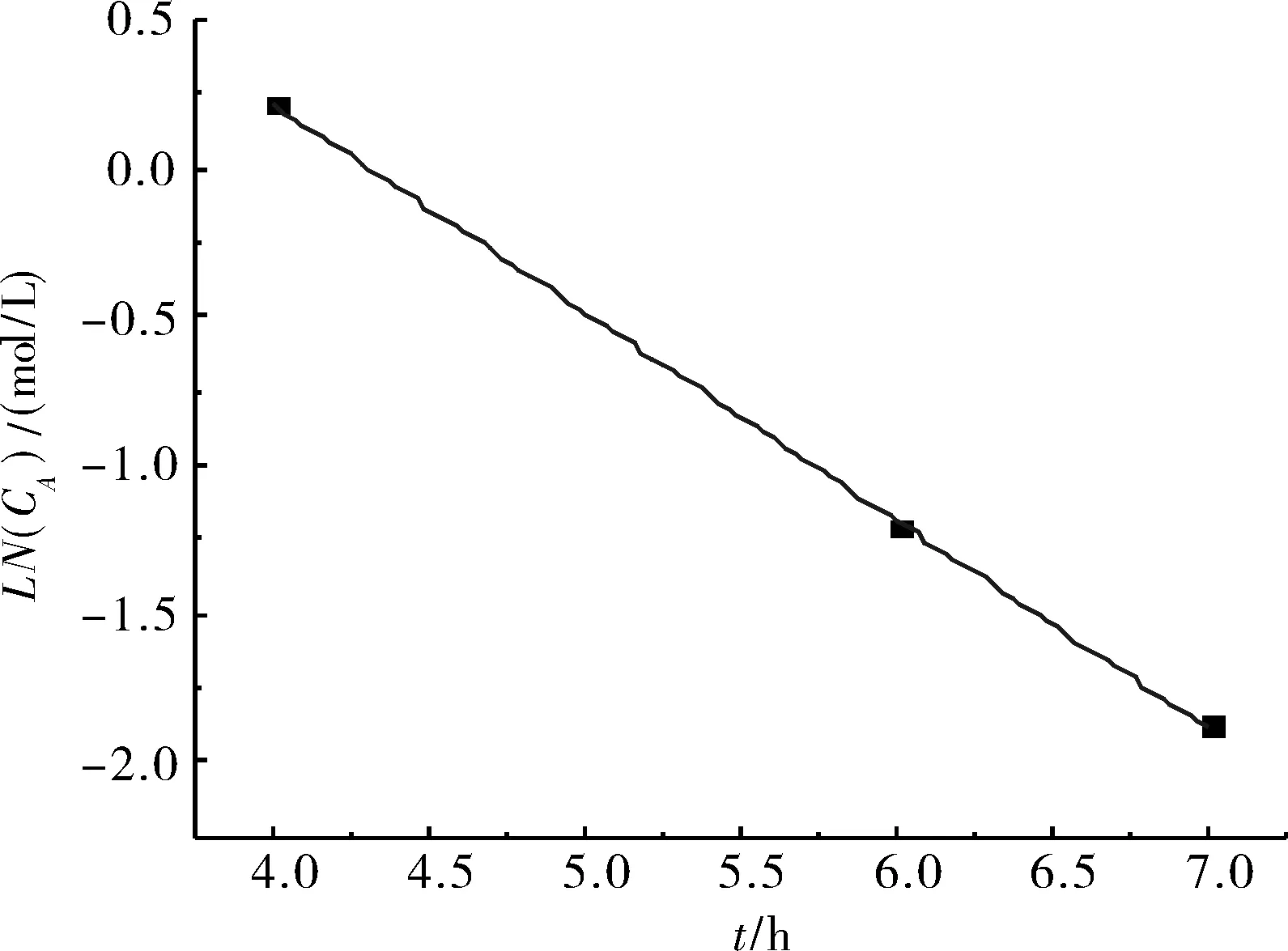
图4 Ln(CA)-T关系图Fig.4 Ln(CA)-time graph
同理,将4、6、7 h时的环氧基度取自然对数后与反应时间进行线性回归,回归系数R2=0.999 54.Ln(CA)与时间T近乎呈直线关系,即:Ln(CA)= -0.700 2·T+3.009 21(见图4).
所得实验数据表明:在第二次加入二乙醇胺后的前三小时内,环氧基与二乙醇胺的反应也近似为一级反应.其速率常数k=0.700 2 h-1,半衰期t1/2= Ln2/k= 0.989 9 h.3 h后的反应速率逐渐偏离一级反应的线性关系,且呈下降趋势.动力学理论分析表明:反应时间越长,二乙醇胺反应得越充分,所得开环产物的环氧值越小.当反应时间趋向于无穷大时,产物的环氧基浓度趋向于0.
2.3 盐酸-丙酮法反应过程的分析
在用盐酸-丙酮法测定产物(同时含有环氧基和叔胺基)环氧值时,会出现“pH缓慢上升期”,即随着NaOH标准溶液的滴入,被测物的pH值会经历一段缓慢上升的过程,近乎掩盖了pH的突跃.
理论推理:过量的盐酸不仅会使环氧基充分反应,还可能与叔胺基团反应生成叔胺盐酸盐.在之后的滴定过程中,过量的氢氧化钠会与叔胺盐酸盐作用,生成氯化钠和水,同时重新游离出叔胺基团.即中和滴定得到水和氯化钠的同时,还不断生成弱碱性的叔胺,因此在滴定过程中会出现pH缓慢上升期的现象.
实验验证:用0.20 mol/L的标准NaOH溶液滴定产物(端羟基环氧树脂与纯环氧树脂的混合物);同样操作进行一组空白实验.以酚酞为指示剂,半分钟微红色不褪去为滴定终点.滴定过程中用pH计测量溶液的pH变化情况,然后分别记录溶液pH值和消耗NaOH溶液的体积,绘制pH-VNaOH曲线.如图5、6所示.
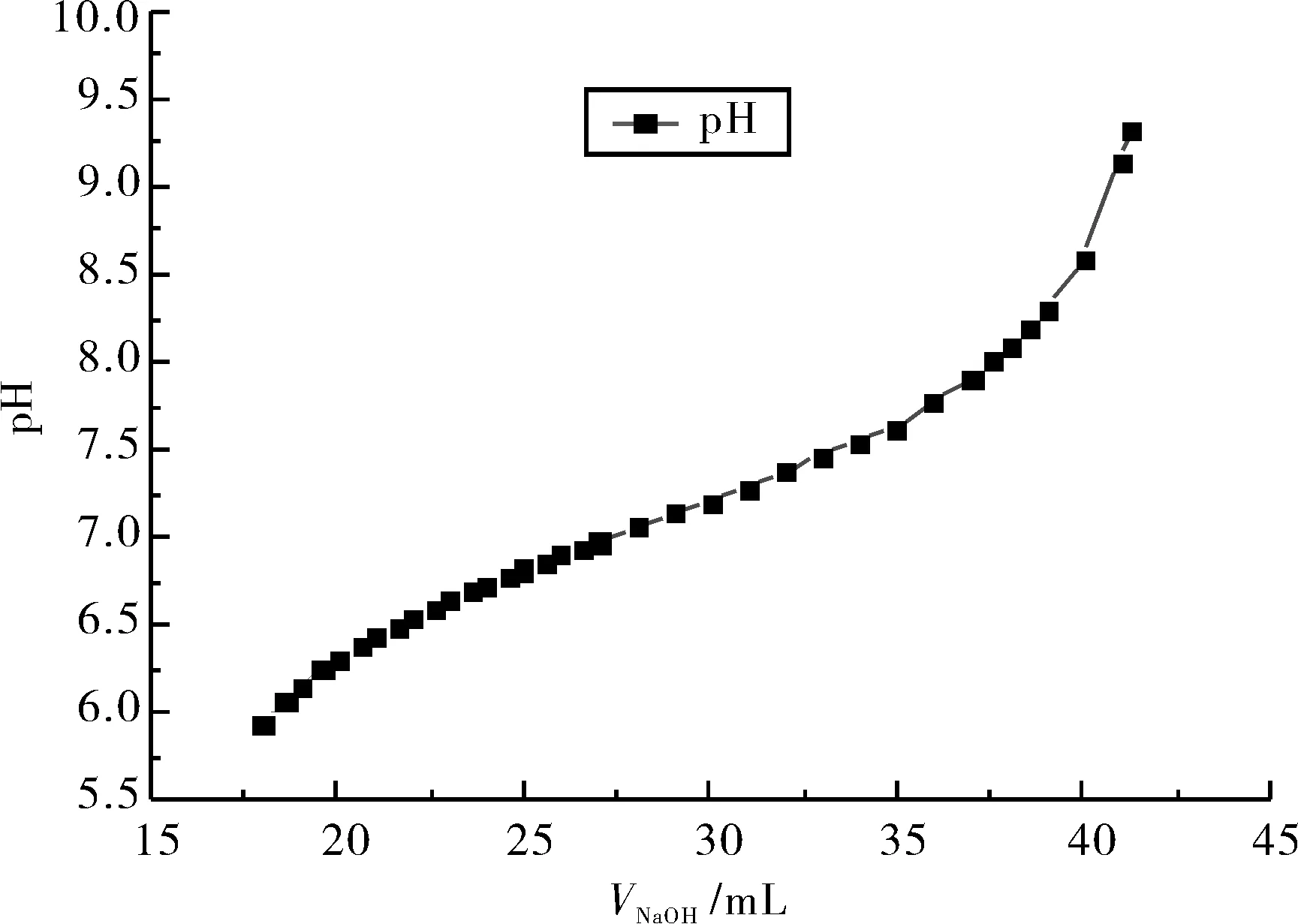
图5 pH-VNaOH曲线A(产物)Fig.5 pH-VNaOH graph ( reaction product)

图6 pH-VNaOH曲线BFig.6 pH-VNaOH graph
通过对比可以发现:在空白实验中,滴入47.2 mL NaOH溶液后,溶液的pH发生了显著的突跃.但是在产物的滴定过程中,溶液的pH值缓慢增加,以至于无法明显地观察到pH的突跃过程.进一步观察产物的pH-VNaOH曲线A发现:pH在升高接近中性后,出现了一段pH缓慢上升的时期.因此,滴定实验中验证了pH缓慢上升的理论预测.
2.4 改性发泡材料的性能测试
2.4.1 发泡实验配方 配方见表4、5.

表4 发泡实验配方ATable 4 Foaming formula composition A

表5 发泡实验配方BTable 5 Foaming formula composition B
2.4.2 凝胶时间与固化时间 对比配方A(聚氨酯)和配方B(环氧树脂改性聚氨酯)的凝胶时间和固化时间可以发现,将端羟基环氧树脂引入聚氨酯发泡体系,可以缩短发泡聚氨酯的凝胶时间与固化时间.由于引入了多官能度的端羟基环氧树脂(环氧树脂的主链上也存在一定量的羟基),使得聚氨酯发泡体系的凝胶时间与固化时间均有所下降(见表6).

表6 凝胶时间与固化时间表Table 6 Gel time and curing time
2.4.3 体积膨胀比 对比配方A(聚氨酯)和配方B(环氧树脂改性聚氨酯)的体积膨胀比可以发现,由于引入了多官能度的端羟基环氧树脂,使得改性聚氨酯发泡后的体积小于纯聚氨酯的体积;因此,改性聚氨酯的体积膨胀比大于纯聚氨酯的体积膨胀比(见表7).

表7 体积膨胀比表Table 7 Volumetric change and volume expansion ratio
2.4.4 拉伸剪切强度 对比聚氨酯和环氧树脂改性聚氨酯的最大负荷P与拉伸剪切强度τ的平均值,可以发现环氧树脂链段的引入可以在一定程度上提高聚氨酯发泡材料的拉伸剪切强度.最大负荷与拉伸剪切强度的提高可能与聚氨酯用量、粘接面间环氧链段含量等因素有关(见表8、9).

表8 搭接面尺寸表Table 8 Faying surface dimensions

表9 最大负荷与拉伸剪切强度Table 9 Peak load and shear-tensile strength
3 结 语
本研究首先合成了端羟基环氧树脂.确定了反应温度70 ℃,反应时间8 h,二乙醇胺二次加料,过量反应物环氧树脂一次加料的制备工艺.环氧基的全程转化率约为94.7%.由于产物含有叔胺结构,在环氧值测定过程中出现了pH缓慢上升的过程.相关实验结果表明:环氧树脂改性聚氨酯具有凝胶、固化快,体积膨胀比较大的特点.环氧树脂链段的引入可以在一定程度上提高聚氨酯发泡材料的拉伸剪切强度.
参考文献:
[1] 石明生,马小跃,王复明.高聚物注浆技术在水泥混凝土道路维修中的应用[J].涂料工业, 2008, 38(5): 23-26.
[2] 薛海蛟.高性能硬质聚氨酯泡沫塑料的制备及性能研究[D].北京:北京化工大学材料科学与工程学院, 2009:22.
[3] 闫福安,张良均,樊庆春,等. 涂料树脂合成及应用[M].北京:化学工业出版社,2008: 158.
[4] Chen Yong, Yang Shu, Shi Hai Yang, et al. Preparation of cationic waterborne epoxy resin and its curing properties [J]. Paint & Coatings Industry, 2008, 38(5): 23-26.
[5] Li Jin, Zhang Linag Jun, Tong Shen yi, et al. Study on properties and preparation of waterborne epoxy resin emulsion [J]. Paint & Coatings Industry, 2008, 38(1): 44-46.
[6] 陈宇飞,郭艳宏,戴亚杰.聚合物基复合材料[M].北京:化学工业出版社,2010: 76.
[7] Chun Wu Hong, Chang Ri Chen, Jung Ouhsin, et al. Case study on prevention of fire hazards in coating epoxy-based FRP work with illumination [J]. Journal of Loss Prevention in the Process Industries, 2010, 23: 346-350.
[8] 王帅,谢建良.环氧树脂改性聚氨酯乳液的研究进展[J]. 四川化工,2010(3):20.
[9] 徐寿昌. 有机化学[M].北京:高等教育出版社,1983:240.
[10] 李桂林.环氧树脂与环氧涂料[M].北京:化学工业出版社,2003:102-105.
[11] 中华人民共和国国家标准局. GB/T 7124-1986胶粘剂拉伸剪切强度测定方法[S].北京:中国标准出版社,1986.

